El metabolismo del hierro humano es el conjunto de reacciones químicas que mantienen la homeostasis humana del hierro a nivel sistémico y celular. El hierro es necesario para el cuerpo y potencialmente tóxico. Controlar los niveles de hierro en el cuerpo es una parte de importancia crítica para muchos aspectos de la salud y la enfermedad humana. Los hematólogos han estado especialmente interesados en el metabolismo sistémico del hierro , porque el hierro es esencial para los glóbulos rojos , donde se encuentra la mayor parte del hierro del cuerpo humano. Comprender el metabolismo del hierro también es importante para comprender las enfermedades de sobrecarga de hierro , como la hemocromatosis hereditaria , y la deficiencia de hierro , como la anemia ferropénica .

El hierro es un bioelemento esencial para la mayoría de las formas de vida, desde las bacterias hasta los mamíferos . Su importancia radica en su capacidad para mediar la transferencia de electrones. En el estado ferroso (Fe 2+ ), el hierro actúa como donador de electrones , mientras que en el estado férrico (Fe 3+ ) actúa como aceptor . Así, el hierro juega un papel vital en la catálisis de las reacciones enzimáticas que implican transferencia de electrones (reducción y oxidación, redox ). Las proteínas pueden contener hierro como parte de diferentes cofactores , como los clústeres hierro-azufre (Fe-S) y los grupos hemo , ambos ensamblados en las mitocondrias .
Las células humanas necesitan hierro para obtener energía en forma de ATP a partir de un proceso de varios pasos conocido como respiración celular, más específicamente a partir de la fosforilación oxidativa en las crestas mitocondriales . El hierro está presente en el grupo hierro-azufre y en los grupos hemo de las proteínas de la cadena de transporte de electrones que generan un gradiente de protones que permite que la ATP sintasa sintetice ATP ( quimiosmosis ).
Los grupos hemo forman parte de la hemoglobina , una proteína que se encuentra en los glóbulos rojos y que sirve para transportar el oxígeno desde los pulmones a otros tejidos. Los grupos hemo también están presentes en la mioglobina para almacenar y difundir el oxígeno en las células musculares.
El cuerpo humano necesita hierro para transportar oxígeno. El oxígeno (O 2 ) es necesario para el funcionamiento y la supervivencia de casi todos los tipos de células. El oxígeno se transporta desde los pulmones al resto del cuerpo unido al grupo hemo de la hemoglobina en los glóbulos rojos. En las células musculares, el hierro une el oxígeno a la mioglobina , que regula su liberación.
El hierro también es potencialmente tóxico. Su capacidad de donar y aceptar electrones significa que puede catalizar la conversión de peróxido de hidrógeno en radicales libres . Los radicales libres pueden causar daño a una amplia variedad de estructuras celulares y, en última instancia, matar la célula. [1]
El hierro unido a proteínas o cofactores como el hemo es seguro. Además, prácticamente no hay iones de hierro verdaderamente libres en la célula, ya que forman complejos con facilidad con moléculas orgánicas. Sin embargo, parte del hierro intracelular está unido a complejos de baja afinidad y se denomina hierro lábil o hierro "libre". El hierro en dichos complejos puede causar daños como los descritos anteriormente. [2]
Para evitar ese tipo de daño, todas las formas de vida que utilizan hierro unen los átomos de hierro a las proteínas . Esta unión permite que las células se beneficien del hierro al tiempo que limita su capacidad de causar daño. [1] [3] Las concentraciones intracelulares típicas de hierro lábil en las bacterias son de 10 a 20 micromolar, [4] aunque pueden ser diez veces más altas en un entorno anaeróbico, [5] donde los radicales libres y las especies reactivas de oxígeno son más escasas. En las células de los mamíferos, las concentraciones intracelulares de hierro lábil son típicamente menores a 1 micromolar, menos del 5 por ciento del hierro celular total. [2]
.jpg/440px-E._coli_Bacteria_(7316101966).jpg)
En respuesta a una infección bacteriana sistémica, el sistema inmunológico inicia un proceso conocido como "retención de hierro". Para que las bacterias sobrevivan, deben obtener hierro de su entorno. Las bacterias que causan enfermedades lo hacen de muchas maneras, incluyendo la liberación de moléculas que se unen al hierro llamadas sideróforos y luego reabsorbiéndolas para recuperar el hierro, o extrayendo el hierro de la hemoglobina y la transferrina . Cuanto más tienen que trabajar las bacterias para obtener hierro, mayor es el precio metabólico que deben pagar. Eso significa que las bacterias privadas de hierro se reproducen más lentamente. Por lo tanto, el control de los niveles de hierro parece ser una defensa importante contra muchas infecciones bacterianas. Ciertas especies de bacterias han desarrollado estrategias para eludir esa defensa; las bacterias que causan tuberculosis pueden residir dentro de los macrófagos , que presentan un entorno rico en hierro, y Borrelia burgdorferi utiliza manganeso en lugar de hierro. Las personas con mayores cantidades de hierro, como, por ejemplo, en la hemocromatosis, son más susceptibles a algunas infecciones bacterianas. [6]
Aunque este mecanismo es una respuesta elegante a una infección bacteriana de corta duración, puede causar problemas cuando se prolonga tanto que el cuerpo se ve privado del hierro necesario para la producción de glóbulos rojos. Las citocinas inflamatorias estimulan al hígado para que produzca la proteína hepcidina , reguladora del metabolismo del hierro , que reduce el hierro disponible. Si los niveles de hepcidina aumentan debido a fuentes no bacterianas de inflamación, como una infección vírica, cáncer, enfermedades autoinmunes u otras enfermedades crónicas, puede producirse la anemia de la enfermedad crónica . En este caso, la retención de hierro en realidad perjudica la salud al impedir la fabricación de suficientes glóbulos rojos que contengan hemoglobina. [3]

La mayoría de las personas bien nutridas en los países industrializados tienen de 4 a 5 gramos de hierro en sus cuerpos (~38 mg de hierro/kg de peso corporal para las mujeres y ~50 mg de hierro/kg de peso corporal para los hombres). [7] De esto, aproximadamenteLa hemoglobina necesaria para transportar oxígeno a través de la sangre contiene 2,5 g (alrededor de 0,5 mg de hierro por ml de sangre), [8] y la mayor parte del resto (aproximadamente 2 gramos en hombres adultos y algo menos en mujeres en edad fértil) está contenida en complejos de ferritina que están presentes en todas las células, pero son más comunes en la médula ósea, el hígado y el bazo . Las reservas de ferritina del hígado son la principal fuente fisiológica de hierro de reserva en el cuerpo. Las reservas de hierro en los países industrializados tienden a ser menores en los niños y las mujeres en edad fértil que en los hombres y en los ancianos. Las mujeres que deben usar sus reservas para compensar el hierro perdido durante la menstruación , el embarazo o la lactancia tienen reservas corporales no hemoglobinológicas más bajas, que pueden consistir en500 mg , o incluso menos.
Del contenido total de hierro del cuerpo, aproximadamenteSe destinan 400 mg a las proteínas celulares que utilizan el hierro para procesos celulares importantes como el almacenamiento de oxígeno (mioglobina) o la realización de reacciones redox productoras de energía ( citocromos ). Una cantidad relativamente pequeña (3-4 mg) circula a través del plasma , unida a la transferrina. [9] Debido a su toxicidad, el hierro soluble libre se mantiene en baja concentración en el cuerpo.
La deficiencia de hierro afecta primero a las reservas de hierro del organismo, y se cree que la disminución de estas reservas es relativamente asintomática, aunque se han asociado con ella algunos síntomas vagos e inespecíficos . Dado que el hierro es necesario principalmente para la hemoglobina, la anemia ferropénica es la principal manifestación clínica de la deficiencia de hierro. Las personas con deficiencia de hierro sufrirán o morirán a causa de daños en los órganos mucho antes de que sus células se queden sin el hierro necesario para los procesos intracelulares, como el transporte de electrones.
Los macrófagos del sistema reticuloendotelial almacenan hierro como parte del proceso de descomposición y procesamiento de la hemoglobina de los glóbulos rojos engullidos. El hierro también se almacena como un pigmento llamado hemosiderina , que es un depósito poco definido de proteína y hierro, creado por los macrófagos cuando hay exceso de hierro, ya sea local o sistémicamente, por ejemplo, entre las personas con sobrecarga de hierro debido a la destrucción frecuente de células sanguíneas y las transfusiones necesarias que requiere su condición. Si se corrige la sobrecarga de hierro sistémica, con el tiempo la hemosiderina es reabsorbida lentamente por los macrófagos.
La homeostasis del hierro en el ser humano se regula en dos niveles diferentes. Los niveles sistémicos de hierro se equilibran mediante la absorción controlada del hierro de la dieta por parte de los enterocitos , las células que recubren el interior de los intestinos , y la pérdida incontrolada de hierro por desprendimiento epitelial, sudor, lesiones y pérdida de sangre. Además, el hierro sistémico se recicla continuamente. Los niveles de hierro celular se controlan de forma diferente por los distintos tipos de células debido a la expresión de determinadas proteínas reguladoras y transportadoras de hierro.

La absorción del hierro de la dieta es un proceso variable y dinámico. La cantidad de hierro absorbido en comparación con la cantidad ingerida es típicamente baja, pero puede variar desde el 5% hasta el 35% dependiendo de las circunstancias y el tipo de hierro. La eficiencia con la que se absorbe el hierro varía según la fuente. Generalmente, las formas de hierro que mejor se absorben provienen de productos animales. La absorción del hierro de la dieta en forma de sal de hierro (como en la mayoría de los suplementos) varía un poco según la necesidad de hierro del cuerpo, y generalmente se encuentra entre el 10% y el 20% de la ingesta de hierro. La absorción del hierro de productos animales, y algunos productos vegetales, se realiza en forma de hierro hemo, y es más eficiente, permitiendo una absorción de entre el 15% y el 35% de la ingesta. El hierro hemo en los animales proviene de la sangre y las proteínas que contienen hemo en la carne y las mitocondrias, mientras que en las plantas, el hierro hemo está presente en las mitocondrias de todas las células que utilizan oxígeno para la respiración.
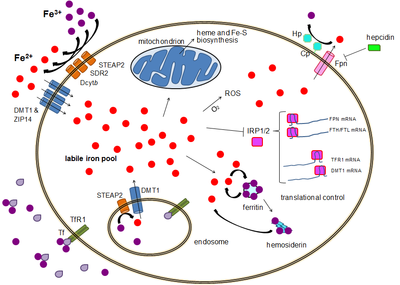
Al igual que la mayoría de los nutrientes minerales, la mayor parte del hierro absorbido de los alimentos digeridos o suplementos es absorbido en el duodeno por los enterocitos del revestimiento duodenal. Estas células tienen moléculas especiales que les permiten transportar el hierro al cuerpo. Para ser absorbido, el hierro de la dieta puede absorberse como parte de una proteína como la proteína hemo o el hierro debe estar en su forma ferrosa Fe 2+ . Una enzima reductasa férrica en el borde en cepillo de los enterocitos , el citocromo B duodenal ( Dcytb ), reduce el Fe 3+ férrico a Fe 2+ . [10] Una proteína llamada transportador de metal divalente 1 ( DMT1 ), que puede transportar varios metales divalentes a través de la membrana plasmática, luego transporta el hierro a través de la membrana celular del enterocito hacia la célula. Si el hierro está unido al hemo, es transportado a través de la membrana apical por la proteína transportadora de hemo 1 (HCP1). [11] El hemo es luego catabolizado por la hemo oxigenasa microsomal en biliverdina , liberando Fe 2+ . [12]
Estas células del revestimiento intestinal pueden entonces almacenar el hierro como ferritina , lo que se logra mediante la unión del Fe2 + a la apoferritina (en cuyo caso el hierro abandonará el cuerpo cuando la célula muera y se deseche en las heces ), o la célula puede liberarlo en el cuerpo a través del único exportador de hierro conocido en los mamíferos, la ferroportina . La hephaestina , una ferroxidasa que puede oxidar Fe2 + a Fe3 + y se encuentra principalmente en el intestino delgado, ayuda a la ferroportina a transferir hierro a través del extremo basolateral de las células del intestino. Tras su liberación en el torrente sanguíneo, el Fe3 + se une a la transferrina y circula a los tejidos. Por el contrario, la ferroportina es reprimida postraduccionalmente por la hepcidina , una hormona peptídica de 25 aminoácidos. El cuerpo regula los niveles de hierro regulando cada uno de estos pasos. Por ejemplo, los enterocitos sintetizan más Dcytb, DMT1 y ferroportina en respuesta a la anemia por deficiencia de hierro. [13] La absorción de hierro de la dieta aumenta en presencia de vitamina C y disminuye con el exceso de calcio, zinc o manganeso. [14]
La tasa de absorción de hierro del cuerpo humano parece responder a una variedad de factores interdependientes, entre ellos las reservas totales de hierro, el grado en que la médula ósea produce nuevos glóbulos rojos, la concentración de hemoglobina en la sangre y el contenido de oxígeno en la sangre. El cuerpo también absorbe menos hierro durante los períodos de inflamación , con el fin de privar a las bacterias de hierro. Descubrimientos recientes demuestran que la regulación de la ferroportina por la hepcidina es responsable del síndrome de anemia de las enfermedades crónicas.
La mayor parte del hierro del cuerpo se almacena y recicla mediante el sistema reticuloendotelial, que descompone los glóbulos rojos viejos. A diferencia de la absorción y el reciclaje del hierro, no existe un mecanismo regulador fisiológico para excretarlo . Las personas pierden una cantidad pequeña pero constante por la pérdida de sangre gastrointestinal, la sudoración y el desprendimiento de células de la piel y del revestimiento mucoso del tracto gastrointestinal . La cantidad total de pérdida para las personas sanas en el mundo desarrollado asciende a un promedio estimado de1 mg al día para los hombres y 1,5–2 mg al día para las mujeres con períodos menstruales regulares. [15] Las personas con infecciones parasitarias gastrointestinales, más comunes en los países en desarrollo, a menudo pierden más. [1] Aquellos que no pueden regular la absorción lo suficientemente bien sufren trastornos de sobrecarga de hierro. En estas enfermedades, la toxicidad del hierro comienza a sobrepasar la capacidad del cuerpo para fijarlo y almacenarlo. [16]
La mayoría de los tipos de células absorben el hierro principalmente a través de la endocitosis mediada por receptores a través del receptor 1 de transferrina (TFR1), el receptor 2 de transferrina (TFR2) y la GAPDH . El TFR1 tiene una afinidad 30 veces mayor por el hierro unido a la transferrina que el TFR2 y, por lo tanto, es el principal actor en este proceso. [17] [18] La enzima glucolítica multifuncional de orden superior gliceraldehído-3-fosfato deshidrogenasa (GAPDH) también actúa como receptor de transferrina. [19] [20] El hierro férrico unido a la transferrina es reconocido por estos receptores de transferrina, lo que desencadena un cambio conformacional que causa endocitosis. Luego, el hierro ingresa al citoplasma desde el endosoma a través del importador DMT1 después de ser reducido a su estado ferroso por una reductasa de la familia STEAP. [21]
Como alternativa, el hierro puede ingresar a la célula directamente a través de importadores de cationes divalentes de la membrana plasmática, como DMT1 y ZIP14 (proteína 14 similar a Zrt-Irt). [22] Nuevamente, el hierro ingresa al citoplasma en estado ferroso después de ser reducido en el espacio extracelular por una reductasa como STEAP2, STEAP3 (en glóbulos rojos), Dcytb (en enterocitos) y SDR2. [21]
El hierro también puede entrar en las células a través de CD44 en complejos unidos al ácido hialurónico durante la transición epitelial-mesenquimal (EMT). En este proceso, las células epiteliales se transforman en células mesenquimales y se desprenden de la membrana basal , a la que normalmente están ancladas, lo que allana el camino para que las células mesenquimales móviles recientemente diferenciadas comiencen a migrar fuera de la capa epitelial. [23] [24]
Si bien la EMT desempeña un papel crucial en procesos fisiológicos como la implantación , donde permite al embrión invadir el endometrio para facilitar la unión placentaria , su desregulación también puede impulsar la propagación maligna de tumores, permitiéndoles invadir los tejidos circundantes y establecer colonias distantes ( metástasis ). [24]
Las células malignas suelen presentar una mayor demanda de hierro, lo que alimenta su transición hacia un estado mesenquimal más invasivo. Este hierro es necesario para la expresión de genes mesenquimales, como los que codifican el factor de crecimiento transformante beta (TGF-β), crucial para la EMT. Cabe destacar que la capacidad única del hierro para catalizar la desmetilación de proteínas y ADN desempeña un papel vital en este proceso de expresión genética. [23]
Las vías convencionales de captación de hierro, como las que utilizan el receptor 1 de transferrina (TfR1), a menudo resultan insuficientes para satisfacer estas elevadas demandas de hierro en las células cancerosas. Como resultado, varias citocinas y factores de crecimiento desencadenan la regulación positiva de CD44, una molécula de superficie capaz de internalizar el hierro unido al complejo de hialuronano. Esta vía alternativa, que se basa en la endocitosis mediada por CD44, se convierte en el mecanismo de captación de hierro dominante en comparación con la ruta tradicional dependiente de TfR1. [23] [24]
En el citoplasma, el hierro ferroso se encuentra en un estado soluble y quelable que constituye el fondo de hierro lábil (~0,001 mM). [25] En este fondo, se cree que el hierro está unido a compuestos de baja masa como péptidos, carboxilatos y fosfatos, aunque algunos podrían estar en forma libre e hidratada ( iones de agua ). [25] Alternativamente, los iones de hierro podrían estar unidos a proteínas especializadas conocidas como metalochaperonas . [26] Específicamente, las proteínas de unión a poli-r(C) PCBP1 y PCBP2 parecen mediar la transferencia de hierro libre a la ferritina (para almacenamiento) y enzimas de hierro no hemo (para uso en catálisis). [22] [27] El fondo de hierro lábil es potencialmente tóxico debido a la capacidad del hierro para generar especies reactivas de oxígeno. El hierro de este fondo puede ser absorbido por las mitocondrias a través de la mitoferrina para sintetizar grupos Fe-S y grupos hemo. [21]
El hierro se puede almacenar en la ferritina como hierro férrico debido a la actividad ferroxidasa de la cadena pesada de ferritina. [28] La ferritina disfuncional puede acumularse como hemosiderina , lo que puede ser problemático en casos de sobrecarga de hierro. [29] El depósito de hierro almacenado en la ferritina es mucho más grande que el depósito de hierro lábil, y su concentración varía de 0,7 mM a 3,6 mM. [25]
La exportación de hierro ocurre en una variedad de tipos de células, incluyendo neuronas , glóbulos rojos, macrófagos y enterocitos. Los dos últimos son especialmente importantes ya que los niveles sistémicos de hierro dependen de ellos. Sólo hay un exportador de hierro conocido, la ferroportina . [30] Transporta hierro ferroso fuera de la célula, generalmente ayudado por ceruloplasmina y/o hephaestina (principalmente en enterocitos), que oxidan el hierro a su estado férrico para que pueda unirse a la ferritina en el medio extracelular. [21] La hepcidina causa la internalización de ferroportina, disminuyendo la exportación de hierro. Además, la hepcidina parece regular a la baja tanto TFR1 como DMT1 a través de un mecanismo desconocido. [31] Otro jugador que ayuda a la ferroportina a efectuar la exportación de hierro celular es GAPDH. [32] Una isoforma específica modificada postraduccionalmente de GAPDH se recluta en la superficie de las células cargadas de hierro, donde recluta apotransferrina en estrecha proximidad a la ferroportina para quelar rápidamente el hierro extruido. [33]

La expresión de hepcidina, que sólo ocurre en ciertos tipos de células como los hepatocitos , está estrechamente controlada a nivel transcripcional y representa el vínculo entre la homeostasis celular y sistémica del hierro debido al papel de la hepcidina como "guardián" de la liberación de hierro de los enterocitos al resto del cuerpo. [21] Los eritroblastos producen eritroferrona , una hormona que inhibe la hepcidina y aumenta así la disponibilidad de hierro necesaria para la síntesis de hemoglobina. [35]
Aunque existe cierto control a nivel transcripcional, la regulación de los niveles celulares de hierro está controlada en última instancia a nivel traduccional por las proteínas de unión a elementos sensibles al hierro IRP1 y especialmente IRP2. [36] Cuando los niveles de hierro son bajos, estas proteínas pueden unirse a elementos sensibles al hierro (IRE). Los IRE son estructuras de tallo y bucle en las regiones no traducidas (UTR) del ARNm. [21]
Tanto la ferritina como la ferroportina contienen un IRE en sus UTR 5', de modo que en caso de deficiencia de hierro su traducción es reprimida por IRP2, impidiendo la síntesis innecesaria de proteína de almacenamiento y la exportación perjudicial de hierro. Por el contrario, TFR1 y algunas variantes de DMT1 contienen IRE en el UTR 3', que se unen a IRP2 en caso de deficiencia de hierro, estabilizando el ARNm, lo que garantiza la síntesis de importadores de hierro. [21]

La deficiencia de hierro funcional o real puede deberse a diversas causas, que pueden agruparse en varias categorías:
El organismo es capaz de reducir sustancialmente la cantidad de hierro que absorbe a través de la mucosa, pero no parece ser capaz de detener por completo el proceso de transporte de hierro. Además, en situaciones en las que el exceso de hierro daña el revestimiento intestinal (por ejemplo, cuando los niños comen una gran cantidad de comprimidos de hierro producidos para el consumo de adultos), puede entrar aún más hierro en el torrente sanguíneo y causar un síndrome de sobrecarga de hierro potencialmente mortal. Grandes cantidades de hierro libre en la circulación causarán daños a células críticas en el hígado, el corazón y otros órganos metabólicamente activos.
La toxicidad del hierro se produce cuando la cantidad de hierro circulante excede la cantidad de transferrina disponible para unirse a él, pero el cuerpo es capaz de regular vigorosamente su absorción de hierro. Por lo tanto, la toxicidad del hierro por ingestión suele ser el resultado de circunstancias extraordinarias, como el consumo excesivo de comprimidos de hierro [1] [42], en lugar de variaciones en la dieta . El tipo de toxicidad aguda por ingestión de hierro causa graves daños en las mucosas del tracto gastrointestinal, entre otros problemas.
El exceso de hierro se ha relacionado con mayores tasas de enfermedad y mortalidad. Por ejemplo, los pacientes con cáncer de mama con baja expresión de ferroportina (que conduce a mayores concentraciones de hierro intracelular) sobreviven durante un período de tiempo más corto en promedio, mientras que la expresión alta de ferroportina predice un 90% de supervivencia a 10 años en pacientes con cáncer de mama. [43] De manera similar, las variaciones genéticas en los genes transportadores de hierro que se sabe que aumentan los niveles séricos de hierro también reducen la esperanza de vida y el número promedio de años pasados con buena salud. [44] Se ha sugerido que las mutaciones que aumentan la absorción de hierro, como las responsables de la hemocromatosis (ver más abajo), fueron seleccionadas durante el Neolítico ya que proporcionaban una ventaja selectiva contra la anemia por deficiencia de hierro. [45] El aumento de los niveles sistémicos de hierro se vuelve patológico en la vejez, lo que apoya la noción de que la pleiotropía antagónica o "hiperfunción" impulsa el envejecimiento humano. [44]
La toxicidad crónica del hierro suele ser el resultado de síndromes de sobrecarga de hierro más crónicos asociados con enfermedades genéticas, transfusiones repetidas u otras causas. En tales casos, las reservas de hierro de un adulto pueden alcanzar 50 gramos (10 veces el hierro corporal total normal) o más. Las enfermedades más comunes de sobrecarga de hierro son la hemocromatosis hereditaria (HH), causada por mutaciones en el gen HFE , y la enfermedad más grave hemocromatosis juvenil (JH), causada por mutaciones en hemojuvelina ( HJV ) [46] o hepcidina ( HAMP ). Los mecanismos exactos de la mayoría de las diversas formas de hemocromatosis adulta, que constituyen la mayoría de los trastornos genéticos de sobrecarga de hierro, siguen sin resolverse. Por lo tanto, si bien los investigadores han podido identificar mutaciones genéticas que causan varias variantes adultas de hemocromatosis, ahora deben centrar su atención en la función normal de estos genes mutados.