El glioxal es un compuesto orgánico con la fórmula química OCH2CHO. Es el dialdehído más pequeño (un compuesto con dos grupos aldehído ). Es un sólido cristalino, blanco a bajas temperaturas y amarillo cerca del punto de fusión (15 °C). El líquido es amarillo y el vapor es verde. [2]
El glioxal puro no se encuentra comúnmente porque el glioxal se maneja generalmente como una solución acuosa al 40% (densidad cercana a 1,24 g/mL). Forma una serie de hidratos , incluidos oligómeros . Para muchos propósitos, estos oligómeros hidratados se comportan de manera equivalente al glioxal. El glioxal se produce industrialmente como precursor de muchos productos. [3]
El glioxal fue preparado y nombrado por primera vez por el químico germano-británico Heinrich Debus (1824-1915) al reaccionar etanol con ácido nítrico . [4] [5]
El glioxal comercial se prepara mediante la oxidación en fase gaseosa de etilenglicol en presencia de un catalizador de plata o cobre (el proceso Laporte) o mediante la oxidación en fase líquida de acetaldehído con ácido nítrico . [3]
La primera fuente comercial de glioxal se encontraba en Lamotte , Francia, y comenzó en 1960. La fuente comercial más grande es BASF en Ludwigshafen , Alemania , con alrededor de 60.000 toneladas por año. También existen otros sitios de producción en los EE. UU. y China. El glioxal comercial a granel se fabrica y se informa como una solución al 40% en agua en peso [3] (aproximadamente una relación molar de glioxal a agua de 1:5).
El glioxal se puede sintetizar en el laboratorio mediante la oxidación del acetaldehído con ácido selenioso [6] o mediante ozonólisis del benceno . [7]
El glioxal anhidro se prepara calentando hidratos de glioxal sólidos con pentóxido de fósforo y condensando los vapores en una trampa fría . [8]
La constante de la ley de Henry del glioxal determinada experimentalmente es:

Los productos finales de glicación avanzada (AGE) son proteínas o lípidos que se glucosilan como resultado de una dieta rica en azúcar. [10] Son un biomarcador implicado en el envejecimiento y el desarrollo o empeoramiento de muchas enfermedades degenerativas , como la diabetes , la aterosclerosis , la enfermedad renal crónica y la enfermedad de Alzheimer . [11]
Las bases de guanina en el ADN pueden sufrir una glicación no enzimática por acción del glioxal para formar aductos de glioxal-guanina. [12] Estos aductos pueden producir enlaces cruzados en el ADN . La glicación del ADN también puede provocar mutaciones , roturas del ADN y citotoxicidad . [13] En los seres humanos, los nucleótidos glicosilados con glioxal pueden ser reparados por la proteína DJ-1, también conocida como Park7. [13]
Los acabados de papel y textiles recubiertos utilizan grandes cantidades de glioxal como agente de reticulación para formulaciones a base de almidón . Se condensa con urea para producir 4,5-dihidroxi-2-imidazolidinona, que reacciona con formaldehído para dar el derivado bis(hidroximetil) dimetilol etileno urea , que se utiliza para tratamientos químicos de la ropa que resisten a las arrugas, es decir, el planchado permanente. [3]
El glioxal se utiliza como solubilizante y agente de reticulación en la química de polímeros .
El glioxal es un componente básico valioso en la síntesis orgánica , especialmente en la síntesis de heterociclos como los imidazoles . [14] Una forma conveniente del reactivo para usar en el laboratorio es su bis(hemiacetal) con etilenglicol , 1,4-dioxano-2,3-diol. Este compuesto está disponible comercialmente.
Las soluciones de glioxal también se pueden utilizar como fijador para histología , es decir, un método para preservar células para examinarlas bajo el microscopio.
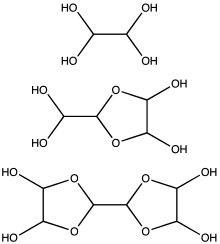
El glioxal se suministra típicamente como una solución acuosa al 40%. [3] Al igual que otros aldehídos pequeños , el glioxal forma hidratos. Además, los hidratos se condensan para dar una serie de oligómeros, algunos de los cuales permanecen con una estructura incierta. Para la mayoría de las aplicaciones, la naturaleza exacta de las especies en solución es intrascendente. Al menos un hidrato de glioxal se vende comercialmente, el trímero de glioxal dihidrato: [(CHO) 2 ] 3 (H 2 O) 2 (CAS 4405-13-4). Hay otros equivalentes de glioxal disponibles, como el hemiacetal de etilenglicol 1,4-dioxano- trans -2,3-diol ( CAS 4845-50-5, pf 91–95 °C).
Se estima que, en concentraciones inferiores a 1 M , el glioxal existe predominantemente como monómero o hidratos del mismo, es decir, OCHCHO, OCHCH(OH) 2 o (HO) 2 CHCH(OH) 2 . En concentraciones superiores a 1 M, predominan los dímeros. Estos dímeros son probablemente dioxolanos , con la fórmula [(HO)CH] 2 O 2 CHCHO. El dímero y los trímeros precipitan como sólidos a partir de soluciones frías. [15]
Se ha observado que el glioxal es un gas traza en la atmósfera, por ejemplo, como producto de oxidación de hidrocarburos. [16] Se han reportado concentraciones troposféricas de 0 a 200 ppt por volumen, en regiones contaminadas hasta 1 ppb por volumen. [17]
La LD 50 (oral, ratas) es 3300 mg/kg, [3] cuando la LD 50 de la sal común es 3000 mg/kg. [18]
Man erhitzt nun das Glyoxal-Phosphorpentoxyd-Gemisch mit freier Flamme und beobachtet bald, dass sich unter Schwarzfärbung des Kolbeninhalte ein flüchtiges grünes Gas bildet, welches sich in der gekühlten Vorlage zu schönen Krystallen von gelber Farbe kondensiert. [Se calienta la mezcla de glioxal (crudo) y P
4
O
10
con una llama abierta y pronto se observa, al ennegrecerse el contenido, un gas verde móvil que se condensa en el matraz enfriado en forma de hermosos cristales amarillos.]