El dogma central de la biología molecular se ocupa del flujo de información genética dentro de un sistema biológico. A menudo se lo enuncia como "el ADN produce ARN y el ARN produce proteínas", [1] aunque este no es su significado original. Fue enunciado por primera vez por Francis Crick en 1957, [2] [3] y publicado después en 1958: [4] [5]
El dogma central. Éste establece que una vez que la "información" ha pasado a la proteína , no puede volver a salir. En más detalle, la transferencia de información de un ácido nucleico a otro, o de un ácido nucleico a una proteína, puede ser posible, pero la transferencia de una proteína a otra, o de una proteína a un ácido nucleico, es imposible. En este caso, la información significa la determinación precisa de la secuencia, ya sea de bases en el ácido nucleico o de residuos de aminoácidos en la proteína.
Lo reiteró en un artículo de Nature publicado en 1970: "El dogma central de la biología molecular trata de la transferencia detallada residuo por residuo de información secuencial . Afirma que dicha información no puede transferirse de vuelta de una proteína a otra ni a otra proteína ni a un ácido nucleico". [6]
Existe una segunda versión del dogma central que es popular pero incorrecta. Se trata de la simplista vía ADN → ARN → proteína publicada por James Watson en la primera edición de La biología molecular del gen (1965). La versión de Watson difiere de la de Crick porque Watson describe un proceso de dos pasos (ADN → ARN y ARN → proteína) como el dogma central. [7] Si bien el dogma tal como lo enunció originalmente Crick sigue siendo válido hoy en día, [6] [8] la versión de Watson no lo es. [2]
Los biopolímeros que comprenden ADN, ARN y (poli) péptidos son polímeros lineales (es decir: cada monómero está conectado a, como máximo, otros dos monómeros). La secuencia de sus monómeros codifica de manera efectiva la información. Las transferencias de información de una molécula a otra son transferencias fieles y deterministas , en las que la secuencia de un biopolímero se utiliza como plantilla para la construcción de otro biopolímero con una secuencia que depende completamente de la secuencia del biopolímero original. Cuando el ADN se transcribe a ARN, su complemento se empareja con él. Los códigos de ADN A, G, T y C se transfieren a los códigos de ARN A, G, U y C, respectivamente. La codificación de proteínas se realiza en grupos de tres, conocidos como codones . La tabla de codones estándar se aplica a los humanos y los mamíferos, pero algunas otras formas de vida (incluidas las mitocondrias humanas [9] ) utilizan diferentes traducciones . [10]
En el sentido de que la replicación del ADN debe ocurrir para que se proporcione material genético a la progenie de cualquier célula, ya sea somática o reproductiva , la copia de ADN a ADN es posiblemente el paso fundamental en la transferencia de información. Un grupo complejo de proteínas llamado replisoma realiza la replicación de la información de la cadena parental a la cadena hija complementaria.

La transcripción es el proceso por el cual la información contenida en una sección de ADN se replica en forma de un fragmento recién ensamblado de ARN mensajero (ARNm). Las enzimas que facilitan el proceso incluyen la ARN polimerasa y los factores de transcripción . En las células eucariotas, el transcrito primario es el pre-ARNm . El pre-ARNm debe procesarse para que se proceda a la traducción. El procesamiento incluye la adición de una tapa 5' y una cola de poli-A a la cadena de pre-ARNm, seguido del empalme . El empalme alternativo ocurre cuando es apropiado, lo que aumenta la diversidad de las proteínas que cualquier ARNm puede producir. El producto de todo el proceso de transcripción (que comenzó con la producción de la cadena de pre-ARNm) es una cadena de ARNm madura.
El ARNm maduro encuentra su camino hacia un ribosoma , donde se traduce . En las células procariotas , que no tienen compartimento nuclear, los procesos de transcripción y traducción pueden estar vinculados entre sí sin una separación clara. En las células eucariotas , el sitio de transcripción (el núcleo celular ) generalmente está separado del sitio de traducción (el citoplasma ), por lo que el ARNm debe transportarse fuera del núcleo hacia el citoplasma, donde puede unirse a los ribosomas. El ribosoma lee los codones tripletes del ARNm , generalmente comenzando con un AUG ( adenina − uracilo − guanina ), o codón iniciador de metionina corriente abajo del sitio de unión del ribosoma . Los complejos de factores de iniciación y factores de elongación llevan los ARN de transferencia aminoacilados (ARNt) al complejo ribosoma-ARNm, haciendo coincidir el codón en el ARNm con el anticodón en el ARNt. Cada ARNt contiene el residuo de aminoácido apropiado para agregarlo a la cadena polipeptídica que se está sintetizando. A medida que los aminoácidos se unen a la cadena peptídica en crecimiento, la cadena comienza a plegarse hasta adoptar la conformación correcta. La traducción finaliza con un codón de terminación que puede ser un triplete UAA, UGA o UAG.
El ARNm no contiene toda la información para especificar la naturaleza de la proteína madura. La cadena polipeptídica naciente liberada del ribosoma generalmente requiere procesamiento adicional antes de que surja el producto final. Por un lado, el proceso de plegado correcto es complejo y de vital importancia. Para la mayoría de las proteínas, se requieren otras proteínas chaperonas para controlar la forma del producto. Algunas proteínas luego escinden segmentos internos de sus propias cadenas peptídicas, empalmando los extremos libres que bordean el espacio; en tales procesos, las secciones internas "descartadas" se denominan inteínas . Otras proteínas deben dividirse en múltiples secciones sin empalmarse. Algunas cadenas polipeptídicas necesitan ser reticuladas y otras deben unirse a cofactores como el grupo hemo antes de que se vuelvan funcionales.

La transcripción inversa es la transferencia de información del ARN al ADN (el proceso inverso de la transcripción normal). Se sabe que esto ocurre en el caso de los retrovirus , como el VIH , así como en los eucariotas , en el caso de los retrotransposones y la síntesis de telómeros . Es el proceso por el cual la información genética del ARN se transcribe en ADN nuevo. La familia de enzimas involucradas en este proceso se llama transcriptasa inversa .
La replicación del ARN es la copia de un ARN en otro. Muchos virus se replican de esta manera. Las enzimas que copian el ARN en ARN nuevo, llamadas ARN polimerasas dependientes de ARN , también se encuentran en muchos eucariotas, donde participan en el silenciamiento del ARN . [11]
La edición de ARN , en la que una secuencia de ARN es alterada por un complejo de proteínas y un "ARN guía", también podría verse como una transferencia de ARN a ARN.
Se ha demostrado la traducción directa de ADN a proteína en un sistema libre de células (es decir, en un tubo de ensayo), utilizando extractos de E. coli que contenían ribosomas, pero no células intactas. Estos fragmentos celulares podían sintetizar proteínas a partir de plantillas de ADN monocatenario aisladas de otros organismos (por ejemplo, ratón o sapo), y se descubrió que la neomicina potenciaba este efecto. Sin embargo, no estaba claro si este mecanismo de traducción correspondía específicamente al código genético. [12] [13]
Una vez que las secuencias de aminoácidos de las proteínas se han traducido a partir de cadenas de ácidos nucleicos, se pueden editar con las enzimas adecuadas. Aunque se trata de una forma de secuenciación de proteínas que afecta a las proteínas, no contemplada explícitamente por el dogma central, no hay muchos ejemplos claros en los que los conceptos asociados de los dos campos tengan mucho que ver entre sí.
Algunas proteínas son sintetizadas por sintetasas de péptidos no ribosómicos , que pueden ser grandes complejos proteicos, cada uno especializado en sintetizar solo un tipo de péptido. Los péptidos no ribosómicos suelen tener estructuras cíclicas y/o ramificadas y pueden contener aminoácidos no proteinogénicos ; ambos factores los diferencian de las proteínas sintetizadas por ribosomas. Un ejemplo de péptidos no ribosómicos son algunos de los antibióticos.
Una inteína es un segmento "parásito" de una proteína que es capaz de separarse de la cadena de aminoácidos a medida que emergen del ribosoma y volver a unir las porciones restantes con un enlace peptídico de tal manera que la "columna vertebral" de la proteína principal no se deshaga. Este es un caso de una proteína que cambia su propia secuencia primaria a partir de la secuencia codificada originalmente por el ADN de un gen. Además, la mayoría de las inteínas contienen una endonucleasa homing o dominio HEG que es capaz de encontrar una copia del gen original que no incluye la secuencia de nucleótidos de la inteína. Al entrar en contacto con la copia libre de inteína, el dominio HEG inicia el mecanismo de reparación de la rotura de doble cadena del ADN . Este proceso hace que la secuencia de inteína se copie del gen fuente original al gen libre de inteína. Este es un ejemplo de proteína que edita directamente la secuencia de ADN, así como también aumenta la propagación hereditaria de la secuencia.
La variación en los estados de metilación del ADN puede alterar significativamente los niveles de expresión génica . La variación de la metilación ocurre generalmente a través de la acción de las metilasas del ADN . Cuando el cambio es hereditario, se considera epigenético . Cuando el cambio en el estado de información no es hereditario, sería un epitipo somático . El contenido de información efectiva ha sido cambiado por medio de las acciones de una proteína o proteínas sobre el ADN, pero la secuencia primaria del ADN no se altera.
Los priones son proteínas de secuencias de aminoácidos particulares en conformaciones particulares. Se propagan en las células huésped al realizar cambios conformacionales en otras moléculas de proteína con la misma secuencia de aminoácidos, pero con una conformación diferente que es funcionalmente importante o perjudicial para el organismo. Una vez que la proteína se ha transformado al plegamiento del prión, cambia de función. A su vez, puede transmitir información a nuevas células y reconfigurar moléculas más funcionales de esa secuencia en la forma priónica alternativa. En algunos tipos de priones en hongos, este cambio es continuo y directo; el flujo de información es Proteína → Proteína.
Algunos científicos, como Alain E. Bussard y Eugene Koonin, han sostenido que la herencia mediada por priones viola el dogma central de la biología molecular. [14] [15] Sin embargo, Rosalind Ridley, en Molecular Pathology of the Prions (2001), ha escrito que "la hipótesis del prión no es herética al dogma central de la biología molecular (que la información necesaria para fabricar proteínas está codificada en la secuencia de nucleótidos del ácido nucleico), porque no afirma que las proteínas se repliquen. Más bien, afirma que existe una fuente de información dentro de las moléculas de proteínas que contribuye a su función biológica, y que esta información puede transmitirse a otras moléculas". [16]
James A. Shapiro sostiene que un superconjunto de estos ejemplos debería clasificarse como ingeniería genética natural y que son suficientes para refutar el dogma central. Si bien Shapiro ha recibido una atención respetuosa por su punto de vista, sus críticos no han quedado convencidos de que su interpretación del dogma central esté en línea con lo que Crick pretendía. [17] [18]
En su autobiografía , What Mad Pursuit , Crick escribió sobre su elección de la palabra dogma y algunos de los problemas que le causó:
"Llamé a esta idea el dogma central, por dos razones, supongo. Ya había utilizado la palabra obvia hipótesis en la hipótesis de la secuencia , y además quería sugerir que esta nueva suposición era más central y más poderosa... Resultó que el uso de la palabra dogma causó casi más problemas de los que ameritaba. Muchos años después, Jacques Monod me señaló que yo no parecía entender el uso correcto de la palabra dogma, que es una creencia que no puede ponerse en duda . Entendí esto de una manera vaga, pero como pensaba que todas las creencias religiosas carecían de fundamento, utilicé la palabra como yo mismo pensaba sobre ella, no como lo hace la mayoría del mundo, y simplemente la apliqué a una gran hipótesis que, por plausible que fuera, tenía poco apoyo experimental directo".
De manera similar, Horace Freeland Judson registra en El octavo día de la creación : [19]
"Mi idea era que un dogma era una idea para la que no había ninguna prueba razonable . ¿Lo ves?", y Crick lanzó un rugido de alegría. "Simplemente no sabía qué significaba dogma . Y podría haberlo llamado la 'hipótesis central' o... ya sabes. Que es lo que quería decir. Dogma era sólo una frase pegadiza".
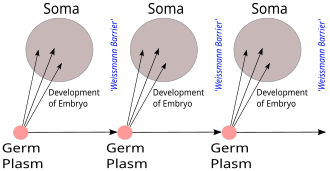
La barrera de Weismann , propuesta por August Weismann en 1892, distingue entre los linajes de células germinales "inmortales" (el plasma germinal ) que producen gametos y las células somáticas "desechables". La información hereditaria se traslada sólo de las células germinales a las células somáticas (es decir, las mutaciones somáticas no se heredan). Esto, antes del descubrimiento del papel o la estructura del ADN, no predice el dogma central, pero sí anticipa su visión de la vida centrada en los genes, aunque en términos no moleculares. [20] [21]
no era reformular la división de las células de Weismann en la línea somática y la línea germinal, ni defender la comprensión moderna de la evolución por selección natural frente a la idea de la herencia de las características adquiridas. El dogma central se basaba en patrones conocidos o supuestos de transferencia de información bioquímica en la célula, más que en una posición dogmática. Como tal, era vulnerable a ser invalidado por descubrimientos futuros. Sin embargo, en sus fundamentos se ha demostrado que es correcto. Excepciones reales o aparentes a esta regla, como la enfermedad priónica de retrotranscripción o los efectos epigenéticos transgeneracionales, no han socavado su verdad básica. (p. 263)
Donde Weismann decía que es imposible que los cambios adquiridos durante la vida de un organismo retroalimenten los rasgos transmisibles en la línea germinal, el CDMB ahora agregó que era imposible que la información codificada en las proteínas retroalimentara y afectara la información genética en cualquier forma, lo que era esencialmente una reformulación molecular de la barrera de Weismann.
{{cite book}}: |work=ignorado ( ayuda )