

Las metiltransferasas son un gran grupo de enzimas que metilan sus sustratos, pero se pueden dividir en varias subclases según sus características estructurales. La clase más común de metiltransferasas es la clase I, todas las cuales contienen un pliegue de Rossmann para la unión de S -adenosil metionina (SAM). Las metiltransferasas de clase II contienen un dominio SET, que se ejemplifican por las metiltransferasas de histonas de dominio SET , y las metiltransferasas de clase III, que están asociadas a la membrana. [1] Las metiltransferasas también se pueden agrupar en diferentes tipos que utilizan diferentes sustratos en las reacciones de transferencia de metilo. Estos tipos incluyen metiltransferasas de proteínas, metiltransferasas de ADN/ARN, metiltransferasas de productos naturales y metiltransferasas no dependientes de SAM. SAM es el donante de metilo clásico para las metiltransferasas, sin embargo, se ven ejemplos de otros donantes de metilo en la naturaleza. El mecanismo general de transferencia de metilo es un ataque nucleofílico de tipo S N 2 donde el azufre de la metionina sirve como grupo saliente y el grupo metilo unido a él actúa como electrófilo que transfiere el grupo metilo al sustrato enzimático. La SAM se convierte en S -adenosil homocisteína (SAH) durante este proceso. La ruptura del enlace SAM-metilo y la formación del enlace sustrato-metilo ocurren casi simultáneamente. Estas reacciones enzimáticas se encuentran en muchas vías y están implicadas en enfermedades genéticas, cáncer y enfermedades metabólicas. Otro tipo de transferencia de metilo es el radical S-adenosil metionina (SAM), que es la metilación de átomos de carbono no activados en metabolitos primarios, proteínas, lípidos y ARN.
La metilación, así como otras modificaciones epigenéticas , afecta la transcripción , la estabilidad genética y la impronta parental . [2] Afecta directamente a la estructura de la cromatina y puede modular la transcripción genética, o incluso silenciar o activar genes por completo, sin mutación del gen en sí. Aunque los mecanismos de este control genético son complejos, la hipometilación y la hipermetilación del ADN están implicadas en muchas enfermedades.
La metilación de proteínas tiene un papel regulador en las interacciones proteína-proteína , las interacciones proteína-ADN y la activación de proteínas.
Ejemplos: RCC1, una proteína mitótica importante , está metilada para poder interactuar con los centrómeros de los cromosomas. Este es un ejemplo de regulación de la interacción proteína-proteína, ya que la metilación regula la unión de RCC1 a las proteínas histonas H2A y H2B . La interacción RCC1-cromatina también es un ejemplo de interacción proteína-ADN, ya que otro dominio de RCC1 interactúa directamente con el ADN cuando esta proteína está metilada. Cuando RCC1 no está metilado, las células en división tienen múltiples polos del huso y, por lo general, no pueden sobrevivir.
El p53 se metila en la lisina para regular su activación e interacción con otras proteínas en la respuesta al daño del ADN. Este es un ejemplo de regulación de las interacciones proteína-proteína y la activación de proteínas. El p53 es un supresor tumoral conocido que activa las vías de reparación del ADN , inicia la apoptosis y detiene el ciclo celular . En general, responde a las mutaciones del ADN, enviando señales a la célula para que las arregle o inicie la muerte celular de modo que estas mutaciones no puedan contribuir al cáncer.
NF-κB (una proteína involucrada en la inflamación) es un objetivo de metilación conocido de la metiltransferasa SETD6 , que desactiva la señalización de NF-κB al inhibir una de sus subunidades, RelA . Esto reduce la activación transcripcional y la respuesta inflamatoria , lo que hace que la metilación de NF-κB sea un proceso regulador por el cual se reduce la señalización celular a través de esta vía. [3]
Las metiltransferasas de productos naturales aportan una variedad de datos a las vías metabólicas, incluida la disponibilidad de cofactores, moléculas de señalización y metabolitos. Esto regula varias vías celulares mediante el control de la actividad proteica.
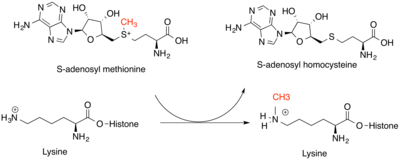
Las metiltransferasas de histonas son fundamentales para la regulación genética a nivel epigenético . Modifican principalmente la lisina en el nitrógeno ε y el grupo guanidinio de la arginina en las colas de las histonas. Las metiltransferasas de lisina y las metiltransferasas de arginina son clases únicas de enzimas, pero ambas se unen a SAM como donante de metilo para sus sustratos de histonas . Los aminoácidos de lisina se pueden modificar con uno, dos o tres grupos metilo, mientras que los aminoácidos de arginina se pueden modificar con uno o dos grupos metilo. Esto aumenta la fuerza de la carga positiva y la hidrofobicidad del residuo , lo que permite que otras proteínas reconozcan las marcas de metilo. El efecto de esta modificación depende de la ubicación de la modificación en la cola de la histona y de las otras modificaciones de histonas a su alrededor. La ubicación de las modificaciones puede determinarse parcialmente por la secuencia de ADN, así como por los pequeños ARN no codificantes y la metilación del propio ADN. Lo más común es que sea la histona H3 o H4 la que se metila en los vertebrados. Puede producirse un aumento o una disminución de la transcripción de genes en torno a la modificación. El aumento de la transcripción es resultado de una menor condensación de la cromatina , mientras que la disminución de la transcripción es resultado de una mayor condensación de la cromatina. [4] Las marcas de metilo en las histonas contribuyen a estos cambios al servir como sitios para el reclutamiento de otras proteínas que pueden modificar aún más la cromatina. [5]

Las N-alfa metiltransferasas transfieren un grupo metilo desde SAM al nitrógeno N-terminal en los objetivos proteicos. La metionina N-terminal es escindida primero por otra enzima y la secuencia de consenso X- Prolina -Lisina es reconocida por la metiltransferasa. Para todos los sustratos conocidos, el aminoácido X es Alanina , Serina o Prolina. Esta reacción produce una proteína metilada y SAH. Los objetivos conocidos de estas metiltransferasas en humanos incluyen RCC-1 (un regulador de proteínas de transporte nuclear) y proteína de retinoblastoma (una proteína supresora de tumores que inhibe la división celular excesiva). La metilación de RCC-1 es especialmente importante en la mitosis ya que coordina la localización de algunas proteínas nucleares en ausencia de la envoltura nuclear . Cuando RCC-1 no está metilado, la división celular es anormal después de la formación de polos de huso adicionales . [6] La función de la metilación N-terminal de la proteína de retinoblastoma no se conoce.

La metilación del ADN, un componente clave de la regulación genética, ocurre principalmente en el carbono 5 de la base citosina , formando 5'metilcitosina (ver a la izquierda). [7] La metilación es una modificación epigenética catalizada por las enzimas metiltransferasas del ADN , incluidas DNMT1, DNMT2 (renombrada TRDMT1 para reflejar su función de metilar ARNt, no ADN) y DNMT3. Estas enzimas usan S-adenosilmetionina como donante de metilo y contienen varias características estructurales altamente conservadas entre las tres formas; estas incluyen el sitio de unión de S-adenosilmetionina, un par prolina-cisteína vecinal que forma un anión tiolato importante para el mecanismo de reacción y el bolsillo de unión del sustrato de citosina. Muchas características de las metiltransferasas del ADN están altamente conservadas en muchas clases de vida, desde bacterias hasta mamíferos. Además de controlar la expresión de ciertos genes , hay una variedad de complejos proteicos, muchos de ellos con implicaciones para la salud humana, que solo se unen a los sitios de reconocimiento de ADN metilado . Se cree que muchas de las primeras metiltransferasas de ADN se derivaron de las metiltransferasas de ARN que se suponía que eran activas en el mundo del ARN para proteger muchas especies de ARN primitivo. [8] La metilación del ARN se ha observado en diferentes tipos de especies de ARN, a saber , ARNm , ARNr , ARNt, snoRNA , snRNA , miRNA , tmRNA , así como especies de ARN virales. Las células emplean metiltransferasas de ARN específicas para marcarlas en las especies de ARN según la necesidad y el entorno que prevalece alrededor de las células, que forman parte del campo llamado epigenética molecular . La metilación 2'-O , la metilación m6A , la metilación m1G y la m5C son las marcas de metilación más comúnmente observadas en diferentes tipos de ARN.
6A es una enzima que cataliza la reacción química como se indica a continuación: [9]
S-adenosil-L-metionina + ADN adenina S-adenosil-L-homocisteína + ADN 6-metilaminopurina
La m6A se encontró principalmente en procariotas hasta 2015, cuando también se identificó en algunos eucariotas. Las metiltransferasas m6A metilan el grupo amino en el ADN en la posición C-6 específicamente para evitar que el sistema huésped digiera su propio genoma a través de enzimas de restricción. [10]
La m5C desempeña un papel en la regulación de la transcripción genética. Las transferasas m5C son las enzimas que producen C5-metilcitosina en el ADN en la posición C-5 de la citosina y se encuentran en la mayoría de las plantas y algunos eucariotas. [11]

Las metiltransferasas de productos naturales (NPMT) son un grupo diverso de enzimas que agregan grupos metilo a moléculas pequeñas producidas naturalmente. Al igual que muchas metiltransferasas, SAM se utiliza como donante de metilo y se produce SAH. Los grupos metilo se agregan a los átomos de S, N, O o C, y se clasifican según cuál de estos átomos se modifica, siendo las O-metiltransferasas la clase más grande. Los productos metilados de estas reacciones cumplen una variedad de funciones, incluidos cofactores, pigmentos, compuestos de señalización y metabolitos. Las NPMT pueden cumplir una función reguladora modificando la reactividad y disponibilidad de estos compuestos. Estas enzimas no están muy conservadas en diferentes especies, ya que cumplen una función más específica al proporcionar moléculas pequeñas para vías especializadas en especies o grupos más pequeños de especies. Un reflejo de esta diversidad es la variedad de estrategias catalíticas, incluida la catálisis ácido-base general , la catálisis basada en metales y los efectos de proximidad y desolvatación que no requieren aminoácidos catalíticos. Las NPMT son la clase de metiltransferasas funcionalmente más diversa. [12]

Ejemplos importantes de esta clase de enzimas en humanos incluyen la feniletanolamina N-metiltransferasa (PNMT), que convierte la norepinefrina en epinefrina , [14] y la histamina N-metiltransferasa (HNMT), que metila la histamina en el proceso de metabolismo de la histamina. [15] La catecol- O -metiltransferasa (COMT) degrada una clase de moléculas conocidas como catecolaminas que incluyen dopamina , epinefrina y norepinefrina. [16]
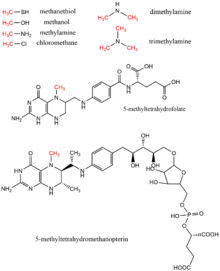
El metanol , el metiltetrahidrofolato , la mono- , di- y trimetilamina , el metanotiol , la metiltetrahidrometanopterina y el clorometano son todos donantes de metilo que se encuentran en biología como donantes de grupos metilo, típicamente en reacciones enzimáticas que utilizan el cofactor vitamina B12 . [17] Estos sustratos contribuyen a las vías de transferencia de metilo, incluida la biosíntesis de metionina , la metanogénesis y la acetogénesis .
En función de las diferentes estructuras proteicas y mecanismos de catálisis, existen 3 tipos diferentes de metilasas radicales SAM (RS): Clase A, B y C. Las metilasas RS de clase A son las mejor caracterizadas de las 4 enzimas y están relacionadas tanto con RlmN como con Cfr. RlmN es ubicua en bacterias, lo que mejora la fidelidad de la traducción y RlmN cataliza la metilación de C2 de adenosina 2503 (A2503) en 23 S rRNA y C2 de adenosina (A37). Cfr, por otro lado, cataliza también la metilación de C8 de A2503 y también cataliza la metilación de C2. [18] La clase B es actualmente la clase más grande de metilasas SAM radicales que pueden metilar átomos de carbono hibridados sp 2 y sp 3 en diferentes conjuntos de sustratos a diferencia de la clase A que solo cataliza átomos de carbono hibridados sp 2. La principal diferencia que distingue a la clase B de otras es el dominio adicional de unión a cobalamina N-terminal que se une al dominio RS. [19] La metilasa de clase C tiene una secuencia homóloga con la enzima RS, coproporfirinógeno III oxidasa (HemN), que también cataliza la metilación de centros de carbono hibridados sp 2 pero carece de las 2 cisteínas requeridas para la metilación en el mecanismo de la clase A. [18]
Al igual que con cualquier proceso biológico que regula la expresión y/o función de los genes, la metilación anómala del ADN se asocia con trastornos genéticos como el ICF , el síndrome de Rett y el síndrome del cromosoma X frágil . [2] Las células cancerosas suelen mostrar menos actividad de metilación del ADN en general, aunque a menudo hipermetilación en sitios que no están metilados en las células normales; esta sobremetilación a menudo funciona como una forma de inactivar los genes supresores de tumores . La inhibición de la actividad general de la ADN metiltransferasa se ha propuesto como una opción de tratamiento, pero se ha descubierto que los inhibidores de DNMT, análogos de sus sustratos de citosina , son altamente tóxicos debido a su similitud con la citosina (ver a la derecha); esta similitud con el nucleótido hace que el inhibidor se incorpore a la traducción del ADN , lo que hace que se sintetice ADN que no funciona.
Una metilasa que altera el sitio de unión del ARN ribosómico del antibiótico linezolid provoca resistencia cruzada a otros antibióticos que actúan sobre el ARN ribosómico. Los vectores plasmídicos capaces de transmitir este gen son una causa de resistencia cruzada potencialmente peligrosa. [20]
Ejemplos de enzimas metiltransferasas relevantes para la enfermedad:
Trabajos recientes han revelado que las metiltransferasas involucradas en la metilación de agentes anticancerígenos naturales utilizan análogos de la S-adenosil metionina (SAM) que llevan grupos alquilo alternativos como reemplazo del metilo. El desarrollo de la sencilla plataforma quimioenzimática para generar y utilizar análogos de SAM alquilados diferencialmente en el contexto del descubrimiento y desarrollo de fármacos se conoce como alquilrandomización. [21]
En las células humanas, se ha descubierto que el m5C se asocia con células tumorales anormales en el cáncer. [22] El papel y la posible aplicación del m5C incluyen equilibrar el ADN dañado en el cáncer, tanto la hipermetilación como la hipometilación. Se puede aplicar una reparación epigenética del ADN modificando la cantidad de m5C en ambos tipos de células cancerosas (hipermetilación/hipometilación) y también el entorno de los cánceres para alcanzar un punto equivalente para inhibir las células tumorales. [23]
Algunos ejemplos incluyen: