Un dipéptido es un compuesto orgánico derivado de dos aminoácidos . Los aminoácidos constituyentes pueden ser iguales o diferentes. Cuando son diferentes, son posibles dos isómeros del dipéptido, dependiendo de la secuencia. Varios dipéptidos son fisiológicamente importantes, y algunos son tanto fisiológicamente como comercialmente significativos. Un dipéptido bien conocido es el aspartamo , un edulcorante artificial . [1]
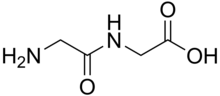
Los dipéptidos son sólidos blancos. Muchos son mucho más solubles en agua que los aminoácidos originales. [1] Por ejemplo, el dipéptido Ala-Gln tiene una solubilidad de 586 g/L, más de 10 veces la solubilidad de Gln (35 g/L). Los dipéptidos también pueden presentar diferentes estabilidades, por ejemplo, con respecto a la hidrólisis. Gln no resiste los procedimientos de esterilización, mientras que este dipéptido sí. Debido a que los dipéptidos son propensos a la hidrólisis, la alta solubilidad se aprovecha en infusiones, es decir, para proporcionar nutrición. [2]

Aproximadamente seis dipéptidos son de interés comercial. [1]
Los dipéptidos se producen mediante el acoplamiento de aminoácidos. El grupo amino de un aminoácido se vuelve no nucleofílico (P en la ecuación) y el grupo de ácido carboxílico del segundo aminoácido se desactiva como su éster metílico. A continuación, los dos aminoácidos modificados se combinan en presencia de un agente de acoplamiento, lo que facilita la formación del enlace amida:
Posteriormente a esta reacción de acoplamiento, el grupo protector de amina P y el éster se convierten en amina libre y ácido carboxílico, respectivamente. [3]
En muchos aminoácidos, los grupos funcionales auxiliares están protegidos . La condensación de la amina y el ácido carboxílico para formar el enlace peptídico generalmente emplea agentes de acoplamiento para activar el ácido carboxílico. [4]
La síntesis de péptidos de azlactona de Bergmann es una síntesis orgánica clásica para la preparación de dipéptidos. [1]
Los dipéptidos se producen a partir de polipéptidos por la acción de la enzima hidrolasa dipeptidil peptidasa . [5] Las proteínas de la dieta se digieren en dipéptidos y aminoácidos, y los dipéptidos se absorben más rápidamente que los aminoácidos, porque su absorción implica un mecanismo separado. Los dipéptidos activan las células G que se encuentran en el estómago para secretar gastrina .

Las dicetopiperazinas son una clase especial de dipéptidos, que son cíclicos. Se forman como productos secundarios en la síntesis de péptidos. Muchas se han producido a partir de aminoácidos no canónicos. [7]