El agua ( H2O ) es un compuesto inorgánico polar que, a temperatura ambiente , es un líquido insípido e inodoro , que es casi incoloro, salvo por un matiz inherente de azul . Es, con diferencia, el compuesto químico más estudiado [20] y se describe como el " disolvente universal " [21] y el "disolvente de la vida". [22] Es la sustancia más abundante en la superficie de la Tierra [23] y la única sustancia común que existe como sólido , líquido y gas en la superficie de la Tierra. [24] También es la tercera molécula más abundante del universo (detrás del hidrógeno molecular y el monóxido de carbono ). [23]
Las moléculas de agua forman enlaces de hidrógeno entre sí y son fuertemente polares. Esta polaridad le permite disociar los iones en sales y unirse a otras sustancias polares como alcoholes y ácidos, disolviéndolos así. Sus enlaces de hidrógeno son la causa de sus numerosas propiedades únicas, como tener una forma sólida menos densa que su forma líquida, un punto de ebullición relativamente alto de 100 °C para su masa molar y una alta capacidad calorífica .
El agua es anfótera , lo que significa que puede exhibir propiedades de un ácido o de una base , dependiendo del pH de la solución en la que se encuentra; produce fácilmente tanto H+y OH−iones. [c] Relacionado con su carácter anfótero, sufre autoionización . El producto de las actividades , o aproximadamente, las concentraciones de H+
y OH−
es una constante, por lo que sus respectivas concentraciones son inversamente proporcionales entre sí. [25]
El agua es la sustancia química con fórmula química H
2O ; una molécula de agua tiene dos átomos de hidrógeno unidos covalentemente a un solo átomo de oxígeno . [26] El agua es un líquido insípido e inodoro a temperatura y presión ambiente . El agua líquida tiene bandas de absorción débiles en longitudes de onda de alrededor de 750 nm que hacen que parezca tener un color azul. [4] Esto se puede observar fácilmente en una bañera o lavabo lleno de agua cuyo revestimiento es blanco. Los cristales de hielo grandes, como en los glaciares , también aparecen azules.
En condiciones estándar , el agua es principalmente un líquido, a diferencia de otros hidruros análogos de la familia del oxígeno , que generalmente son gaseosos. Esta propiedad única del agua se debe a los enlaces de hidrógeno . Las moléculas de agua se mueven constantemente entre sí, y los enlaces de hidrógeno se rompen y reforman continuamente en escalas de tiempo más rápidas que 200 femtosegundos (2 × 10 −13 segundos). [27] Sin embargo, estos enlaces son lo suficientemente fuertes como para crear muchas de las propiedades peculiares del agua, algunas de las cuales la hacen parte integral de la vida.
En la atmósfera y la superficie de la Tierra, la fase líquida es la más común y es la forma que generalmente se denota con la palabra "agua". La fase sólida del agua se conoce como hielo y comúnmente toma la estructura de cristales duros amalgamados , como los cubitos de hielo , o cristales granulares acumulados de forma suelta , como la nieve . Aparte del hielo cristalino hexagonal común , se conocen otras fases cristalinas y amorfas del hielo . La fase gaseosa del agua se conoce como vapor de agua (o vapor de agua ). El vapor y las nubes visibles se forman a partir de diminutas gotas de agua suspendidas en el aire.
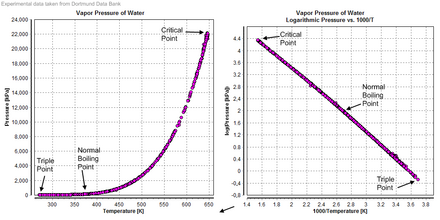
El agua también forma un fluido supercrítico . La temperatura crítica es de 647 K y la presión crítica es de 22,064 MPa . En la naturaleza, esto solo ocurre raramente en condiciones extremadamente hostiles. Un ejemplo probable de agua supercrítica de origen natural se encuentra en las partes más calientes de los respiraderos hidrotermales de aguas profundas , en las que el agua se calienta a la temperatura crítica por columnas volcánicas y la presión crítica es causada por el peso del océano en las profundidades extremas donde se encuentran los respiraderos. Esta presión se alcanza a una profundidad de aproximadamente 2200 metros: mucho menos que la profundidad media del océano (3800 metros). [28]

El agua tiene una capacidad calorífica específica muy alta de 4184 J/(kg·K) a 20 °C (4182 J/(kg·K) a 25 °C), la segunda más alta entre todas las especies heteroatómicas (después del amoníaco ), así como un alto calor de vaporización (40,65 kJ/mol o 2257 kJ/kg en el punto de ebullición normal), ambos resultados de los extensos enlaces de hidrógeno entre sus moléculas. Estas dos propiedades inusuales permiten al agua moderar el clima de la Tierra al amortiguar las grandes fluctuaciones de temperatura. La mayor parte de la energía adicional almacenada en el sistema climático desde 1970 se ha acumulado en los océanos . [29]
La entalpía específica de fusión (más comúnmente conocida como calor latente) del agua es de 333,55 kJ/kg a 0 °C: se requiere la misma cantidad de energía para fundir hielo que para calentarlo desde -160 °C hasta su punto de fusión o para calentar la misma cantidad de agua en unos 80 °C. De las sustancias comunes, solo la del amoníaco es superior. Esta propiedad confiere resistencia a la fusión al hielo de los glaciares y del hielo a la deriva . Antes y después de la llegada de la refrigeración mecánica , el hielo era y sigue siendo de uso común para retardar el deterioro de los alimentos.
La capacidad calorífica específica del hielo a -10 °C es 2030 J/(kg·K) [30] y la capacidad calorífica del vapor a 100 °C es 2080 J/(kg·K). [31]

La densidad del agua es de aproximadamente 1 gramo por centímetro cúbico (62 lb/cu ft): esta relación se utilizó originalmente para definir el gramo. [32] La densidad varía con la temperatura, pero no de forma lineal: a medida que aumenta la temperatura, la densidad aumenta hasta un pico a 3,98 °C (39,16 °F) y luego disminuye; [33] el aumento inicial es inusual porque la mayoría de los líquidos experimentan expansión térmica , de modo que la densidad solo disminuye en función de la temperatura. El aumento observado para el agua de 0 °C (32 °F) a 3,98 °C (39,16 °F) y para algunos otros líquidos [d] se describe como expansión térmica negativa . El hielo regular, hexagonal , también es menos denso que el agua líquida: al congelarse, la densidad del agua disminuye aproximadamente un 9%. [36] [e]
Estos efectos peculiares se deben a la unión altamente direccional de las moléculas de agua a través de los enlaces de hidrógeno: el hielo y el agua líquida a baja temperatura tienen estructuras reticulares abiertas de baja energía y densidad comparativamente baja. La ruptura de los enlaces de hidrógeno al fundirse con el aumento de la temperatura en el rango de 0 a 4 °C permite un empaquetamiento molecular más denso en el que algunas de las cavidades reticulares se llenan con moléculas de agua. [33] [37] Sin embargo, por encima de los 4 °C, la expansión térmica se convierte en el efecto dominante, [37] y el agua cerca del punto de ebullición (100 °C) es aproximadamente un 4% menos densa que el agua a 4 °C (39 °F). [36] [f]
Bajo una presión creciente, el hielo experimenta una serie de transiciones a otros polimorfos con mayor densidad que el agua líquida, como el hielo II , el hielo III , el hielo amorfo de alta densidad (HDA) y el hielo amorfo de muy alta densidad (VHDA). [38] [39]

La inusual curva de densidad y la menor densidad del hielo que la del agua son esenciales para gran parte de la vida en la Tierra: si el agua fuera más densa en el punto de congelación, entonces en invierno el enfriamiento en la superficie provocaría una mezcla convectiva. Una vez que se alcancen los 0 °C, la masa de agua se congelaría de abajo hacia arriba y toda la vida en ella moriría. [36] Además, dado que el agua es un buen aislante térmico (debido a su capacidad calorífica), algunos lagos congelados podrían no descongelarse completamente en verano. [36] Tal como están las cosas, la inversión de la curva de densidad conduce a una estratificación estable para temperaturas superficiales inferiores a 4 °C, y con la capa de hielo que flota en la parte superior aislando el agua de abajo, [40] incluso, por ejemplo, el lago Baikal en Siberia central se congela solo hasta aproximadamente 1 m de espesor en invierno. En general, para lagos lo suficientemente profundos, la temperatura en el fondo se mantiene constante a aproximadamente 4 °C (39 °F) durante todo el año (ver diagrama). [36]

La densidad del agua salada depende del contenido de sal disuelta y de la temperatura. El hielo todavía flota en los océanos, de lo contrario, se congelaría de abajo hacia arriba. Sin embargo, el contenido de sal de los océanos reduce el punto de congelación en aproximadamente 1,9 °C [41] (debido a la depresión del punto de congelación de un disolvente que contiene un soluto ) y reduce la temperatura del máximo de densidad del agua al punto de congelación anterior a 0 °C. Esta es la razón por la que, en el agua del océano, la convección descendente del agua más fría no se ve bloqueada por una expansión del agua a medida que se enfría cerca del punto de congelación. El agua fría de los océanos cerca del punto de congelación continúa hundiéndose. Por lo tanto, las criaturas que viven en el fondo de océanos fríos como el océano Ártico generalmente viven en agua 4 °C más fría que en el fondo de lagos y ríos de agua dulce congelados .
A medida que la superficie del agua salada comienza a congelarse (a -1,9 °C [41] para el agua de mar de salinidad normal , 3,5 %), el hielo que se forma es esencialmente libre de sal, con aproximadamente la misma densidad que el hielo de agua dulce. Este hielo flota en la superficie, y la sal que se "congela" se suma a la salinidad y la densidad del agua de mar justo debajo de él, en un proceso conocido como rechazo de salmuera . Esta agua salada más densa se hunde por convección y el agua de mar que la reemplaza está sujeta al mismo proceso. Esto produce esencialmente hielo de agua dulce a -1,9 °C [41] en la superficie. La mayor densidad del agua de mar debajo del hielo en formación hace que se hunda hacia el fondo. A gran escala, el proceso de rechazo de salmuera y hundimiento de agua salada fría da como resultado la formación de corrientes oceánicas para transportar dicha agua lejos de los polos, lo que conduce a un sistema global de corrientes llamado circulación termohalina .

El agua es miscible con muchos líquidos, incluido el etanol en todas las proporciones. El agua y la mayoría de los aceites son inmiscibles y suelen formar capas según aumenta la densidad desde la parte superior. Esto se puede predecir comparando la polaridad . El agua, al ser un compuesto relativamente polar, tenderá a ser miscible con líquidos de alta polaridad, como el etanol y la acetona, mientras que los compuestos con baja polaridad tenderán a ser inmiscibles y poco solubles , como los hidrocarburos .
Como gas, el vapor de agua es completamente miscible con el aire. Por otro lado, la presión máxima de vapor de agua que es termodinámicamente estable con el líquido (o sólido) a una temperatura dada es relativamente baja en comparación con la presión atmosférica total. Por ejemplo, si la presión parcial del vapor es el 2% de la presión atmosférica y el aire se enfría desde 25 °C, comenzando aproximadamente a 22 °C, el agua comenzará a condensarse, definiendo el punto de rocío y creando niebla o rocío . El proceso inverso explica que la niebla se queme por la mañana. Si se aumenta la humedad a temperatura ambiente, por ejemplo, al abrir una ducha o un baño caliente, y la temperatura se mantiene más o menos igual, el vapor pronto alcanza la presión para el cambio de fase y luego se condensa en forma de diminutas gotas de agua, comúnmente conocidas como vapor.
Un gas saturado o con una humedad relativa del 100 % es aquel en el que la presión de vapor del agua en el aire está en equilibrio con la presión de vapor debida al agua (líquida); el agua (o el hielo, si está lo suficientemente frío) no perderá masa por evaporación cuando se exponga al aire saturado. Debido a que la cantidad de vapor de agua en el aire es pequeña, la humedad relativa, la relación entre la presión parcial debida al vapor de agua y la presión parcial de vapor saturado, es mucho más útil. La presión de vapor por encima del 100 % de humedad relativa se denomina sobresaturada y puede ocurrir si el aire se enfría rápidamente, por ejemplo, al elevarse repentinamente en una corriente ascendente. [g]
La compresibilidad del agua es función de la presión y la temperatura. A 0 °C, en el límite de presión cero, la compresibilidad es5,1 × 10 −10 Pa −1 . En el límite de presión cero, la compresibilidad alcanza un mínimo de4,4 × 10 −10 Pa −1 alrededor de los 45 °C antes de volver a aumentar con el aumento de la temperatura. A medida que aumenta la presión, la compresibilidad disminuye, siendo3,9 × 10 −10 Pa −1 a 0 °C y 100 megapascales (1.000 bar). [42]
El módulo volumétrico del agua es de aproximadamente 2,2 GPa. [43] La baja compresibilidad de los no gases, y del agua en particular, hace que a menudo se los considere incompresibles. La baja compresibilidad del agua significa que incluso en los océanos profundos a 4 km de profundidad, donde las presiones son de 40 MPa, solo hay una disminución del 1,8% en el volumen. [43]
El módulo volumétrico del hielo de agua varía desde 11,3 GPa a 0 K hasta 8,6 GPa a 273 K. [44] El gran cambio en la compresibilidad del hielo en función de la temperatura es el resultado de su coeficiente de expansión térmica relativamente grande en comparación con otros sólidos comunes.

La temperatura y la presión a las que el agua ordinaria, sólida, líquida y gaseosa coexisten en equilibrio es un punto triple del agua. Desde 1954, este punto se había utilizado para definir la unidad base de temperatura, el kelvin , [45] [46] pero, a partir de 2019 , el kelvin ahora se define utilizando la constante de Boltzmann , en lugar del punto triple del agua. [47]
Debido a la existencia de muchos polimorfos (formas) de hielo, el agua tiene otros puntos triples, que tienen tres polimorfos de hielo o dos polimorfos de hielo y líquido en equilibrio. [46] Gustav Heinrich Johann Apollon Tammann en Göttingen produjo datos sobre varios otros puntos triples a principios del siglo XX. Kamb y otros documentaron más puntos triples en la década de 1960. [48] [49] [50]
El punto de fusión del hielo es de 0 °C (32 °F; 273 K) a presión estándar; sin embargo, el agua líquida pura se puede sobreenfriar muy por debajo de esa temperatura sin congelarse si no se altera mecánicamente. Puede permanecer en estado fluido hasta su punto de nucleación homogéneo de aproximadamente 231 K (−42 °C; −44 °F). [52] El punto de fusión del hielo hexagonal ordinario cae ligeramente bajo presiones moderadamente altas, en 0,0073 °C (0,0131 °F)/atm [h] o alrededor de 0,5 °C (0,90 °F)/70 atm [i] [53] ya que la energía de estabilización del enlace de hidrógeno es excedida por la repulsión intermolecular, pero a medida que el hielo se transforma en sus polimorfos (ver estados cristalinos del hielo ) por encima de 209,9 MPa (2072 atm), el punto de fusión aumenta notablemente con la presión , es decir, alcanzando 355 K (82 °C) a 2,216 GPa (21 870 atm) (punto triple del hielo VII [54] ).
El agua pura que no contiene iones exógenos es un excelente aislante electrónico , pero ni siquiera el agua "desionizada" está completamente libre de iones. El agua sufre autoionización en estado líquido cuando dos moléculas de agua forman un anión hidróxido ( OH−
) y un catión hidronio ( H
3Oh+
). Debido a la autoionización, a temperaturas ambiente el agua líquida pura tiene una concentración de portadores de carga intrínseca similar a la del semiconductor germanio y una concentración de portadores de carga intrínseca tres órdenes de magnitud mayor que la del semiconductor silicio, por lo tanto, en base a la concentración de portadores de carga, el agua no puede considerarse un material completamente dieléctrico o aislante eléctrico sino un conductor limitado de carga iónica. [55]
Como el agua es un disolvente tan bueno, casi siempre tiene algún soluto disuelto en ella, a menudo una sal . Si el agua tiene incluso una cantidad minúscula de una impureza de este tipo, los iones pueden transportar cargas de un lado a otro, lo que permite que el agua conduzca la electricidad con mucha más facilidad.
Se sabe que la resistividad eléctrica máxima teórica del agua es de aproximadamente 18,2 MΩ·cm (182 kΩ ·m) a 25 °C. [56] Esta cifra concuerda bien con lo que se observa típicamente en los sistemas de ósmosis inversa , agua ultrapura ultrafiltrada y desionizada que se utilizan, por ejemplo, en plantas de fabricación de semiconductores. Un nivel de contaminante de sal o ácido que exceda incluso las 100 partes por billón (ppt) en agua por lo demás ultrapura comienza a reducir notablemente su resistividad en hasta varios kΩ·m. [ cita requerida ]
En agua pura, un equipo sensible puede detectar una conductividad eléctrica muy leve de 0,05501 ± 0,0001 μS / cm a 25,00 °C. [56] El agua también se puede electrolizar en gases de oxígeno e hidrógeno, pero en ausencia de iones disueltos, este es un proceso muy lento, ya que se conduce muy poca corriente. En el hielo, los portadores de carga primarios son los protones (véase conductor de protones ). [57] Anteriormente se pensaba que el hielo tenía una conductividad pequeña pero medible de 1 × 10−10 S/cm, pero ahora se piensa que esta conductividad se debe casi en su totalidad a defectos superficiales y, sin ellos, el hielo es un aislante con una conductividad inmensamente pequeña. [33]

Una característica importante del agua es su naturaleza polar. La estructura tiene una geometría molecular doblada para los dos hidrógenos del vértice de oxígeno. El átomo de oxígeno también tiene dos pares de electrones solitarios. Un efecto que generalmente se atribuye a los pares solitarios es que el ángulo de flexión de la fase gaseosa H–O–H es de 104,48°, [58] que es menor que el ángulo tetraédrico típico de 109,47°. Los pares solitarios están más cerca del átomo de oxígeno que los electrones unidos sigma a los hidrógenos, por lo que requieren más espacio. La mayor repulsión de los pares solitarios fuerza a los enlaces O–H a acercarse entre sí. [59]
Otra consecuencia de su estructura es que el agua es una molécula polar . Debido a la diferencia de electronegatividad , un momento dipolar de enlace apunta de cada H al O, haciendo que el oxígeno sea parcialmente negativo y cada hidrógeno parcialmente positivo. Un gran dipolo molecular apunta desde una región entre los dos átomos de hidrógeno al átomo de oxígeno. Las diferencias de carga hacen que las moléculas de agua se agreguen (las áreas relativamente positivas son atraídas por las áreas relativamente negativas). Esta atracción, el enlace de hidrógeno , explica muchas de las propiedades del agua, como sus propiedades disolventes. [60]
Aunque el enlace de hidrógeno es una atracción relativamente débil en comparación con los enlaces covalentes dentro de la propia molécula de agua, es responsable de varias de las propiedades físicas del agua. Estas propiedades incluyen sus temperaturas de fusión y ebullición relativamente altas: se requiere más energía para romper los enlaces de hidrógeno entre las moléculas de agua. Por el contrario, el sulfuro de hidrógeno ( H
2S ), tiene un enlace de hidrógeno mucho más débil debido a la menor electronegatividad del azufre. H
2El S es un gas a temperatura ambiente , a pesar de que el sulfuro de hidrógeno tiene casi el doble de masa molar que el agua. La unión adicional entre las moléculas de agua también le otorga al agua líquida una gran capacidad calorífica específica . Esta alta capacidad calorífica hace que el agua sea un buen medio de almacenamiento de calor (refrigerante) y escudo térmico.

Las moléculas de agua se mantienen juntas ( cohesión ) gracias a la acción colectiva de los enlaces de hidrógeno entre ellas. Estos enlaces de hidrógeno se rompen constantemente y se forman nuevos enlaces con diferentes moléculas de agua; pero en cualquier momento dado, en una muestra de agua líquida, una gran parte de las moléculas se mantienen unidas por dichos enlaces. [61]
El agua también tiene altas propiedades de adhesión debido a su naturaleza polar. En un vidrio limpio y liso , el agua puede formar una película delgada porque las fuerzas moleculares entre el vidrio y las moléculas de agua (fuerzas adhesivas) son más fuertes que las fuerzas de cohesión. [ cita requerida ] En las células y los orgánulos biológicos , el agua está en contacto con superficies de membranas y proteínas que son hidrófilas ; es decir, superficies que tienen una fuerte atracción por el agua. Irving Langmuir observó una fuerte fuerza repulsiva entre superficies hidrófilas. Para deshidratar superficies hidrófilas (eliminar las capas de agua de hidratación fuertemente retenidas) se requiere realizar un trabajo sustancial contra estas fuerzas, llamadas fuerzas de hidratación. Estas fuerzas son muy grandes pero disminuyen rápidamente en un nanómetro o menos. [62] Son importantes en biología, particularmente cuando las células se deshidratan por exposición a atmósferas secas o congelación extracelular. [63]



El agua tiene una tensión superficial inusualmente alta de 71,99 mN/m a 25 °C [64], que es causada por la fuerza de los enlaces de hidrógeno entre las moléculas de agua. [65] Esto permite a los insectos caminar sobre el agua. [65]
Debido a que el agua tiene fuertes fuerzas cohesivas y adhesivas, exhibe acción capilar. [66] La fuerte cohesión por enlaces de hidrógeno y adhesión permite a los árboles transportar agua a más de 100 m hacia arriba. [65]

El agua es un excelente disolvente debido a su alta constante dieléctrica. [67] Las sustancias que se mezclan bien y se disuelven en agua se conocen como sustancias hidrófilas ("amantes del agua"), mientras que las que no se mezclan bien con el agua se conocen como sustancias hidrófobas ("temerosas del agua"). [68] La capacidad de una sustancia para disolverse en agua está determinada por si la sustancia puede igualar o superar las fuertes fuerzas de atracción que las moléculas de agua generan entre otras moléculas de agua. Si una sustancia tiene propiedades que no le permiten superar estas fuertes fuerzas intermoleculares, las moléculas se precipitan fuera del agua. Contrariamente a la idea errónea común, el agua y las sustancias hidrófobas no se "repelen", y la hidratación de una superficie hidrófoba es energéticamente, pero no entrópicamente, favorable.
Cuando un compuesto iónico o polar entra en el agua, se rodea de moléculas de agua ( hidratación ). El tamaño relativamente pequeño de las moléculas de agua (~3 angstroms) permite que muchas moléculas de agua rodeen una molécula de soluto . Los extremos dipolares parcialmente negativos del agua son atraídos por los componentes cargados positivamente del soluto, y viceversa para los extremos dipolares positivos.
En general, las sustancias iónicas y polares, como los ácidos , los alcoholes y las sales, son relativamente solubles en agua, mientras que las sustancias no polares, como las grasas y los aceites, no lo son. Las moléculas no polares permanecen juntas en el agua porque es energéticamente más favorable para las moléculas de agua formar enlaces de hidrógeno entre sí que participar en interacciones de van der Waals con moléculas no polares.
Un ejemplo de soluto iónico es la sal de mesa ; el cloruro de sodio, NaCl, se separa en Na+
cationes y Cl−
aniones , cada uno de ellos rodeado de moléculas de agua. Los iones se transportan fácilmente desde su red cristalina hacia la solución. Un ejemplo de soluto no iónico es el azúcar de mesa . Los dipolos de agua forman enlaces de hidrógeno con las regiones polares de la molécula de azúcar (grupos OH) y permiten que se la transporte hacia la solución.
La dinámica del efecto túnel cuántico en el agua se informó ya en 1992. En ese momento se sabía que hay movimientos que destruyen y regeneran el enlace de hidrógeno débil mediante rotaciones internas de los monómeros de agua sustituyentes . [69] El 18 de marzo de 2016, se informó que el enlace de hidrógeno se puede romper mediante efecto túnel cuántico en el hexámero de agua . A diferencia de los movimientos de efecto túnel informados anteriormente en el agua, esto implicó la ruptura concertada de dos enlaces de hidrógeno. [70] Más tarde, en el mismo año, se informó del descubrimiento del efecto túnel cuántico de las moléculas de agua. [71]
El agua es relativamente transparente a la luz visible , la luz ultravioleta cercana y la luz roja lejana , pero absorbe la mayor parte de la luz ultravioleta , la luz infrarroja y las microondas . La mayoría de los fotorreceptores y pigmentos fotosintéticos utilizan la parte del espectro de luz que se transmite bien a través del agua. Los hornos microondas aprovechan la opacidad del agua a la radiación de microondas para calentar el agua dentro de los alimentos. El color azul claro del agua se debe a una absorción débil en la parte roja del espectro visible . [4] [72]

Una sola molécula de agua puede participar en un máximo de cuatro enlaces de hidrógeno porque puede aceptar dos enlaces utilizando los pares solitarios del oxígeno y donar dos átomos de hidrógeno. Otras moléculas como el fluoruro de hidrógeno , el amoníaco y el metanol también pueden formar enlaces de hidrógeno. Sin embargo, no muestran propiedades termodinámicas , cinéticas o estructurales anómalas como las observadas en el agua porque ninguna de ellas puede formar cuatro enlaces de hidrógeno: o bien no pueden donar o aceptar átomos de hidrógeno, o bien hay efectos estéricos en residuos voluminosos. En el agua, las estructuras tetraédricas intermoleculares se forman debido a los cuatro enlaces de hidrógeno, formando así una estructura abierta y una red de enlaces tridimensional, lo que da como resultado la disminución anómala de la densidad cuando se enfría por debajo de los 4 °C. Esta unidad repetida y en constante reorganización define una red tridimensional que se extiende por todo el líquido. Esta visión se basa en estudios de dispersión de neutrones y simulaciones por computadora, y tiene sentido a la luz de la disposición inequívocamente tetraédrica de las moléculas de agua en las estructuras de hielo.
Sin embargo, existe una teoría alternativa sobre la estructura del agua. En 2004, un artículo controvertido de la Universidad de Estocolmo sugirió que las moléculas de agua en estado líquido normalmente se unen no a cuatro, sino sólo a dos más, formando así cadenas y anillos. Se acuñó el término "teoría de cuerdas del agua" (que no debe confundirse con la teoría de cuerdas de la física). Estas observaciones se basaron en espectroscopia de absorción de rayos X que sondeó el entorno local de átomos de oxígeno individuales. [73]
Los efectos repulsivos de los dos pares solitarios en el átomo de oxígeno hacen que el agua tenga una estructura molecular curvada , no lineal , [74] lo que le permite ser polar. El ángulo hidrógeno-oxígeno-hidrógeno es de 104,45°, que es menor que los 109,47° para la hibridación sp 3 ideal . La explicación de la teoría del enlace de valencia es que los pares solitarios del átomo de oxígeno son físicamente más grandes y, por lo tanto, ocupan más espacio que los enlaces del átomo de oxígeno a los átomos de hidrógeno. [75] La explicación de la teoría de orbitales moleculares ( regla de Bent ) es que reducir la energía de los orbitales híbridos no enlazantes del átomo de oxígeno (asignándoles más carácter s y menos carácter p) y aumentar correspondientemente la energía de los orbitales híbridos del átomo de oxígeno enlazados a los átomos de hidrógeno (asignándoles más carácter p y menos carácter s) tiene el efecto neto de reducir la energía de los orbitales moleculares ocupados porque la energía de los orbitales híbridos no enlazantes del átomo de oxígeno contribuye completamente a la energía de los pares solitarios del átomo de oxígeno mientras que la energía de los otros dos orbitales híbridos del átomo de oxígeno contribuye solo parcialmente a la energía de los orbitales enlazantes (el resto de la contribución proviene de los orbitales 1s de los átomos de hidrógeno).
En el agua líquida hay cierta autoionización dando lugar a iones hidronio e iones hidróxido .
La constante de equilibrio para esta reacción, conocida como producto iónico del agua, tiene un valor de aproximadamente 10−14 a 25 °C. A pH neutro , la concentración delion hidróxido ( OH−
) es igual a la del ion hidrógeno (solvatado) ( H+
), con un valor cercano a 10 −7 mol L −1 a 25 °C. [76] Consulte la página de datos para conocer los valores a otras temperaturas.
La constante de equilibrio termodinámico es un cociente de las actividades termodinámicas de todos los productos y reactivos, incluido el agua:
Sin embargo, para soluciones diluidas, la actividad de un soluto como H 3 O + o OH − se aproxima por su concentración, y la actividad del solvente H 2 O se aproxima por 1, de modo que obtenemos el producto iónico simple.
La acción del agua sobre las rocas durante largos períodos de tiempo suele provocar meteorización y erosión hídrica , procesos físicos que convierten las rocas sólidas y los minerales en suelo y sedimento, pero en determinadas condiciones también se producen reacciones químicas con el agua, lo que da lugar al metasomatismo o hidratación mineral , un tipo de alteración química de una roca que produce minerales arcillosos . También ocurre cuando el cemento Portland se endurece.
El hielo de agua puede formar compuestos de clatrato , conocidos como hidratos de clatrato , con una variedad de moléculas pequeñas que pueden incrustarse en su amplia red cristalina. El más notable de ellos es el clatrato de metano , 4 CH
4·23H
2O , se encuentra naturalmente en grandes cantidades en el fondo del océano.
La lluvia es generalmente ligeramente ácida, con un pH entre 5,2 y 5,8 si no tiene ningún ácido más fuerte que el dióxido de carbono. [77] Si hay grandes cantidades de óxidos de nitrógeno y azufre en el aire, estos también se disolverán en las nubes y las gotas de lluvia, produciendo lluvia ácida .
Existen varios isótopos tanto de hidrógeno como de oxígeno, lo que da lugar a varios isotópogos conocidos del agua. El agua oceánica media estándar de Viena es el estándar internacional actual para los isótopos del agua. El agua natural está compuesta casi en su totalidad por el isótopo de hidrógeno sin neutrones protio . Solo 155 ppm incluyen deuterio (2
H o D), un isótopo de hidrógeno con un neutrón y menos de 20 partes por quintillón incluyen tritio (3
H o T), que tiene dos neutrones. El oxígeno también tiene tres isótopos estables, con16
O presente en 99,76%,17
O en 0,04%, y18
O en el 0,2% de las moléculas de agua. [78]
Óxido de deuterio, D
2El O , también se conoce como agua pesada debido a su mayor densidad. Se utiliza en reactores nucleares como moderador de neutrones . El tritio es radiactivo y se desintegra con una vida media de 4500 días; el THO existe en la naturaleza solo en cantidades mínimas y se produce principalmente a través de reacciones nucleares inducidas por rayos cósmicos en la atmósfera. El agua con un átomo de protio y un átomo de deuterio HDO se encuentra de forma natural en el agua ordinaria en concentraciones bajas (~0,03 %) y el D
2O en cantidades mucho menores (0,000003%) y estas moléculas son temporales ya que los átomos se recombinan.
Las diferencias físicas más notables entre H
2O y D
2El O , además de la simple diferencia en la masa específica, implica propiedades que se ven afectadas por los enlaces de hidrógeno, como la congelación y la ebullición, y otros efectos cinéticos. Esto se debe a que el núcleo del deuterio es dos veces más pesado que el del protio, y esto provoca diferencias notables en las energías de enlace. La diferencia en los puntos de ebullición permite separar los isotólogos. El coeficiente de autodifusión del H
2O a 25 °C es un 23% mayor que el valor de D
2O . [79] Debido a que las moléculas de agua intercambian átomos de hidrógeno entre sí, el óxido de deuterio e hidrógeno (DOH) es mucho más común en agua pesada de baja pureza que el monóxido de dideuterio puro D
2Oh .
Consumo de vitamina D pura aislada
2El O puede afectar los procesos bioquímicos: la ingestión de grandes cantidades afecta el funcionamiento de los riñones y del sistema nervioso central. Se pueden consumir pequeñas cantidades sin sufrir efectos nocivos; los seres humanos generalmente no son conscientes de las diferencias de sabor, [80] pero a veces informan una sensación de ardor [81] o un sabor dulce. [82] Se deben consumir cantidades muy grandes de agua pesada para que se manifieste cualquier toxicidad. Sin embargo, las ratas pueden evitar el agua pesada por el olor, y es tóxica para muchos animales. [83]
El agua ligera se refiere al agua pobre en deuterio (DDW), agua en la que el contenido de deuterio se ha reducido por debajo del nivel estándar de 155 ppm .
El agua es la sustancia más abundante en la superficie de la Tierra y también la tercera molécula más abundante en el universo, después del H
2y CO . [23] 0,23 ppm de la masa de la Tierra es agua y el 97,39% del volumen de agua global de 1,38 × 10En los océanos se encuentran 9 km3 . [ 84]
El agua es mucho más frecuente en el Sistema Solar exterior, más allá de un punto llamado línea de congelación , donde la radiación del Sol es demasiado débil para vaporizar el agua sólida y líquida (así como otros elementos y compuestos químicos con puntos de fusión relativamente bajos, como el metano y el amoníaco ). En el Sistema Solar interior, los planetas, asteroides y lunas están formados casi en su totalidad por metales y silicatos. Desde entonces, el agua ha sido entregada al Sistema Solar interior a través de un mecanismo aún desconocido, que se teoriza que son los impactos de asteroides o cometas que transportan agua desde el Sistema Solar exterior, donde los cuerpos contienen mucho más hielo de agua. [85] La diferencia entre los cuerpos planetarios ubicados dentro y fuera de la línea de congelación puede ser marcada. La masa de la Tierra es 0,000023% de agua, mientras que Tetis , una luna de Saturno, está compuesta casi en su totalidad de agua. [86]
El agua es anfótera : tiene la capacidad de actuar como ácido o como base en reacciones químicas. [87] Según la definición de Brønsted-Lowry , un ácido es un protón ( H+) donante y una base es un aceptor de protones. [88] Cuando reacciona con un ácido más fuerte, el agua actúa como una base; cuando reacciona con una base más fuerte, actúa como un ácido. [88] Por ejemplo, el agua recibe un H+
ion de HCl cuando se forma ácido clorhídrico :
En la reacción con amoniaco , NH
3, el agua dona un H+
ion, y por tanto actúa como un ácido:
Debido a que el átomo de oxígeno en el agua tiene dos pares solitarios , el agua a menudo actúa como una base de Lewis , o donante de pares de electrones, en reacciones con ácidos de Lewis , aunque también puede reaccionar con bases de Lewis, formando enlaces de hidrógeno entre los donantes de pares de electrones y los átomos de hidrógeno del agua. La teoría HSAB describe al agua como un ácido duro débil y una base dura débil, lo que significa que reacciona preferentemente con otras especies duras:
Cuando una sal de un ácido débil o de una base débil se disuelve en agua, el agua puede hidrolizar parcialmente la sal, produciendo la base o el ácido correspondiente, lo que da a las soluciones acuosas de jabón y bicarbonato de sodio su pH básico:
El carácter de base de Lewis del agua la convierte en un ligando común en complejos de metales de transición , ejemplos de los cuales incluyen complejos acuosos de metales como Fe(H
2O)2+
6al ácido perrénico , que contiene dos moléculas de agua coordinadas a un centro de renio . En los hidratos sólidos , el agua puede ser un ligando o simplemente estar alojada en la estructura, o ambas cosas. Así, FeSO
4·7 horas
2El O está formado por centros [Fe2 ( H2O ) 6 ] 2+ y un “agua reticular”. El agua es típicamente un ligando monodentado , es decir, forma sólo un enlace con el átomo central. [89]

Como base dura, el agua reacciona fácilmente con carbocationes orgánicos ; por ejemplo, en una reacción de hidratación , un grupo hidroxilo ( OH−
) y un protón ácido se añaden a los dos átomos de carbono unidos entre sí en el doble enlace carbono-carbono, lo que da como resultado un alcohol. Cuando la adición de agua a una molécula orgánica divide la molécula en dos, se dice que ocurre hidrólisis . Ejemplos notables de hidrólisis son la saponificación de grasas y la digestión de proteínas y polisacáridos . El agua también puede ser un grupo saliente en las reacciones de sustitución S N 2 y eliminación E2 ; esta última se conoce entonces como reacción de deshidratación .
El agua contiene hidrógeno en el estado de oxidación +1 y oxígeno en el estado de oxidación −2. [90] Oxida sustancias químicas como hidruros , metales alcalinos y algunos metales alcalinotérreos . [91] [92] Un ejemplo de un metal alcalino que reacciona con el agua es: [93]
Algunos otros metales reactivos, como el aluminio y el berilio , también se oxidan con el agua, pero sus óxidos se adhieren al metal y forman una capa protectora pasiva . [94] Nótese que la oxidación del hierro es una reacción entre el hierro y el oxígeno [95] que se disuelve en agua, no entre el hierro y el agua.
El agua se puede oxidar para emitir gas oxígeno, pero muy pocos oxidantes reaccionan con el agua incluso si su potencial de reducción es mayor que el potencial del O
2/A
2O . Casi todas estas reacciones requieren un catalizador . [96] Un ejemplo de la oxidación del agua es:
El agua se puede dividir en sus elementos constituyentes, hidrógeno y oxígeno, al pasar una corriente eléctrica a través de ella. [97] Este proceso se llama electrólisis. La semirreacción del cátodo es:
La semireacción del ánodo es:
Los gases producidos burbujean hasta la superficie, donde pueden recogerse o encenderse con una llama sobre el agua si esa era la intención. El potencial necesario para la electrólisis del agua pura es de 1,23 V a 25 °C. [97] El potencial operativo es en realidad de 1,48 V o superior en la electrólisis práctica.
Henry Cavendish demostró que el agua estaba compuesta de oxígeno e hidrógeno en 1781. [98] La primera descomposición del agua en hidrógeno y oxígeno, por electrólisis , fue realizada en 1800 por el químico inglés William Nicholson y Anthony Carlisle . [98] [99] En 1805, Joseph Louis Gay-Lussac y Alexander von Humboldt demostraron que el agua está compuesta de dos partes de hidrógeno y una parte de oxígeno. [100]
Gilbert Newton Lewis aisló la primera muestra de agua pesada pura en 1933. [101]
Las propiedades del agua se han utilizado históricamente para definir diversas escalas de temperatura . En particular, las escalas Kelvin , Celsius , Rankine y Fahrenheit se definieron, o se definen actualmente, por los puntos de congelación y ebullición del agua. Las escalas menos comunes de Delisle , Newton , Réaumur y Rømer se definieron de manera similar. El punto triple del agua es un punto estándar más utilizado en la actualidad.
El nombre IUPAC aceptado para el agua es oxidano o simplemente agua , [102] o su equivalente en diferentes idiomas, aunque hay otros nombres sistemáticos que se pueden usar para describir la molécula. El oxidano solo está destinado a usarse como el nombre del hidruro progenitor mononuclear utilizado para nombrar derivados del agua mediante la nomenclatura de sustituyentes . [103] Estos derivados comúnmente tienen otros nombres recomendados. Por ejemplo, se recomienda el nombre hidroxilo en lugar de oxidanilo para el grupo –OH. El nombre oxano es mencionado explícitamente por la IUPAC como inadecuado para este propósito, ya que ya es el nombre de un éter cíclico también conocido como tetrahidropirano . [3] [104]
El nombre sistemático más simple del agua es óxido de hidrógeno . Esto es análogo a compuestos relacionados como peróxido de hidrógeno , sulfuro de hidrógeno y óxido de deuterio (agua pesada). Usando la nomenclatura química para compuestos binarios iónicos de tipo I , el agua tomaría el nombre de monóxido de hidrógeno , [105] pero este no está entre los nombres publicados por la Unión Internacional de Química Pura y Aplicada (IUPAC). [102] Otro nombre es monóxido de dihidrógeno , que es un nombre de agua raramente usado, y usado principalmente en la parodia del monóxido de dihidrógeno .
Otros nombres sistemáticos para el agua incluyen ácido hidróxico , ácido hidroxílico e hidróxido de hidrógeno , utilizando nombres de ácidos y bases. [j] Ninguno de estos nombres exóticos se usa ampliamente. La forma polarizada de la molécula de agua, H+
OH−
, también se denomina hidróxido de hidrógeno según la nomenclatura IUPAC. [106]
La sustancia agua es un término poco común utilizado para H2O cuando no se desea especificar la fase de la materia ( agua líquida , vapor de agua , alguna forma de hielo o un componente de una mezcla), aunque el término "agua" también se utiliza con este significado general.
El dihidruro de oxígeno es otra forma de referirse al agua, pero el uso moderno a menudo restringe el término " hidruro " a compuestos iónicos (que el agua no es).
A veces, estos compuestos tienen nombres genéricos o comunes (p. ej., H2O es "agua") y también tienen nombres sistemáticos (p. ej., H2O, monóxido de dihidrógeno).
El calentamiento del océano domina el inventario global de cambio energético. El calentamiento del océano representa alrededor del 93% del aumento del inventario energético de la Tierra entre 1971 y 2010 (nivel de confianza alto), y el calentamiento de la capa superior del océano (de 0 a 700 m) representa alrededor del 64% del total. El derretimiento del hielo (incluido el hielo marino del Ártico, las capas de hielo y los glaciares) y el calentamiento de los continentes y la atmósfera explican el resto del cambio en la energía.
Gramo
, el peso absoluto de un volumen de agua pura es igual al cubo de la fracción de centímetro del metro y a la temperatura del hielo fondante.
{{cite web}}: CS1 maint: unfit URL (link)El agua, H2O
,
es similar. Tiene dos pares de electrones sin nada unido a ellos. También hay que tenerlos en cuenta. Las moléculas como NH3y
H2O
se
denominan
moléculas
dobladas
.
Nótese que los ángulos de enlace disminuyen a medida que aumenta el número de pares de electrones no enlazantes. Un par de electrones enlazantes es atraído por ambos núcleos de los átomos enlazados, pero un par no enlazante es atraído principalmente por un solo núcleo. Debido a que un par no enlazante experimenta menos atracción nuclear, su dominio electrónico se extiende más en el espacio que el dominio electrónico de un par enlazante (Figura 9.7). Por lo tanto, los pares de electrones no enlazantes ocupan más espacio que los pares enlazantes; en esencia, actúan como globos grandes y más gordos en nuestra analogía de la Figura 9.5. Como resultado, los dominios electrónicos de los pares de electrones no enlazantes ejercen mayores fuerzas repulsivas sobre los dominios electrónicos adyacentes y tienden a comprimir los ángulos de enlace.