
La tinción es una técnica utilizada para mejorar el contraste en las muestras, generalmente a nivel microscópico . Las tinciones y tintes se utilizan frecuentemente en histología (estudio microscópico de tejidos biológicos ), en citología (estudio microscópico de células ) y en los campos médicos de histopatología , hematología y citopatología que se centran en el estudio y diagnóstico de enfermedades a nivel microscópico. . Las tinciones se pueden utilizar para definir tejidos biológicos (resaltando, por ejemplo, fibras musculares o tejido conectivo ), poblaciones de células (clasificando diferentes células sanguíneas ) u orgánulos dentro de células individuales.
En bioquímica , implica agregar un colorante de clase específica ( ADN , proteínas , lípidos , carbohidratos ) a un sustrato para calificar o cuantificar la presencia de un compuesto específico. La tinción y el etiquetado fluorescente pueden tener propósitos similares. La tinción biológica también se utiliza para marcar células en citometría de flujo y para señalar proteínas o ácidos nucleicos en electroforesis en gel . Los microscopios ópticos se utilizan para observar muestras teñidas con un gran aumento, normalmente utilizando iluminación de campo brillante o epifluorescencia.
La tinción no se limita únicamente a materiales biológicos, ya que también se puede utilizar para estudiar la estructura de otros materiales; por ejemplo, las estructuras laminares de polímeros semicristalinos o las estructuras de dominio de copolímeros en bloque .
La tinción in vivo (también llamada tinción vital o tinción intravital) es el proceso de teñir tejidos vivos. Al hacer que ciertas células o estructuras adquieran colores contrastantes, su forma ( morfología ) o posición dentro de una célula o tejido se puede ver y estudiar fácilmente. El objetivo habitual es revelar detalles citológicos que de otro modo podrían no ser evidentes; sin embargo, la tinción también puede revelar dónde tienen lugar ciertas sustancias químicas o reacciones químicas específicas dentro de las células o tejidos.
La tinción in vitro implica colorear células o estructuras que han sido eliminadas de su contexto biológico. Ciertos tintes a menudo se combinan para revelar más detalles y características que un solo tinte. Combinadas con protocolos específicos para la fijación y preparación de muestras, los científicos y médicos pueden utilizar estas técnicas estándar como herramientas de diagnóstico consistentes y repetibles. Una contratinción es una tinción que hace que las células o estructuras sean más visibles, cuando no son completamente visibles con la tinción principal.
Mientras están ex vivo, muchas células continúan viviendo y metabolizándose hasta que se "fijan". Algunos métodos de tinción se basan en esta propiedad. Las tinciones excluidas por las células vivas pero absorbidas por las células ya muertas se denominan tinciones vitales (por ejemplo , azul tripán o yoduro de propidio para las células eucariotas). Las que entran y tiñen las células vivas se denominan tinciones supravitales (por ejemplo , nuevo azul de metileno y azul de cresilo brillante para la tinción de reticulocitos ). Sin embargo, estas manchas acaban siendo tóxicas para el organismo, algunas más que otras. En parte debido a su interacción tóxica dentro de una célula viva, cuando las tinciones supravitales ingresan a una célula viva, pueden producir un patrón característico de tinción diferente al de una célula ya fijada (por ejemplo, apariencia de "reticulocitos" versus "policromasia" difusa). Para lograr los efectos deseados, los tintes se utilizan en soluciones muy diluidas que van desde 1 : 5 000 a 1 : 500 000 (Howey, 2000). Tenga en cuenta que muchas tinciones se pueden utilizar tanto en células vivas como fijas.
Los pasos preparatorios involucrados dependen del tipo de análisis planificado. Es posible que se requieran algunos o todos los siguientes procedimientos.
Las preparaciones húmedas se utilizan para observar organismos vivos y se pueden preparar con agua y ciertos tintes. El líquido se agrega al portaobjetos antes de agregar el organismo y se coloca un cubreobjetos sobre la muestra en el agua y se tiñe para ayudar a contenerla dentro del campo de visión . [1]
La fijación , que a su vez puede constar de varios pasos, tiene como objetivo preservar al máximo la forma de las células o del tejido afectado. A veces se utiliza la fijación por calor para matar, adherir y alterar la muestra para que acepte manchas. La mayoría de los fijadores químicos (sustancias químicas que causan la fijación) generan enlaces químicos entre las proteínas y otras sustancias dentro de la muestra, lo que aumenta su rigidez. Los fijadores comunes incluyen formaldehído , etanol , metanol y/o ácido pícrico . Se pueden incrustar trozos de tejido en cera de parafina para aumentar su resistencia mecánica y estabilidad y facilitar su corte en rodajas finas. [2]
Los mordientes son agentes químicos que tienen el poder de producir tintes para teñir materiales que de otro modo no se podrían teñir.
Los mordientes se clasifican en dos categorías:
a) Mordiente básico: reacciona con colorantes ácidos, por ejemplo, alumbre, sulfato ferroso, cloruro de cetilpiridinio, etc.
b) Mordiente ácido: reacciona con colorantes básicos, por ejemplo, ácido pícrico, ácido tánico, etc.
[2] Tinción Directa: Realizada sin mordiente.
Tinción Indirecta: Tinción con ayuda de un mordiente.
La permeabilización implica el tratamiento de las células con (normalmente) un tensioactivo suave . Este tratamiento disuelve las membranas celulares y permite que moléculas de tinte más grandes ingresen al interior de la célula.
El montaje generalmente implica colocar las muestras en un portaobjetos de vidrio para microscopio para su observación y análisis. En algunos casos, las células se pueden cultivar directamente en un portaobjetos. Para muestras de células sueltas (como en un frotis de sangre o una prueba de Papanicolaou ), la muestra se puede aplicar directamente a un portaobjetos. Para trozos de tejido más grandes, se hacen secciones delgadas (rebanadas) utilizando un micrótomo ; Estas rebanadas luego se pueden montar e inspeccionar.
La mayoría de los tintes comúnmente utilizados en microscopía están disponibles como colorantes certificados por el BSC . Esto significa que las muestras del lote del fabricante han sido analizadas por un organismo independiente, la Biological Stain Commission ( BSC ), y se ha determinado que cumplen o superan ciertos estándares de pureza, contenido de tinte y rendimiento en técnicas de tinción, lo que garantiza experimentos realizados con mayor precisión y mayor confiabilidad. resultados. Estos estándares se publican en la revista Biotechnic & Histochemistry de la comisión . [3] Muchos tintes tienen una composición inconsistente de un proveedor a otro. El uso de tintes certificados por BSC elimina una fuente de resultados inesperados. [4]
Algunos vendedores venden tintes "certificados" por ellos mismos en lugar de por la Comisión de Manchas Biológicas. Dichos productos pueden o no ser adecuados para diagnóstico y otras aplicaciones. [5]

Un método de tinción sencillo para bacterias que suele tener éxito, incluso cuando los métodos de tinción positivos fallan, es utilizar una tinción negativa . Esto se puede lograr untando la muestra sobre el portaobjetos y luego aplicando nigrosina (un tinte sintético negro) o tinta china (una suspensión acuosa de partículas de carbón). Después del secado, los microorganismos pueden verse en microscopía de campo brillante como inclusiones más claras que contrastan con el ambiente oscuro que los rodea. [6] La tinción negativa puede teñir el fondo en lugar de los organismos porque la pared celular de los microorganismos generalmente tiene una carga negativa que repele la tinción cargada negativamente. Los tintes utilizados en la tinción negativa son ácidos. [1] Nota: la tinción negativa es una técnica suave que puede no destruir los microorganismos y, por lo tanto, no es adecuada para estudiar patógenos.
A diferencia de la tinción negativa, la tinción positiva utiliza tintes básicos para colorear la muestra sobre un fondo brillante. Si bien el cromóforo se utiliza tanto para tinciones negativas como positivas, el tipo de cromóforo utilizado en esta técnica es un ion cargado positivamente en lugar de uno negativo. La pared celular cargada negativamente de muchos microorganismos atrae al cromóforo cargado positivamente, lo que hace que la muestra absorba el tinte dándole el color del tinte que se está utilizando. La tinción positiva se utiliza más comúnmente que la tinción negativa en microbiología. Los diferentes tipos de tinción positiva se enumeran a continuación. [1]
La tinción simple es una técnica que solo utiliza un tipo de tinte en un portaobjetos a la vez. Debido a que solo se utiliza un tinte, las muestras (para tintes positivos) o el fondo (para tintes negativos) serán de un color. Por lo tanto, las tinciones simples generalmente se usan para observar solo un organismo por portaobjetos. La tinción diferencial utiliza múltiples tinciones por portaobjetos. Según las tinciones que se utilicen, los organismos con diferentes propiedades aparecerán en diferentes colores, lo que permitirá la categorización de múltiples muestras. La tinción diferencial también se puede utilizar para colorear diferentes orgánulos dentro de un organismo, lo que se puede observar en la tinción de endosporas . [1]
La tinción de Gram se utiliza para determinar el estado de Gram y clasificar las bacterias en términos generales según la composición de su pared celular . La tinción de Gram utiliza cristal violeta para teñir las paredes celulares, yodo (como mordiente) y una contratinción de fucsina o safranina para (marcar todas las bacterias). El estado de Gram ayuda a dividir las muestras de bacterias en dos grupos, generalmente representativos de su filogenia subyacente. Esta característica, en combinación con otras técnicas, la convierte en una herramienta útil en los laboratorios de microbiología clínica, donde puede ser importante en la selección temprana de antibióticos apropiados . [8]
En la mayoría de las preparaciones teñidas con Gram, los organismos Gram negativos aparecen rojos o rosados debido a su contratinción. Debido a la presencia de un mayor contenido de lípidos, después del tratamiento con alcohol, la porosidad de la pared celular aumenta, por lo que el complejo CVI (cristal violeta – yodo) puede atravesarla. Por tanto, la tinción primaria no se conserva. Además, a diferencia de la mayoría de las bacterias Gram positivas, las bacterias Gram negativas tienen sólo unas pocas capas de peptidoglicano y una membrana celular secundaria compuesta principalmente de lipopolisacárido.
La tinción de endosporas se utiliza para identificar la presencia o ausencia de endosporas , que hacen que las bacterias sean muy difíciles de matar. Las esporas bacterianas han demostrado ser difíciles de teñir ya que no son permeables a los reactivos colorantes acuosos. La tinción de endosporas es particularmente útil para identificar patógenos bacterianos formadores de endosporas como Clostridium difficile . Antes del desarrollo de métodos más eficientes, esta tinción se realizaba utilizando el método de Wirtz con fijación por calor y contratinción. Mediante el uso de verde de malaquita y una proporción diluida de carbol fucsina, fijar bacterias en ácido ósmico fue una excelente manera de garantizar que no se mezclen tintes. Sin embargo, los métodos de tinción recientemente revisados han reducido significativamente el tiempo necesario para crear estas tinciones. Esta revisión incluyó la sustitución de carbolfucsina por safranina acuosa combinada con una fórmula recién diluida al 5% de verde malaquita. Esta nueva y mejorada composición de tintes se realizó de la misma manera que antes con el uso de fijación por calor, enjuague y secado para su posterior examen. Tras el examen, todas las bacterias formadoras de endosporas se teñirán de verde y todas las demás células aparecerán de color rojo. [9]
Una tinción de Ziehl-Neelsen es una tinción acidorresistente que se utiliza para teñir especies de Mycobacterium tuberculosis que no se tiñen con los procedimientos de tinción de laboratorio estándar, como la tinción de Gram.
Esta tinción se realiza mediante el uso de carbolfucsina de color rojo que tiñe las bacterias y una tinción contraria como el azul de metileno .

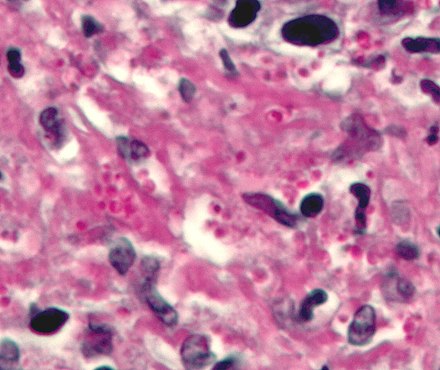
La tinción con hematoxilina y eosina se utiliza con frecuencia en histología para examinar secciones finas de tejido. [10] La hematoxilina tiñe de azul los núcleos celulares, mientras que la eosina tiñe el citoplasma, el tejido conectivo y otras sustancias extracelulares de rosa o rojo. [10] La eosina es fuertemente absorbida por los glóbulos rojos , coloreándolos de color rojo brillante. En una preparación H&E hábilmente elaborada, los glóbulos rojos son casi anaranjados, y el colágeno y el citoplasma (especialmente el músculo) adquieren diferentes tonos de rosa.
La tinción de Papanicolaou , o tinción PAP, se desarrolló para reemplazar la citología por aspiración con aguja fina (PAAF) con la esperanza de disminuir los tiempos de tinción y el costo sin comprometer la calidad. Esta tinción es un método utilizado con frecuencia para examinar muestras de células de una variedad de tipos de tejidos en varios órganos. La tinción PAP ha sufrido varias modificaciones para convertirse en una “alternativa adecuada” a la FNAC. Esta transición surgió de la apreciación de los frotis húmedos fijos por parte de los científicos que preservaban las estructuras de los núcleos en oposición a la apariencia opaca de los frotis de Romanowsky secados al aire. Esto llevó a la creación de una tinción híbrida de fijación húmeda y secado al aire conocida como tinción de Papanicolaou ultrarrápida. Esta modificación incluye el uso de solución salina nasal para rehidratar las células y aumentar la transparencia celular y se combina con el uso de formalina alcohólica para realzar los colores de los núcleos. La tinción de Papanicolaou ahora se utiliza en lugar de la tinción citológica en todos los tipos de órganos debido a su aumento en la calidad morfológica, menor tiempo de tinción y menor costo. Se utiliza con frecuencia para teñir muestras de prueba de Papanicolaou . [11] Utiliza una combinación de hematoxilina , naranja G , eosina Y , verde claro SF amarillento y, a veces, marrón Bismarck Y. [10] [11] [12]
[13] El ácido periódico de Schiff es una tinción histológica especial que se utiliza para marcar los carbohidratos ( glucógeno , glicoproteína , proteoglicanos ). El PAS se usa comúnmente en el tejido hepático donde se producen los depósitos de glucógeno, lo que se realiza en un esfuerzo por distinguir diferentes tipos de enfermedades por almacenamiento de glucógeno. El PAS es importante porque puede detectar gránulos de glucógeno que se encuentran en tumores de ovarios y páncreas del sistema endocrino, así como en la vejiga y los riñones del sistema renal. Las membranas basales también pueden aparecer en una tinción PAS y pueden ser importantes a la hora de diagnosticar una enfermedad renal. Debido al gran volumen de carbohidratos dentro de la pared celular de las hifas y las levaduras de los hongos, la tinción con ácido periódico-Schiff puede ayudar a localizar estas especies dentro de muestras de tejido del cuerpo humano.
El tricrómico de Masson es (como su nombre indica) un protocolo de tinción de tres colores. La receta ha evolucionado a partir de la técnica original de Masson para diferentes aplicaciones específicas, pero todas son adecuadas para distinguir las células del tejido conectivo circundante . La mayoría de las recetas producen queratina y fibras musculares rojas, tinción azul o verde del colágeno y hueso , tinción roja clara o rosada del citoplasma y núcleos celulares negros .
La tinción de Romanowsky se considera una tinción de efecto policromado y se basa en una combinación de eosina plus ( eosina químicamente reducida ) y azul de metileno desmetilado (que contiene sus productos de oxidación azul A y azul B). Esta tinción desarrolla colores variables para todas las estructuras celulares (“efecto Romanowsky-Giemsa) y, por lo tanto, se usó para teñir polimorfos de neutrófilos y núcleos celulares. Las variantes comunes incluyen la tinción de Wright , la tinción de Jenner , la tinción de May-Grunwald, la tinción de Leishman y la tinción de Giemsa .
Todos se utilizan para examinar muestras de sangre o médula ósea . Se prefieren a H&E para la inspección de células sanguíneas porque se pueden distinguir fácilmente diferentes tipos de leucocitos (glóbulos blancos). Todos también son adecuados para el análisis de sangre para detectar parásitos transmitidos por la sangre como la malaria . [14]
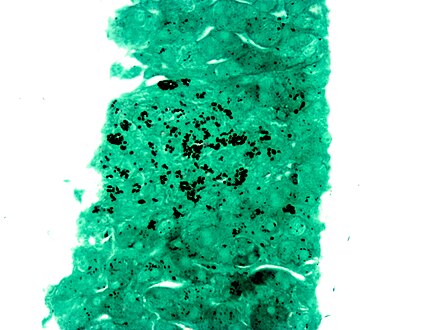
La tinción con plata es el uso de plata para teñir secciones histológicas . Este tipo de tinción es importante en la demostración de proteínas (por ejemplo, colágeno tipo III ) y ADN . Se utiliza para mostrar tanto sustancias dentro como fuera de las células . La tinción con plata también se utiliza en la electroforesis en gel con gradiente de temperatura .
"Las células argentafinas reducen la solución de plata a plata metálica después de la fijación con formalina ". Este método fue descubierto por el italiano Camillo Golgi , al utilizar una reacción entre nitrato de plata y dicromato de potasio , precipitando así el cromato de plata en algunas células (ver método de Golgi ). Las células girofílicas reducen la solución de plata a plata metálica después de ser expuestas al tinte que contiene un reductor . Un ejemplo de esto sería la hidroquinona o la formalina.
La tinción de Sudán utiliza tintes de Sudán para teñir sustancias sudanófilas, que a menudo incluyen lípidos . A menudo se utilizan Sudan III , Sudan IV , Oil Red O , tetróxido de osmio y Sudan Black B. La tinción de Sudán se utiliza a menudo para determinar el nivel de grasa fecal en el diagnóstico de esteatorrea .
La tinción de Wirtz-Conklin es una técnica especial diseñada para teñir endosporas verdaderas con el uso de tinte verde malaquita como tinción principal y safranina como contratinción. Una vez teñidos, no se decoloran. La adición de calor durante el proceso de tinción es un factor que contribuye enormemente. [15] El calor ayuda a abrir la membrana de la espora para que el tinte pueda entrar. El objetivo principal de esta tinción es mostrar la germinación de esporas bacterianas. Si se está llevando a cabo el proceso de germinación, la espora se volverá verde debido al verde de malaquita y la célula circundante se volverá roja debido a la safranina. Esta tinción también puede ayudar a determinar la orientación de la espora dentro de la célula bacteriana; ya sea terminal (en la punta), subterminal (dentro de la célula) o central (completamente en el medio de la célula).
La tinción con péptido hibridizante de colágeno (CHP) permite una manera fácil y directa de teñir colágenos desnaturalizados de cualquier tipo (Tipo I, II, IV, etc.) independientemente de si fueron dañados o degradados por medios enzimáticos, mecánicos, químicos o térmicos. Funcionan replegándose en la triple hélice de colágeno con las hebras individuales disponibles en el tejido. Los CHP se pueden visualizar mediante un simple microscopio de fluorescencia .
Diferentes tintes reaccionan o se concentran en diferentes partes de una célula o tejido, y estas propiedades se aprovechan para revelar partes o áreas específicas. Algunas de las tinciones biológicas más comunes se enumeran a continuación. A menos que se indique lo contrario, todos estos tintes pueden usarse con células y tejidos fijos; Se indican los tintes vitales (adecuados para su uso con organismos vivos).
El naranja de acridina (AO) es un colorante catiónico fluorescente selectivo de ácidos nucleicos útil para la determinación del ciclo celular. Es permeable a las células e interactúa con el ADN y el ARN mediante intercalación o atracciones electrostáticas. Cuando se une al ADN, es espectralmente muy similar a la fluoresceína. Al igual que la fluoresceína, también es útil como colorante no específico para retroiluminar células teñidas convencionalmente en la superficie de una muestra sólida de tejido (tinción con retroiluminación fluorescente [16] ).
[17] El marrón Bismarck (también marrón Bismarck Y o marrón Manchester) imparte un color amarillo a las mucinas ácidas . y un color marrón intenso a los mastocitos. Un defecto de esta mancha es que borra cualquier otra estructura que la rodee y reduce la calidad del contraste. Tiene que combinarse con otros tintes para que sea útil. Algunas tinciones complementarias utilizadas junto con el marrón Bismark son la hematoxilina y el azul de toluidina, que proporcionan un mejor contraste dentro de la muestra histológica.

El carmín es un tinte de color rojo intenso que se utiliza para teñir el glucógeno , mientras que el alumbre carmín es un tinte nuclear. Los tintes de carmín requieren el uso de un mordiente, normalmente de aluminio .
El azul de Coomassie (también azul brillante) tiñe de forma no específica las proteínas con un color azul intenso. Se utiliza a menudo en electroforesis en gel.
El violeta de cresilo tiñe de color violeta los componentes ácidos del citoplasma neuronal, específicamente los cuerpos de Nissl . A menudo se utiliza en la investigación del cerebro.
El violeta cristal , cuando se combina con un mordiente adecuado, tiñe las paredes celulares de color púrpura. El violeta cristal es el colorante utilizado en la tinción de Gram.
DAPI es una tinción nuclear fluorescente , excitada por la luz ultravioleta y que muestra una fuerte fluorescencia azul cuando se une al ADN . DAPI se une a repeticiones de cromosomas ricas en A=T. DAPI tampoco es visible con microscopía de transmisión normal. Puede utilizarse en células vivas o fijas. Las células teñidas con DAPI son especialmente apropiadas para el recuento celular. [18]
La eosina se utiliza con mayor frecuencia como contratinción de la hematoxilina, impartiendo un color rosado o rojo al material citoplasmático , las membranas celulares y algunas estructuras extracelulares. También imparte un color rojo intenso a los glóbulos rojos . La eosina también se puede utilizar como contratinción en algunas variantes de la tinción de Gram y en muchos otros protocolos. En realidad, existen dos compuestos muy estrechamente relacionados a los que comúnmente se hace referencia como eosina. La más utilizada es la eosina Y (también conocida como eosina Y ws o eosina amarillenta); tiene un tono muy ligeramente amarillento. El otro compuesto de eosina es la eosina B (eosina azulada o roja imperial); tiene un tono azulado muy tenue. Los dos tintes son intercambiables, y el uso de uno u otro es más una cuestión de preferencia y tradición.
El bromuro de etidio se intercala y tiñe el ADN, proporcionando una tinción fluorescente de color rojo anaranjado. Aunque no tiñe células sanas, puede usarse para identificar células que se encuentran en las etapas finales de apoptosis ; dichas células tienen membranas mucho más permeables . En consecuencia, el bromuro de etidio se utiliza a menudo como marcador de apoptosis en poblaciones de células y para localizar bandas de ADN en electroforesis en gel . La tinción también se puede utilizar junto con naranja de acridina (AO) en el recuento de células viables. Esta tinción combinada EB/AO hace que las células vivas presenten una fluorescencia verde, mientras que las células apoptóticas conservan la fluorescencia distintiva de color rojo anaranjado.
La fucsina ácida se puede utilizar para teñir colágeno, músculo liso o mitocondrias . La fucsina ácida se utiliza como colorante nuclear y citoplasmático en el método tricrómico de Mallory. La fucsina ácida tiñe el citoplasma en algunas variantes del tricrómico de Masson. En la picrofucsina de Van Gieson, la fucsina ácida imparte su color rojo a las fibras de colágeno. La fucsina ácida también es un colorante tradicional para las mitocondrias (método de Altmann).
La hematoxilina (hematoxilina en América del Norte) es una tinción nuclear. [10] Utilizado con un mordiente, la hematoxilina tiñe los núcleos de color azul violeta o marrón. [10] Se utiliza con mayor frecuencia con eosina en la tinción H&E (hematoxilina y eosina), uno de los procedimientos más comunes en histología . [10]
Hoechst es un compuesto derivado de bisbencimidazol que se une al surco menor del ADN . Utilizadas a menudo en microscopía de fluorescencia para la tinción de ADN, las tinciones de Hoechst aparecen de color amarillo cuando se disuelven en soluciones acuosas y emiten luz azul bajo excitación ultravioleta. Hay dos tipos principales de Hoechst : Hoechst 33258 y Hoechst 33342 . Los dos compuestos son funcionalmente similares, pero con una pequeña diferencia en estructura. Hoechst 33258 contiene un grupo hidroxilo terminal y, por lo tanto, es más soluble en solución acuosa; sin embargo, esta característica reduce su capacidad para penetrar la membrana plasmática . Hoechst 33342 contiene una sustitución de etilo en el grupo hidroxilo terminal (es decir, un grupo éter etílico), lo que lo hace más hidrofóbico para facilitar el paso a la membrana plasmática.
El yodo se utiliza en química como indicador del almidón . Cuando se mezcla almidón con yodo en solución, se desarrolla un color azul intensamente oscuro, que representa un complejo almidón/yodo. El almidón es una sustancia común a la mayoría de las células vegetales, por lo que una solución débil de yodo manchará el almidón presente en las células. El yodo es un componente de la técnica de tinción conocida como tinción de Gram , utilizada en microbiología . Utilizado como mordiente en la tinción de Gram, el yodo favorece la entrada del tinte a través de los poros presentes en la pared/membrana celular.
La solución de Lugol o yodo de Lugol (IKI) es una solución marrón que se vuelve negra en presencia de almidones y puede usarse como tinte celular, haciendo que los núcleos celulares sean más visibles.
Utilizada con vinagre común (ácido acético), la solución de Lugol se utiliza para identificar cambios precancerosos y cancerosos en los tejidos cervicales y vaginales durante los exámenes de seguimiento de "prueba de Papanicolaou" en preparación para la biopsia. El ácido acético hace que las células anormales palidezcan de color blanco, mientras que los tejidos normales se tiñen de un marrón caoba debido al yodo. [19]
El verde malaquita (también conocido como verde diamante B o verde victoria B) se puede utilizar como contratinción azul verdosa de la safranina en la técnica de tinción de Giménez para bacterias. También se puede utilizar para teñir directamente las esporas .
El verde de metilo se usa comúnmente con microscopios de campo brillante y de fluorescencia [20] para teñir la cromatina de las células para que puedan verse más fácilmente.
El azul de metileno se utiliza para teñir células animales, como las células de las mejillas humanas, para hacer que sus núcleos sean más observables. También se utiliza para teñir extensiones de sangre en citología.
El rojo neutro (o rojo de toluileno) tiñe el rojo de sustancia Nissl . Suele utilizarse como contratinción en combinación con otros tintes.
El azul del Nilo (o azul del Nilo A) tiñe los núcleos de azul. Puede usarse con células vivas.
El rojo del Nilo (también conocido como oxazona azul del Nilo) se forma hirviendo el azul del Nilo con ácido sulfúrico . Esto produce una mezcla de rojo Nilo y azul Nilo. El rojo Nilo es una tinción lipófila ; se acumulará en los glóbulos de lípidos dentro de las células, tiñéndolas de rojo. El rojo del Nilo se puede utilizar con células vivas. Tiene una fuerte fluorescencia cuando se divide en lípidos, pero prácticamente no emite ninguna fluorescencia en solución acuosa.
El tetraóxido de osmio se utiliza en microscopía óptica para teñir lípidos . Se disuelve en grasas y los materiales orgánicos lo reducen a osmio elemental, una sustancia negra fácilmente visible.
El yoduro de propidio es un agente intercalante fluorescente que puede usarse para teñir células. El yoduro de propidio se utiliza como tinción de ADN en citometría de flujo para evaluar la viabilidad celular o el contenido de ADN en el análisis del ciclo celular, o en microscopía para visualizar el núcleo y otros orgánulos que contienen ADN. El yoduro de propidio no puede atravesar la membrana de las células vivas, por lo que es útil para diferenciar células necróticas, apoptóticas y sanas. El PI también se une al ARN, lo que requiere tratamiento con nucleasas para distinguir entre tinción de ARN y ADN.
La rodamina es una tinción fluorescente específica de proteína que se usa comúnmente en microscopía de fluorescencia.
La safranina (o Safranina O) es un tinte catiónico rojo. Se une a los núcleos (ADN) y otros polianiones tisulares , incluidos los glucosaminoglicanos en el cartílago y los mastocitos, y a los componentes de la lignina y los plastidios en los tejidos vegetales. [21] La safranina no debe confundirse con el azafrán, un costoso tinte natural que se utiliza en algunos métodos para impartir un color amarillo al colágeno, para contrastar con los colores azul y rojo impartidos por otros tintes a los núcleos y el citoplasma en animales (incluidos los humanos). tejidos.
La ortografía incorrecta "safranina" es de uso común. La terminación -ina es apropiada para la safranina O porque este tinte es una amina. [4] [22] [23]
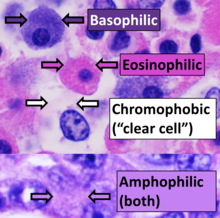
Los tejidos que captan las manchas se llaman cromáticos . Los cromosomas recibieron ese nombre debido a su capacidad para absorber una tinción violeta.
La afinidad positiva por una mancha específica puede designarse con el sufijo -fílico . Por ejemplo, los tejidos que se tiñen con un tinte azul pueden denominarse azurófilos . Esto también se puede utilizar para propiedades de tinción más generalizadas, como acidófilas para tejidos que se tiñen con tinciones ácidas (sobre todo eosina ), basófilas cuando se tiñen con tintes básicos y anfófilas [24] cuando se tiñen con tintes ácidos o básicos. Por el contrario, los tejidos cromófobos no absorben fácilmente el tinte coloreado.
Al igual que en la microscopía óptica, se pueden utilizar tinciones para mejorar el contraste en la microscopía electrónica de transmisión . Normalmente se utilizan compuestos de metales pesados densos en electrones.
[25] El ácido fosfotúngstico es una tinción negativa común para virus , nervios , polisacáridos y otros materiales tisulares biológicos. Se utiliza principalmente en una forma de ph de 0,5-2%, lo que lo hace neutro y se combina con agua para formar una solución acuosa. El ácido fosfotúngstico está lleno de materia densa en electrones que tiñe el fondo que rodea la muestra de oscuro y la propia muestra de color claro. Este proceso no es la técnica positiva normal para la tinción donde la muestra es oscura y el fondo permanece claro.
El tetróxido de osmio se utiliza en microscopía óptica para teñir lípidos . Se disuelve en grasas y los materiales orgánicos lo reducen a osmio elemental, una sustancia negra fácilmente visible. Debido a que es un metal pesado que absorbe electrones, es quizás el tinte más común utilizado para la morfología en microscopía electrónica biológica. También se utiliza para la tinción de diversos polímeros para el estudio de su morfología mediante TEM. OsO
4Es muy volátil y extremadamente tóxico. Es un agente oxidante fuerte ya que el osmio tiene un número de oxidación de +8. Oxida agresivamente muchos materiales, dejando un depósito de osmio no volátil en un estado de oxidación más bajo.
El tetróxido de rutenio es igualmente volátil e incluso más agresivo que el tetraóxido de osmio y puede teñir incluso materiales que resisten la tinción de osmio, por ejemplo, el polietileno.
Otros productos químicos utilizados en la tinción por microscopía electrónica incluyen: molibdato de amonio , yoduro de cadmio , carbohidrazida , cloruro férrico , hexamina , tricloruro de indio , nitrato de lantano (III) , acetato de plomo , citrato de plomo , nitrato de plomo (II) , ácido periódico , ácido fosfomolíbdico , potasio. ferricianuro , ferrocianuro de potasio , rojo de rutenio , nitrato de plata , proteinato de plata , cloroaurato de sodio, nitrato de talio , tiosemicarbazida , acetato de uranilo , nitrato de uranilo y sulfato de vanadilo .