El níquel es un elemento químico ; su símbolo es Ni y su número atómico es 28. Es un metal brillante de color blanco plateado con un ligero tinte dorado. El níquel es un metal de transición duro y dúctil . El níquel puro es químicamente reactivo, pero las piezas grandes reaccionan lentamente con el aire en condiciones estándar porque se forma una capa de pasivación de óxido de níquel en la superficie que evita una mayor corrosión. Aun así, el níquel nativo puro se encuentra en la corteza terrestre solo en cantidades minúsculas, generalmente en rocas ultramáficas , [8] [9] y en el interior de meteoritos de níquel-hierro más grandes que no estuvieron expuestos al oxígeno cuando estaban fuera de la atmósfera terrestre.
El níquel meteórico se encuentra en combinación con hierro , lo que refleja el origen de esos elementos como principales productos finales de la nucleosíntesis de las supernovas . Se cree que una mezcla de hierro y níquel compone los núcleos externo e interno de la Tierra . [10]
El uso del níquel (como aleación meteórica natural de níquel y hierro) se remonta al año 3500 a. C. El níquel fue aislado y clasificado por primera vez como elemento en 1751 por Axel Fredrik Cronstedt , quien inicialmente confundió el mineral con un mineral de cobre , en las minas de cobalto de Los, Hälsingland, Suecia . El nombre del elemento proviene de un travieso duende de la mitología minera alemana, Nickel (similar a Old Nick ). Los minerales de níquel pueden ser verdes, como los minerales de cobre, y se los conocía como kupfernickel (el cobre de Nickel) porque no producían cobre.
Aunque la mayor parte del níquel en la corteza terrestre existe en forma de óxidos, los minerales de níquel económicamente más importantes son los sulfuros, especialmente la pentlandita . Los principales sitios de producción incluyen la región de Sudbury , Canadá (que se cree que es de origen meteórico ), Nueva Caledonia en el Pacífico , Australia Occidental y Norilsk , Rusia. [11]
El níquel es uno de los cuatro elementos (los otros son el hierro , el cobalto y el gadolinio ) [12] que son ferromagnéticos aproximadamente a temperatura ambiente. Los imanes permanentes de alnico basados parcialmente en níquel tienen una resistencia intermedia entre los imanes permanentes basados en hierro y los imanes de tierras raras . El metal se utiliza principalmente en aleaciones y enchapados resistentes a la corrosión.
Alrededor del 68% de la producción mundial se utiliza en acero inoxidable . Un 10% adicional se utiliza para aleaciones a base de níquel y cobre, un 9% para enchapado, un 7% para aceros aleados, un 3% en fundiciones y un 4% en otras aplicaciones como en baterías recargables, [13] incluidas las de los vehículos eléctricos (VE). [14] El níquel se usa ampliamente en monedas , aunque los objetos niquelados a veces provocan alergia al níquel . Como compuesto, el níquel tiene varios usos de fabricación química de nicho, como catalizador para hidrogenación , cátodos para baterías recargables, pigmentos y tratamientos de superficies metálicas. [15] El níquel es un nutriente esencial para algunos microorganismos y plantas que tienen enzimas con níquel como sitio activo . [16]

El níquel es un metal blanco plateado con un ligero tinte dorado que se pule mucho. Es uno de los cuatro elementos que son ferromagnéticos a temperatura ambiente o cerca de ella; los otros son el hierro, el cobalto y el gadolinio . Su temperatura de Curie es de 355 °C (671 °F), lo que significa que el níquel a granel no es magnético por encima de esta temperatura. [18] [12] La celda unitaria del níquel es un cubo centrado en las caras ; tiene un parámetro reticular de 0,352 nm, lo que da un radio atómico de 0,124 nm. Esta estructura cristalina es estable a presiones de al menos 70 GPa. El níquel es duro, maleable y dúctil , y tiene una conductividad eléctrica y térmica relativamente alta para los metales de transición. [19] La alta resistencia a la compresión de 34 GPa, predicha para cristales ideales, nunca se obtiene en el material a granel real debido a la formación y movimiento de dislocaciones . Sin embargo, se ha alcanzado en nanopartículas de Ni . [20]
El níquel tiene dos configuraciones electrónicas atómicas , [Ar] 3d 8 4s 2 y [Ar] 3d 9 4s 1 , que son muy cercanas en energía; [Ar] denota la estructura completa del núcleo de argón . Existe cierto desacuerdo sobre qué configuración tiene la energía más baja. [21] Los libros de texto de química citan la configuración electrónica del níquel como [Ar] 4s 2 3d 8 , [22] también escrito [Ar] 3d 8 4s 2 . [23] Esta configuración concuerda con la regla de ordenamiento de energía de Madelung , que predice que 4s se llena antes que 3d. Está respaldada por el hecho experimental de que el estado de energía más bajo del átomo de níquel es un nivel de energía 3d 8 4s 2 , específicamente el nivel 3d 8 ( 3 F) 4s 2 3 F, J = 4. [24] [25]
Sin embargo, cada una de estas dos configuraciones se divide en varios niveles de energía debido a la estructura fina , [24] [25] y los dos conjuntos de niveles de energía se superponen. La energía promedio de los estados con [Ar] 3d 9 4s 1 es en realidad menor que la energía promedio de los estados con [Ar] 3d 8 4s 2 . Por lo tanto, la literatura de investigación sobre cálculos atómicos cita la configuración del estado fundamental como [Ar] 3d 9 4s 1 . [21]
Los isótopos del níquel varían en peso atómico desde 48 u (48
Ni ) a 82 u (82
Ni ). [7]
El níquel natural se compone de cinco isótopos estables ,58
No ,60
No ,61
No ,62
Ni y64
Ni , de los cuales58
El Ni es el más abundante (68,077% de abundancia natural ). [7]
El níquel-62 tiene la energía de enlace más alta por nucleón de todos los nucleidos : 8,7946 MeV/nucleón. [26] [27] Su energía de enlace es mayor que la de ambos56Fe y58Fe , los nucleidos más abundantes a menudo se citan incorrectamente como los que tienen la energía de enlace más alta. [28] Aunque esto parecería predecir que el níquel es el elemento pesado más abundante en el universo, la alta tasa de fotodesintegración del níquel en el interior de las estrellas hace que el hierro sea, con mucho, el más abundante. [28]
El níquel-60 es el producto hijo del radionúclido extinto 60Fe (vida media de 2,6 millones de años). Debido a la larga vida media de60
Fe , su persistencia en materiales del Sistema Solar puede generar variaciones observables en la composición isotópica de60
Ni . Por lo tanto, la abundancia de60
El Ni presente en material extraterrestre puede proporcionar información sobre el origen del Sistema Solar y su historia temprana. [29]
Se han caracterizado al menos 26 radioisótopos de níquel; los más estables son59
Ni con una vida media de 76.000 años,63
Ni (100 años), y56
Ni (6 días). Todos los demás radioisótopos tienen vidas medias inferiores a 60 horas y la mayoría de ellos tienen vidas medias inferiores a 30 segundos. Este elemento también tiene un estado meta . [7]
El níquel-56 radiactivo se produce mediante el proceso de combustión del silicio y luego se libera en grandes cantidades en las supernovas de tipo Ia . La forma de la curva de luz de estas supernovas en tiempos intermedios y tardíos corresponde a la desintegración por captura de electrones de56
Ni a cobalto -56 y finalmente a hierro-56. [30] El níquel-59 es un radionúclido cosmogénico de larga duración ; vida media de 76.000 años.59
El Ni ha encontrado muchas aplicaciones en la geología isotópica .59
El níquel se ha utilizado para datar la edad terrestre de los meteoritos y para determinar la abundancia de polvo extraterrestre en el hielo y los sedimentos . Se cree que el níquel-78, con una vida media de 110 milisegundos, es un isótopo importante en la nucleosíntesis de elementos más pesados que el hierro en las supernovas. [31] El 48Ni , descubierto en 1999, es el isótopo de elemento pesado más rico en protones conocido. Con 28 protones y 20 neutrones , el 48Ni es " doblemente mágico ", al igual que el 78Ni con 28 protones y 50 neutrones. Por lo tanto, ambos son inusualmente estables para núcleos con un desequilibrio protón-neutrón tan grande . [7] [32]
El níquel-63 es un contaminante que se encuentra en la estructura de soporte de los reactores nucleares. Se produce a través de la captura de neutrones por el níquel-62. También se han encontrado pequeñas cantidades cerca de los sitios de prueba de armas nucleares en el Pacífico Sur. [33]

Los minerales de níquel se clasifican como óxidos o sulfuros. Los óxidos incluyen laterita , donde las principales mezclas minerales son limonita niquelífera , (Fe,Ni)O(OH) y garnierita (una mezcla de varios níquel hidratado y silicatos ricos en níquel). [34] Los sulfuros de níquel existen comúnmente como soluciones sólidas con hierro en minerales como la pentlandita y la pirrotita con la fórmula Fe 9-x Ni x S 8 y Fe 7-x Ni x S 6 , respectivamente. Otros minerales comunes que contienen Ni son la millerita y la niccolita arseniuro . [35] [36]
Los recursos terrestres identificados en todo el mundo con un contenido promedio de níquel del 1% o más comprenden al menos 130 millones de toneladas de níquel (aproximadamente el doble de las reservas conocidas). Alrededor del 60% se encuentra en lateritas y el 40% en depósitos de sulfuro. [37]
Según las evidencias geofísicas , se cree que la mayor parte del níquel de la Tierra se encuentra en los núcleos externos e internos de la Tierra . La kamacita y la taenita son aleaciones naturales de hierro y níquel. En el caso de la kamacita, la aleación suele estar en una proporción de 90:10 a 95:5, aunque pueden estar presentes impurezas (como cobalto o carbono ). La taenita contiene entre un 20% y un 65% de níquel. La kamacita y la taenita también se encuentran en meteoritos de níquel y hierro . [38]
El níquel se encuentra comúnmente en meteoritos de hierro como las aleaciones kamacita y taenita . El níquel en meteoritos fue detectado por primera vez en 1799 por Joseph-Louis Proust , un químico francés que entonces trabajaba en España. Proust analizó muestras del meteorito de Campo del Cielo (Argentina), que había sido obtenido en 1783 por Miguel Rubín de Celis, descubriendo la presencia en ellas de níquel (alrededor del 10%) junto con hierro. [39]
El estado de oxidación más común del níquel es +2, pero los compuestos de Ni 0 , Ni + y Ni 3+ son bien conocidos, y se han caracterizado los estados de oxidación exóticos Ni 2− y Ni − . [40]

El tetracarbonilo de níquel (Ni(CO) 4 ), descubierto por Ludwig Mond [41] , es un líquido volátil y altamente tóxico a temperatura ambiente. Al calentarlo, el complejo se descompone nuevamente en níquel y monóxido de carbono:
Este comportamiento se aprovecha en el proceso Mond para purificar níquel, como se describió anteriormente. El complejo de níquel(0) relacionado, bis(ciclooctadieno)níquel(0), es un catalizador útil en la química de organoníquel porque los ligandos de ciclooctadieno (o cod ) se desplazan fácilmente.

Los complejos de níquel(I) son poco comunes, pero un ejemplo es el complejo tetraédrico NiBr(PPh 3 ) 3 . Muchos complejos de níquel(I) tienen enlaces Ni–Ni, como el diamagnético rojo oscuro K 4 [Ni 2 (CN) 6 ] preparado por reducción de K 2 [Ni 2 (CN) 6 ] con amalgama de sodio . Este compuesto se oxida en agua, liberando H 2 . [42]
Se cree que el estado de oxidación del níquel (I) es importante para las enzimas que contienen níquel, como la [NiFe]-hidrogenasa , que cataliza la reducción reversible de protones a H 2 . [43]
_complexes_in_aqueous_solution.jpg/440px-Color_of_various_Ni(II)_complexes_in_aqueous_solution.jpg)
-sulfate-hexahydrate-sample.jpg/440px-Nickel(II)-sulfate-hexahydrate-sample.jpg)
El níquel (II) forma compuestos con todos los aniones comunes, incluidos sulfuro , sulfato , carbonato, hidróxido, carboxilatos y haluros. El sulfato de níquel (II) se produce en grandes cantidades disolviendo níquel metálico u óxidos en ácido sulfúrico , formando tanto un hexahidrato como un heptahidrato [44] útiles para la galvanoplastia de níquel. Las sales comunes de níquel, como el cloruro, el nitrato y el sulfato, se disuelven en agua para dar soluciones verdes del complejo metálico acuoso [Ni(H 2 O) 6 ] 2+ . [45]
Los cuatro haluros forman compuestos de níquel, que son sólidos con moléculas con centros de Ni octaédricos. El cloruro de níquel (II) es el más común y su comportamiento es ilustrativo de los otros haluros. El cloruro de níquel (II) se obtiene disolviendo níquel o su óxido en ácido clorhídrico . Se suele encontrar como hexahidrato verde, cuya fórmula suele escribirse NiCl 2 ·6H 2 O . Cuando se disuelve en agua, esta sal forma el complejo acuoso metálico [Ni(H 2 O) 6 ] 2+ . La deshidratación de NiCl 2 ·6H 2 O da NiCl 2 anhidro amarillo . [46]
Algunos complejos tetracoordinados de níquel(II), por ejemplo, el cloruro de bis(trifenilfosfina)níquel , existen tanto en geometrías tetraédricas como plano-cuadradas. Los complejos tetraédricos son paramagnéticos ; los complejos plano-cuadrados son diamagnéticos . Al tener propiedades de equilibrio magnético y formación de complejos octaédricos, contrastan con los complejos divalentes de los metales más pesados del grupo 10, paladio(II) y platino(II), que forman solo geometría plano-cuadrada. [40]
El niqueloceno tiene un recuento de electrones de 20. Muchas reacciones químicas del niqueloceno tienden a producir productos de 18 electrones. [47]

Se conocen muchos compuestos de Ni(III). El Ni(III) forma sales simples con iones fluoruro [48] o de óxido . El Ni(III) puede estabilizarse mediante ligandos σ-donadores como los tioles y las organofosfinas [42] .
El Ni(III) se encuentra en el hidróxido de óxido de níquel , que se utiliza como cátodo en muchas baterías recargables , incluidas las de níquel-cadmio , níquel-hierro , níquel-hidrógeno y níquel-hidruro metálico , y que algunos fabricantes utilizan en baterías de iones de litio . [49]
El Ni(IV) sigue siendo un estado de oxidación poco frecuente y se conocen muy pocos compuestos. El Ni(IV) se presenta en el óxido mixto BaNiO 3 . [50] [51] [52] [53]
El uso involuntario de níquel se remonta al año 3500 a. C. Se ha descubierto que los bronces de lo que hoy es Siria contienen hasta un 2 % de níquel. [54] Algunos manuscritos chinos antiguos sugieren que allí se utilizó "cobre blanco" ( cuproníquel , conocido como baitong ) entre 1700 y 1400 a. C. Este cobre blanco de Paktong se exportó a Gran Bretaña ya en el siglo XVII, pero el contenido de níquel de esta aleación no se descubrió hasta 1822. [55] Los reyes bactrianos Agatocles , Eutidemo II y Pantaleón acuñaron monedas de aleación de níquel y cobre en el siglo II a. C., posiblemente a partir del cuproníquel chino. [56]

En la Alemania medieval, se encontró un mineral amarillo metálico en los Montes Metálicos que se parecía al mineral de cobre. Pero cuando los mineros no pudieron obtener nada de cobre de él, culparon a un duende travieso de la mitología alemana, Nickel (similar al viejo Nick ), por acosar al cobre. Llamaron a este mineral Kupfernickel del alemán Kupfer 'cobre'. [57] [58] [59] [60] Este mineral ahora se conoce como el mineral nickeline (anteriormente niccolite [61] ), un arseniuro de níquel . En 1751, el barón Axel Fredrik Cronstedt intentó extraer cobre del kupfernickel en una mina de cobalto en el pueblo de Los, Suecia , y en su lugar produjo un metal blanco al que llamó níquel en honor al espíritu que había dado su nombre al mineral. [62] En alemán moderno, Kupfernickel o Kupfer-Nickel designa la aleación cuproníquel . [19]
En un principio, la única fuente de níquel era el raro Kupfernickel. A partir de 1824, el níquel se obtuvo como subproducto de la producción de azul de cobalto . La primera fundición a gran escala de níquel comenzó en Noruega en 1848 a partir de pirrotita rica en níquel . La introducción del níquel en la producción de acero en 1889 aumentó la demanda de níquel; los depósitos de níquel de Nueva Caledonia , descubiertos en 1865, proporcionaron la mayor parte del suministro mundial entre 1875 y 1915. El descubrimiento de los grandes depósitos en la cuenca de Sudbury en Canadá en 1883, en Norilsk -Talnakh en Rusia en 1920 y en el arrecife Merensky en Sudáfrica en 1924 hizo posible la producción de níquel a gran escala. [55]

Aparte de las monedas bactrianas antes mencionadas, el níquel no fue un componente de las monedas hasta mediados del siglo XIX. [63]
En Canadá (el mayor productor de níquel del mundo en ese momento) se acuñaron monedas de cinco centavos con 99,9 % de níquel durante los años en que no hubo guerra, de 1922 a 1981; el contenido de metal hizo que estas monedas fueran magnéticas. [64] Durante los años de guerra de 1942 a 1945, se eliminó la mayor parte o la totalidad del níquel de las monedas canadienses y estadounidenses para guardarlo para fabricar armaduras. [58] Canadá utilizó níquel con 99,9 % de níquel desde 1968 en sus monedas de mayor valor hasta el año 2000. [65]
Las monedas de níquel casi puro se utilizaron por primera vez en 1881 en Suiza. [66]
Birmingham falsificó monedas de níquel alrededor de 1833 para comercializarlas en Malasia. [67]
En los Estados Unidos, el término "nickel" o "nick" se aplicó originalmente al centavo de cobre-níquel Flying Eagle , que reemplazó al cobre con 12% de níquel entre 1857 y 1858, y luego al centavo Indian Head de la misma aleación entre 1859 y 1864. Más tarde, en 1865, el término designó al níquel de tres centavos , con un aumento del níquel al 25%. En 1866, el níquel de cinco centavos Shield (25% de níquel, 75% de cobre) se apropió de la designación, que se ha utilizado desde entonces para las piezas de 5 centavos posteriores. Esta proporción de aleación no es ferromagnética .
La moneda de níquel estadounidense contiene 0,04 onzas (1,1 g) de níquel, que al precio de abril de 2007 valía 6,5 centavos, junto con 3,75 gramos de cobre por un valor de unos 3 centavos, con un valor total del metal de más de 9 centavos. Dado que el valor nominal de un níquel es de 5 centavos, esto lo convirtió en un objetivo atractivo para la fundición por parte de personas que querían vender los metales con una ganancia. La Casa de la Moneda de los Estados Unidos , anticipándose a esta práctica, implementó nuevas reglas provisionales el 14 de diciembre de 2006, sujetas a comentarios públicos durante 30 días, que penalizaban la fundición y exportación de centavos y níqueles. [68] Los infractores pueden ser castigados con una multa de hasta $ 10,000 y/o un máximo de cinco años de prisión. [69] A partir del 19 de septiembre de 2013, el valor de fusión de un níquel estadounidense (cobre y níquel incluidos) es de $ 0,045 (90% del valor nominal). [70]
En el siglo XXI, el alto precio del níquel ha llevado a que se sustituyera en parte este metal en las monedas de todo el mundo. Entre las monedas que todavía se fabrican con aleaciones de níquel se encuentran las de uno y dos euros , las de 5¢, 10¢, 25¢, 50¢ y 1 dólar estadounidense [71] y las de 20p, 50p, 1£ y 2£ del Reino Unido . A partir de 2012, la aleación de níquel utilizada para las monedas de 5p y 10p del Reino Unido se sustituyó por acero niquelado. Esto encendió una controversia pública sobre los problemas de las personas con alergia al níquel [66] .


Se estima que se extraen 3,3 millones de toneladas (t) de níquel al año en todo el mundo; Indonesia (1.600.000 t), Filipinas (330.000 t), Rusia (220.000 t), Nueva Caledonia ( Francia ) (190.000 t), Australia (160.000 t) y Canadá (130.000 t) son los mayores productores en 2022. [73] Los mayores depósitos de níquel en la Europa no rusa se encuentran en Finlandia y Grecia . Las fuentes terrestres identificadas que promedian al menos un 1% de níquel contienen al menos 130 millones de toneladas de níquel. Alrededor del 60% está en lateritas y el 40% en depósitos de sulfuro. Además, se encuentran extensas fuentes de níquel en las profundidades del Océano Pacífico , especialmente en un área llamada la Zona Clarion Clipperton en forma de nódulos polimetálicos que salpican el fondo marino a 3,5-6 km bajo el nivel del mar . [74] [75] Estos nódulos están compuestos de numerosos metales de tierras raras y se estima que contienen un 1,7% de níquel. [76] Con los avances en ciencia e ingeniería , la Autoridad Internacional de los Fondos Marinos está estableciendo actualmente una regulación para garantizar que estos nódulos se recolecten de una manera consciente con el medio ambiente y al mismo tiempo adhiriéndose a los Objetivos de Desarrollo Sostenible de las Naciones Unidas . [77]
El único lugar en los Estados Unidos donde se ha extraído níquel de manera rentable es Riddle, Oregon , con varios kilómetros cuadrados de depósitos superficiales de garnierita que contienen níquel . La mina cerró en 1987. [78] [79] El proyecto de la mina Eagle es una nueva mina de níquel en la península superior de Michigan . La construcción se completó en 2013 y las operaciones comenzaron en el tercer trimestre de 2014. [80] En el primer año completo de operación, la mina Eagle produjo 18.000 t. [80]

El níquel se obtiene mediante metalurgia extractiva : se extrae del mineral mediante procesos convencionales de tostación y reducción que dan como resultado un metal con una pureza superior al 75 %. En muchas aplicaciones de acero inoxidable , se puede utilizar níquel con una pureza del 75 % sin purificación adicional, dependiendo de las impurezas. [44]
Tradicionalmente, la mayoría de los minerales de sulfuro se procesan utilizando técnicas pirometalúrgicas para producir una mata para su posterior refinación. También se utilizan técnicas hidrometalúrgicas . La mayoría de los depósitos de sulfuro se han procesado tradicionalmente mediante concentración a través de un proceso de flotación por espuma seguido de una extracción pirometalúrgica. La mata de níquel se procesa posteriormente con el proceso Sherritt-Gordon . Primero, se elimina el cobre añadiendo sulfuro de hidrógeno , dejando un concentrado de cobalto y níquel. Luego, se utiliza la extracción con disolventes para separar el cobalto y el níquel, con un contenido final de níquel superior al 86%. [81]
Un segundo proceso de refinación común es la lixiviación de la mata de metal en una solución de sal de níquel, seguida de la extracción electrolítica del níquel de la solución colocándolo sobre un cátodo como níquel electrolítico. [82]

El metal más puro se obtiene a partir del óxido de níquel mediante el proceso Mond , que da una pureza de más del 99,99%. El proceso fue patentado por Ludwig Mond y ha estado en uso industrial desde antes de principios del siglo XX. [83] En este proceso, el níquel se trata con monóxido de carbono en presencia de un catalizador de azufre a alrededor de 40-80 °C para formar carbonilo de níquel . En una reacción similar con el hierro, se puede formar pentacarbonilo de hierro , aunque esta reacción es lenta. Si es necesario, el níquel se puede separar por destilación. El octacarbonilo de dicobalto también se forma en la destilación del níquel como un subproducto, pero se descompone en dodecacarbonilo de tetracobalto a la temperatura de reacción para dar un sólido no volátil. [11]
El níquel se obtiene a partir del carbonilo de níquel mediante uno de dos procesos. Puede pasarse a través de una gran cámara a altas temperaturas en la que se agitan constantemente decenas de miles de esferas de níquel (pellets). El carbonilo se descompone y deposita níquel puro sobre las esferas. En el proceso alternativo, el carbonilo de níquel se descompone en una cámara más pequeña a 230 °C para crear un polvo fino de níquel. El monóxido de carbono resultante se recircula y se reutiliza. El producto de níquel altamente puro se conoce como "níquel carbonilo". [84]
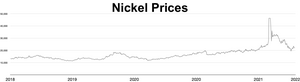
El precio de mercado del níquel aumentó durante 2006 y los primeros meses de 2007; al 5 de abril de 2007 [actualizar], el metal se cotizaba a 52.300 dólares la tonelada o 1,47 dólares la onza. [85] Posteriormente, el precio cayó drásticamente; a septiembre de 2017 [actualizar], el metal se cotizaba a 11.000 dólares la tonelada, o 0,31 dólares la onza. [86] Durante la invasión rusa de Ucrania en 2022 , las preocupaciones sobre las sanciones a las exportaciones rusas de níquel desencadenaron una contracción de posiciones cortas , lo que provocó que el precio del níquel se cuadriplicara en solo dos días, alcanzando los 100.000 dólares la tonelada. [87] [88] La Bolsa de Metales de Londres canceló contratos por valor de 3.900 millones de dólares y suspendió el comercio de níquel durante más de una semana. [89] El analista Andy Home argumentó que tales shocks de precios se ven exacerbados por los requisitos de pureza impuestos por los mercados de metales: sólo el metal de Grado I (99,8% puro) puede usarse como materia prima en las bolsas, pero la mayor parte del suministro mundial es en aleaciones de ferroníquel o purezas de menor grado. [90]

El uso global de níquel actualmente es del 68% en acero inoxidable, 10% en aleaciones no ferrosas , 9% en galvanoplastia , 7% en acero de aleación, 3% en fundiciones y 4% en otros (incluidas las baterías). [13]
El níquel se utiliza en muchos productos industriales y de consumo reconocibles, incluidos el acero inoxidable , los imanes de alnico , las monedas, las baterías recargables (por ejemplo, de níquel-hierro ), las cuerdas de guitarra eléctrica, las cápsulas de micrófono, el enchapado de accesorios de plomería, [91] y aleaciones especiales como permalloy , elinvar e invar . Se utiliza para enchapado y como tinte verde en el vidrio. El níquel es preeminentemente un metal de aleación, y su principal uso es en aceros de níquel y hierros fundidos de níquel, en los que generalmente aumenta la resistencia a la tracción, la tenacidad y el límite elástico. Se usa ampliamente en muchas otras aleaciones, incluidos los latones y bronces de níquel y las aleaciones con cobre, cromo, aluminio, plomo, cobalto, plata y oro ( Inconel , Incoloy , Monel , Nimonic ). [82]

Como el níquel es resistente a la corrosión, se lo utilizó ocasionalmente como sustituto de la plata decorativa. El níquel también se utilizó ocasionalmente en algunos países después de 1859 como metal de acuñación barato (véase más arriba), pero en los últimos años del siglo XX, fue reemplazado por aleaciones de acero inoxidable (es decir, hierro) más económicas, excepto en los Estados Unidos y Canadá. [63]
El níquel es un excelente agente de aleación para ciertos metales preciosos y se utiliza en el ensayo de fuego como colector de elementos del grupo del platino (PGE). Como tal, el níquel puede recolectar completamente los seis PGE de los minerales y puede recolectar parcialmente el oro. Las minas de níquel de alto rendimiento también pueden realizar la recuperación de PGE (principalmente platino y paladio ); ejemplos son Norilsk, Rusia y la cuenca de Sudbury, Canadá. [92]
La espuma de níquel o la malla de níquel se utilizan en electrodos de difusión de gas para pilas de combustible alcalinas . [93] [94]
El níquel y sus aleaciones se utilizan a menudo como catalizadores para reacciones de hidrogenación . El níquel Raney , una aleación de níquel y aluminio finamente dividida, es una forma común, aunque también se utilizan catalizadores relacionados, incluidos los catalizadores de tipo Raney. [95]
El níquel es naturalmente magnetostrictivo: en presencia de un campo magnético , el material sufre un pequeño cambio de longitud. [96] [97] La magnetostricción del níquel es del orden de 50 ppm y es negativa, lo que indica que se contrae. [98]
El níquel se utiliza como aglutinante en la industria del carburo de tungsteno cementado o de los metales duros y se utiliza en proporciones del 6% al 12% en peso. El níquel hace que el carburo de tungsteno sea magnético y añade resistencia a la corrosión a las piezas cementadas, aunque la dureza es menor que la de aquellas con aglutinante de cobalto. [99]
63
El Ni , con una vida media de 100,1 años, es útil en dispositivos de kritrón como emisor de partículas beta ( electrones de alta velocidad ) para hacer más fiable la ionización por el electrodo de mantenimiento de vida. [100] Se está investigando como fuente de energía para baterías betavoltaicas . [101] [102]
Alrededor del 27% de toda la producción de níquel se utiliza para ingeniería, el 10% para construcción, el 14% para productos tubulares, el 20% para productos metálicos, el 14% para transporte, el 11% para productos electrónicos y el 5% para otros usos. [13]
El níquel Raney se utiliza ampliamente para la hidrogenación de aceites insaturados para elaborar margarina , y la margarina de calidad inferior y el aceite sobrante pueden contener níquel como contaminante . Forte et al. descubrieron que los pacientes diabéticos tipo 2 tienen 0,89 ng/mL de Ni en la sangre en relación con 0,77 ng/mL en sujetos de control. [103]
El níquel-titanio es una aleación de porcentajes atómicos aproximadamente iguales de sus metales constituyentes que exhibe dos propiedades únicas y estrechamente relacionadas: el efecto de memoria de forma y la superelasticidad .
No fue reconocido hasta la década de 1970, pero se sabe que el níquel juega un papel importante en la biología de algunas plantas, bacterias , arqueas y hongos . [104] [105] [106] Las enzimas de níquel como la ureasa se consideran factores de virulencia en algunos organismos. [107] [108] La ureasa cataliza la hidrólisis de la urea para formar amoníaco y carbamato . [105] [104] Las hidrogenasas NiFe pueden catalizar la oxidación de H 2 para formar protones y electrones; y también la reacción inversa, la reducción de protones para formar gas hidrógeno. [105] [104] Una coenzima níquel-tetrapirrol, el cofactor F430 , está presente en la metil coenzima M reductasa, que puede catalizar la formación de metano, o la reacción inversa, en arqueas metanogénicas (en estado de oxidación +1). [109] Una de las enzimas deshidrogenasas de monóxido de carbono consiste en un grupo Fe -Ni -S . [110] Otras enzimas que contienen níquel incluyen una clase bacteriana rara de superóxido dismutasa [111] y enzimas glioxalasa I en bacterias y varios parásitos tripanosómicos eucariotas [112] (en otros organismos, incluyendo levaduras y mamíferos, esta enzima contiene Zn 2+ divalente ). [113] [114] [115] [116] [117]
El níquel en la dieta puede afectar la salud humana a través de infecciones por bacterias dependientes del níquel, pero el níquel también puede ser un nutriente esencial para las bacterias que viven en el intestino grueso, funcionando en efecto como un prebiótico . [118] El Instituto de Medicina de los Estados Unidos no ha confirmado que el níquel sea un nutriente esencial para los humanos, por lo que no se ha establecido ni una Ingesta Dietética Recomendada (IDR) ni una Ingesta Adecuada. El nivel máximo tolerable de ingesta de níquel en la dieta es de 1 mg/día en forma de sales solubles de níquel. La ingesta dietética estimada es de 70 a 100 μg/día; menos del 10% se absorbe. Lo que se absorbe se excreta en la orina. [119] Cantidades relativamente grandes de níquel, comparables a la ingestión promedio estimada anteriormente, se filtran en los alimentos cocinados en acero inoxidable. Por ejemplo, la cantidad de níquel lixiviado después de 10 ciclos de cocción en una porción de salsa de tomate promedia 88 μg. [120] [121]
Se sospecha que el níquel liberado por las erupciones volcánicas de las Trampas Siberianas ayudó al crecimiento de Methanosarcina , un género de arqueas euryarchaeotes que produjeron metano en el evento de extinción masiva del Pérmico-Triásico , la mayor extinción masiva conocida . [122]
La principal fuente de exposición al níquel es el consumo oral, ya que el níquel es esencial para las plantas. [124] Las concentraciones de fondo típicas de níquel no superan los 20 ng/m 3 en el aire, 100 mg/kg en el suelo, 10 mg/kg en la vegetación, 10 μg/L en agua dulce y 1 μg/L en agua de mar. [125] Las concentraciones ambientales pueden aumentar por la contaminación humana. Por ejemplo, los grifos niquelados pueden contaminar el agua y el suelo; la minería y la fundición pueden verter níquel en las aguas residuales ; los utensilios de cocina de aleación de níquel y acero y los platos pigmentados con níquel pueden liberar níquel en los alimentos. El aire puede estar contaminado por el refinado de minerales de níquel y la combustión de combustibles fósiles . Los humanos pueden absorber níquel directamente del humo del tabaco y del contacto de la piel con joyas, champús , detergentes y monedas . Una forma menos común de exposición crónica es a través de la hemodiálisis , ya que los rastros de iones de níquel pueden absorberse en el plasma a partir de la acción quelante de la albúmina . [ cita requerida ]
La exposición diaria media no supone una amenaza para la salud humana. La mayor parte del níquel absorbido por los seres humanos se elimina por los riñones y se elimina del cuerpo a través de la orina o por el tracto gastrointestinal sin ser absorbido. El níquel no es un veneno acumulativo, pero dosis mayores o la exposición crónica por inhalación pueden ser tóxicas, incluso cancerígenas , y constituir un riesgo laboral . [126]
Los compuestos de níquel se clasifican como carcinógenos humanos [127] [128] [129] [130] basándose en el aumento de los riesgos de cáncer respiratorio observado en estudios epidemiológicos de trabajadores de refinerías de minerales sulfídicos. [131] Esto está respaldado por los resultados positivos de los bioensayos NTP con subsulfuro de Ni y óxido de Ni en ratas y ratones. [132] [133] Los datos humanos y animales indican consistentemente una falta de carcinogenicidad a través de la vía de exposición oral y limitan la carcinogenicidad de los compuestos de níquel a tumores respiratorios después de la inhalación. [134] [135] El níquel metálico está clasificado como un carcinógeno sospechoso; [127] [128] [129] existe coherencia entre la ausencia de un aumento de los riesgos de cáncer respiratorio en trabajadores expuestos predominantemente al níquel metálico [131] y la ausencia de tumores respiratorios en un estudio de carcinogenicidad por inhalación de por vida en ratas con polvo de níquel metálico. [136] En los estudios de inhalación de roedores con varios compuestos de níquel y níquel metálico, se observó un aumento de la inflamación pulmonar con y sin hiperplasia o fibrosis de los ganglios linfáticos bronquiales. [130] [132] [136] [137] En estudios con ratas, la ingestión oral de sales de níquel solubles en agua puede provocar mortalidad perinatal en animales preñados. [138] No está claro si estos efectos son relevantes para los humanos, ya que los estudios epidemiológicos de trabajadoras altamente expuestas no han mostrado efectos adversos de toxicidad para el desarrollo. [139]
Las personas pueden estar expuestas al níquel en el lugar de trabajo por inhalación, ingestión y contacto con la piel o los ojos. La Administración de Seguridad y Salud Ocupacional (OSHA) ha establecido el límite legal ( límite de exposición permisible ) para el lugar de trabajo en 1 mg/m3 por día laboral de 8 horas, excluyendo el carbonilo de níquel. El Instituto Nacional para la Seguridad y Salud Ocupacional (NIOSH) establece el límite de exposición recomendado (REL) en 0,015 mg/m3 por día laboral de 8 horas. A 10 mg/m3 , el níquel es inmediatamente peligroso para la vida y la salud . [140] El carbonilo de níquel [Ni(CO) 4 ] es un gas extremadamente tóxico. La toxicidad de los carbonilos metálicos es una función tanto de la toxicidad del metal como de la liberación de monóxido de carbono de los grupos funcionales carbonilo; el carbonilo de níquel también es explosivo en el aire. [141] [142]
Las personas sensibilizadas pueden mostrar una alergia cutánea al níquel conocida como dermatitis de contacto . Las personas muy sensibilizadas también pueden reaccionar a alimentos con alto contenido de níquel. [143] Los pacientes con pompholyx también pueden ser sensibles al níquel. El níquel es el principal alérgeno de contacto confirmado en todo el mundo, en parte debido a su uso en joyas para orejas perforadas . [144] Las alergias al níquel que afectan a las orejas perforadas suelen estar marcadas por picazón y enrojecimiento de la piel. Muchos pendientes se fabrican ahora sin níquel o con níquel de baja liberación [145] para abordar este problema. La cantidad permitida en productos que entran en contacto con la piel humana ahora está regulada por la Unión Europea . En 2002, los investigadores descubrieron que el níquel liberado por las monedas de 1 y 2 euros excedía con creces esos estándares. Se cree que esto se debe a una reacción galvánica . [146] El níquel fue votado Alérgeno del Año en 2008 por la Sociedad Americana de Dermatitis de Contacto. [147] En agosto de 2015, la Academia Estadounidense de Dermatología adoptó una declaración de posición sobre la seguridad del níquel: "Las estimaciones sugieren que la dermatitis de contacto, que incluye la sensibilización al níquel, representa aproximadamente 1.918 millones de dólares y afecta a casi 72,29 millones de personas". [143]
Los informes muestran que tanto la activación inducida por níquel del factor inducible por hipoxia (HIF-1) como la regulación positiva de los genes inducibles por hipoxia son causadas por el agotamiento del ascorbato intracelular . La adición de ascorbato al medio de cultivo aumentó el nivel intracelular de ascorbato y revirtió tanto la estabilización inducida por metales de la expresión génica dependiente de HIF-1 y HIF-1α. [148] [149]
En el segundo libro de Oz, The Marvelous Land of Oz (de L. Frank Baum, publicado por Reilly & Britton , 1904), el Leñador de Hojalata afirma que ha hecho que le recubran el cuerpo de hojalata con níquel. A partir de entonces, tiene mucho cuidado de no dejar que el niquelado se raye, se melle o se estropee. [150]
En esta tabla Ni I = átomo de Ni neutro, Ni II = Ni+, etc.
De 1968 a 1999, las monedas de 25 y 10 centavos canadienses se acuñaron con 99,9 % de níquel y las de 5 centavos con 25 a 99,9 % de níquel.
.... Ese aumento en el níquel permitió que los metanógenos despegaran.
{{cite web}}: CS1 maint: bot: estado de URL original desconocido ( enlace )