El metano ( EE. UU .: / ˈmɛθeɪn / METH - ayn , Reino Unido : / ˈm iːθeɪn / MEE -thayn ) es un compuesto químico con la fórmula química CH4 ( un átomo de carbono unido a cuatro átomos de hidrógeno ). Es un hidruro del grupo 14 , el alcano más simple y el principal constituyente del gas natural . La abundancia de metano en la Tierra lo convierte en un combustible económicamente atractivo , aunque capturarlo y almacenarlo es difícil porque es un gas a temperatura y presión estándar . En la atmósfera terrestre, el metano es transparente a la luz visible, pero absorbe la radiación infrarroja, actuando como un gas de efecto invernadero . El metano es un compuesto orgánico y uno de los compuestos orgánicos más simples. El metano también es un hidrocarburo .
El metano natural se encuentra tanto bajo tierra como bajo el fondo marino y se forma mediante procesos geológicos y biológicos. La mayor reserva de metano se encuentra bajo el fondo marino en forma de clatratos de metano . Cuando el metano alcanza la superficie y la atmósfera , se lo conoce como metano atmosférico . [9]
La concentración atmosférica de metano en la Tierra ha aumentado alrededor de un 160% desde 1750, y el porcentaje abrumador se debe a la actividad humana. [10] Representó el 20% del forzamiento radiativo total de todos los gases de efecto invernadero de larga duración y mezclados a nivel mundial , según el informe de 2021 del Grupo Intergubernamental de Expertos sobre el Cambio Climático . [11] Unas reducciones fuertes, rápidas y sostenidas de las emisiones de metano podrían limitar el calentamiento a corto plazo y mejorar la calidad del aire al reducir el ozono superficial global. [12]
También se ha detectado metano en otros planetas, incluido Marte , lo que tiene implicaciones para la investigación astrobiológica . [13]
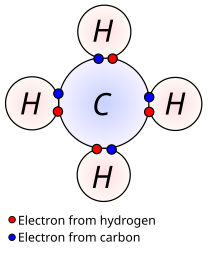
El metano es una molécula tetraédrica con cuatro enlaces C–H equivalentes . Su estructura electrónica se describe mediante cuatro orbitales moleculares de enlace (OM) resultantes de la superposición de los orbitales de valencia de C y H. El OM de menor energía es el resultado de la superposición del orbital 2s del carbono con la combinación en fase de los orbitales 1s de los cuatro átomos de hidrógeno. Por encima de este nivel de energía hay un conjunto triplemente degenerado de OM que implica la superposición de los orbitales 2p del carbono con varias combinaciones lineales de los orbitales 1s del hidrógeno. El esquema de enlace "tres sobre uno" resultante es coherente con las mediciones espectroscópicas de fotoelectrones.
El metano es un gas inodoro, incoloro y transparente. [14] Absorbe la luz visible, especialmente en el extremo rojo del espectro, debido a las bandas de sobretonos , pero el efecto solo se nota si el recorrido de la luz es muy largo. Esto es lo que da a Urano y Neptuno sus colores azul o verde azulado, ya que la luz pasa a través de sus atmósferas que contienen metano y luego se dispersa de nuevo. [15]
El olor familiar del gas natural que se utiliza en los hogares se consigue añadiendo un odorante , normalmente mezclas que contienen terc -butiltiol , como medida de seguridad. El metano tiene un punto de ebullición de -161,5 °C a una presión de una atmósfera . [3] Como gas, es inflamable en un rango de concentraciones (5,4%–17%) en el aire a presión estándar .
El metano sólido existe en varias modificaciones . Actualmente se conocen nueve. [16] El enfriamiento del metano a presión normal da como resultado la formación de metano I. Esta sustancia cristaliza en el sistema cúbico ( grupo espacial Fm 3 m). Las posiciones de los átomos de hidrógeno no son fijas en el metano I, es decir, las moléculas de metano pueden rotar libremente. Por lo tanto, es un cristal plástico . [17]
Las reacciones químicas principales del metano son la combustión , la reformación con vapor para generar gas de síntesis y la halogenación . En general, las reacciones del metano son difíciles de controlar.
La oxidación parcial del metano a metanol ( C H 3 OH ), un combustible líquido más conveniente, es un desafío porque la reacción generalmente progresa hasta el dióxido de carbono y el agua incluso con un suministro insuficiente de oxígeno . La enzima metano monooxigenasa produce metanol a partir de metano, pero no se puede utilizar para reacciones a escala industrial. [18] Se han desarrollado algunos sistemas catalizados homogéneamente y sistemas heterogéneos, pero todos tienen desventajas significativas. Estos generalmente funcionan generando productos protegidos que están protegidos de la sobreoxidación. Los ejemplos incluyen el sistema Catalytica , las zeolitas de cobre y las zeolitas de hierro que estabilizan el sitio activo del oxígeno alfa . [19]
Un grupo de bacterias cataliza la oxidación del metano con nitrito como oxidante en ausencia de oxígeno , dando lugar a la llamada oxidación anaeróbica del metano . [20]
Al igual que otros hidrocarburos , el metano es un ácido extremadamente débil . Se estima que su p K a en DMSO es 56. [21] No se puede desprotonar en solución, pero la base conjugada se conoce en formas como el metil-litio .
Se han observado diversos iones positivos derivados del metano, principalmente como especies inestables en mezclas de gases a baja presión. Entre ellos se encuentran el catión metenio o metilo CH+3, catión metano CH+4, y metanio o metano protonado CH+5Algunos de estos se han detectado en el espacio exterior . El metanio también se puede producir como soluciones diluidas a partir de metano con superácidos . Los cationes con mayor carga, como el CH2+6y CH3+7, se han estudiado teóricamente y se ha conjeturado que son estables. [22]
A pesar de la fuerza de sus enlaces C–H, existe un intenso interés en los catalizadores que facilitan la activación del enlace C–H en el metano (y otros alcanos de menor número ). [23]

El calor de combustión del metano es de 55,5 MJ/kg. [24] La combustión del metano es una reacción de varios pasos que se resume a continuación:
La química de cuatro pasos de Peters es una química de cuatro pasos sistemáticamente reducida que explica la combustión de metano.
Dadas las condiciones adecuadas, el metano reacciona con radicales halógenos de la siguiente manera:
donde X es un halógeno : flúor (F), cloro (Cl), bromo (Br) o yodo (I). Este mecanismo para este proceso se llama halogenación de radicales libres . Se inicia cuando la luz UV o algún otro iniciador de radicales (como peróxidos ) produce un átomo de halógeno. Se produce una reacción en cadena de dos pasos en la que el átomo de halógeno abstrae un átomo de hidrógeno de una molécula de metano, lo que da como resultado la formación de una molécula de haluro de hidrógeno y un radical metilo ( •CH 3 ). El radical metilo reacciona luego con una molécula del halógeno para formar una molécula de halometano, con un nuevo átomo de halógeno como subproducto. [25] Pueden ocurrir reacciones similares en el producto halogenado, lo que lleva al reemplazo de átomos de hidrógeno adicionales por átomos de halógeno con estructuras de dihalometano , trihalometano y, en última instancia, tetrahalometano , dependiendo de las condiciones de reacción y la relación halógeno-metano.
Esta reacción se utiliza habitualmente con cloro para producir diclorometano y cloroformo a partir de clorometano . El tetracloruro de carbono se puede preparar con un exceso de cloro.
El metano puede transportarse como líquido refrigerado (gas natural licuado o GNL ). Si bien las fugas de un contenedor de líquido refrigerado son inicialmente más pesadas que el aire debido a la mayor densidad del gas frío, el gas a temperatura ambiente es más liviano que el aire. Los gasoductos distribuyen grandes cantidades de gas natural, del cual el metano es el componente principal.
El metano se utiliza como combustible para hornos, hogares, calentadores de agua, hornos, automóviles, [26] [27] turbinas, etc.
Como componente principal del gas natural , el metano es importante para la generación de electricidad al quemarlo como combustible en una turbina de gas o un generador de vapor . En comparación con otros combustibles de hidrocarburos , el metano produce menos dióxido de carbono por cada unidad de calor liberada. Con aproximadamente 891 kJ/mol, el calor de combustión del metano es menor que el de cualquier otro hidrocarburo, pero la relación entre el calor de combustión (891 kJ/mol) y la masa molecular (16,0 g/mol, de los cuales 12,0 g/mol son carbono) muestra que el metano, al ser el hidrocarburo más simple, produce más calor por unidad de masa (55,7 kJ/g) que otros hidrocarburos complejos. En muchas áreas con una población lo suficientemente densa, el metano se transporta por tuberías a hogares y empresas para calefacción , cocina y usos industriales. En este contexto, generalmente se lo conoce como gas natural , que se considera que tiene un contenido energético de 39 megajulios por metro cúbico o 1000 BTU por pie cúbico estándar . El gas natural licuado (GNL) es predominantemente metano ( CH 4 ) convertido en forma líquida para facilitar su almacenamiento o transporte.
El metano líquido refinado , así como el GNL, se utilizan como combustible para cohetes , [28] cuando se combinan con oxígeno líquido , como en los motores TQ-12 , BE-4 , Raptor y YF-215 . [29] Debido a las similitudes entre el metano y el GNL, estos motores se agrupan comúnmente bajo el término methalox .
Como propulsor líquido para cohetes , una combinación de metano/ oxígeno líquido ofrece la ventaja sobre la combinación de queroseno / oxígeno líquido , o kerolox, de producir moléculas de escape pequeñas, reduciendo la coquización o la deposición de hollín en los componentes del motor. El metano es más fácil de almacenar que el hidrógeno debido a su punto de ebullición y densidad más altos, así como a su falta de fragilización por hidrógeno . [30] [31] El menor peso molecular del escape también aumenta la fracción de energía térmica que está en forma de energía cinética disponible para la propulsión, lo que aumenta el impulso específico del cohete. En comparación con el hidrógeno líquido , la energía específica del metano es menor, pero esta desventaja se compensa con la mayor densidad y rango de temperatura del metano, lo que permite un tanque más pequeño y liviano para una masa de combustible dada. El metano líquido tiene un rango de temperatura (91–112 K) casi compatible con el oxígeno líquido (54–90 K). El combustible actualmente se utiliza en vehículos de lanzamiento operativos como Zhuque-2 y Vulcan , así como en lanzadores en desarrollo como Starship , Neutron y Terran R. [32]
El gas natural , que se compone principalmente de metano, se utiliza para producir gas hidrógeno a escala industrial. El reformado de metano con vapor (SMR), o simplemente conocido como reformado con vapor, es el método industrial estándar para producir gas hidrógeno comercial a granel. Más de 50 millones de toneladas métricas se producen anualmente en todo el mundo (2013), principalmente a partir del SMR de gas natural. [33] Gran parte de este hidrógeno se utiliza en refinerías de petróleo , en la producción de productos químicos y en el procesamiento de alimentos. Se utilizan cantidades muy grandes de hidrógeno en la síntesis industrial de amoníaco .
A altas temperaturas (700–1100 °C) y en presencia de un catalizador a base de metal ( níquel ), el vapor reacciona con el metano para producir una mezcla de CO y H 2 , conocida como "gas de agua" o " gas de síntesis ":
Esta reacción es fuertemente endotérmica (consume calor, Δ H r = 206 kJ/mol). Se obtiene hidrógeno adicional mediante la reacción de CO con agua mediante la reacción de desplazamiento de agua-gas :
Esta reacción es ligeramente exotérmica (produce calor, Δ H r = −41 kJ/mol).
El metano también se somete a cloración de radicales libres en la producción de clorometanos, aunque el metanol es un precursor más típico. [34]
El hidrógeno también se puede producir a través de la descomposición directa del metano, también conocida como pirólisis del metano , que, a diferencia del reformado con vapor, no produce gases de efecto invernadero (GEI). El calor necesario para la reacción también puede estar libre de emisiones de GEI, por ejemplo, a partir de luz solar concentrada, electricidad renovable o quemando parte del hidrógeno producido. Si el metano proviene del biogás , entonces el proceso puede ser un sumidero de carbono . Se requieren temperaturas superiores a 1200 °C para romper los enlaces del metano y producir gas hidrógeno y carbono sólido. [35]
Sin embargo, mediante el uso de un catalizador adecuado, la temperatura de reacción se puede reducir a entre 550 y 900 °C, dependiendo del catalizador elegido. Se han probado docenas de catalizadores, incluidos catalizadores metálicos soportados y no soportados, catalizadores carbonosos y catalizadores de metal-carbono. [36]
La reacción es moderadamente endotérmica como se muestra en la ecuación de reacción a continuación. [37]
Como refrigerante , el metano tiene la designación ASHRAE R-50 .

El metano puede generarse a través de rutas geológicas, biológicas o industriales.

Las dos principales rutas para la generación geológica de metano son (i) orgánica (generada térmicamente o termogénica) y (ii) inorgánica ( abiótica ). [13] El metano termogénico se produce debido a la ruptura de materia orgánica a temperaturas y presiones elevadas en estratos sedimentarios profundos . La mayor parte del metano en cuencas sedimentarias es termogénico; por lo tanto, el metano termogénico es la fuente más importante de gas natural. Los componentes del metano termogénico generalmente se consideran reliquias (de una época anterior). Generalmente, la formación de metano termogénico (en profundidad) puede ocurrir a través de la ruptura de materia orgánica o síntesis orgánica. Ambas formas pueden involucrar microorganismos ( metanogénesis ), pero también pueden ocurrir de manera inorgánica. Los procesos involucrados también pueden consumir metano, con y sin microorganismos.
La fuente más importante de metano en profundidad (roca cristalina) es abiótica. Abiótico significa que el metano se crea a partir de compuestos inorgánicos, sin actividad biológica, ya sea a través de procesos magmáticos [ se necesita un ejemplo ] o mediante reacciones entre el agua y la roca que ocurren a bajas temperaturas y presiones, como la serpentinización . [38] [39]
La mayor parte del metano de la Tierra es biogénico y se produce por metanogénesis , [40] [41] una forma de respiración anaeróbica que solo se sabe que realizan algunos miembros del dominio Archaea . [42] Los metanógenos se encuentran en vertederos y suelos , [43] rumiantes (por ejemplo, ganado ), [44] los intestinos de las termitas y los sedimentos anóxicos debajo del lecho marino y el fondo de los lagos.
Estos microorganismos utilizan este proceso de varios pasos para obtener energía. La reacción neta de la metanogénesis es:
El paso final del proceso es catalizado por la enzima metil coenzima M reductasa (MCR). [45]

Los humedales son las mayores fuentes naturales de metano a la atmósfera, [46] y representan aproximadamente entre el 20 y el 30 % del metano atmosférico. [47] El cambio climático está aumentando la cantidad de metano liberado por los humedales debido al aumento de las temperaturas y a la alteración de los patrones de precipitaciones. Este fenómeno se denomina retroalimentación de metano de los humedales . [48]
El cultivo de arroz genera hasta un 12% de las emisiones globales totales de metano debido a las inundaciones a largo plazo de los arrozales. [49]
Los rumiantes, como el ganado, emiten metano, que representa aproximadamente el 22% de las emisiones anuales de metano de los Estados Unidos a la atmósfera. [50] Un estudio informó que el sector ganadero en general (principalmente ganado, pollos y cerdos) produce el 37% de todo el metano inducido por el hombre. [51] Un estudio de 2013 estimó que el ganado representaba el 44% del metano inducido por el hombre y aproximadamente el 15% de las emisiones de gases de efecto invernadero inducidas por el hombre. [52] Se están realizando muchos esfuerzos para reducir la producción de metano del ganado, como tratamientos médicos y ajustes dietéticos, [53] [54] y para atrapar el gas para utilizar su energía de combustión. [55]
La mayor parte del subsuelo marino es anóxico porque el oxígeno es eliminado por microorganismos aeróbicos dentro de los primeros centímetros del sedimento . Debajo del fondo marino repleto de oxígeno, los metanógenos producen metano que es utilizado por otros organismos o queda atrapado en hidratos de gas . [42] Estos otros organismos que utilizan el metano como energía se conocen como metanótrofos ('comedores de metano'), y son la razón principal por la que el poco metano generado en profundidad llega a la superficie del mar. [42] Se ha descubierto que los consorcios de arqueas y bacterias oxidan el metano a través de la oxidación anaeróbica del metano (AOM); los organismos responsables de esto son las arqueas metanotróficas anaeróbicas (ANME) y las bacterias reductoras de sulfato (SRB). [56]

Dada su abundancia y bajo precio en el gas natural, existen pocos incentivos para producir metano de manera industrial. El metano se puede producir hidrogenando dióxido de carbono mediante el proceso Sabatier . El metano también es un subproducto de la hidrogenación de monóxido de carbono en el proceso Fischer-Tropsch , que se practica a gran escala para producir moléculas de cadena más larga que el metano.
Un ejemplo de gasificación de carbón a metano a gran escala es la planta Great Plains Synfuels , que comenzó a construirse en 1984 en Beulah, Dakota del Norte , como una forma de desarrollar los abundantes recursos locales de lignito de baja calidad , un recurso que de otro modo sería difícil de transportar debido a su peso, contenido de cenizas , bajo valor calorífico y propensión a la combustión espontánea durante el almacenamiento y el transporte. Existen varias plantas similares en todo el mundo, aunque la mayoría de ellas están destinadas a la producción de alcanos de cadena larga para su uso como gasolina , diésel o materia prima para otros procesos.
La conversión de energía a metano es una tecnología que utiliza energía eléctrica para producir hidrógeno a partir de agua mediante electrólisis y utiliza la reacción de Sabatier para combinar hidrógeno con dióxido de carbono para producir metano.
El metano se puede producir mediante la protonación de metil litio o un reactivo de Grignard de metilo como el cloruro de metilmagnesio . También se puede fabricar a partir de acetato de sodio anhidro e hidróxido de sodio seco , mezclados y calentados a más de 300 °C (con carbonato de sodio como subproducto). [ cita requerida ] En la práctica, la necesidad de metano puro se puede satisfacer fácilmente con botellas de gas de acero de proveedores de gas estándar.
El metano es el componente principal del gas natural, aproximadamente el 87% en volumen. La principal fuente de metano es la extracción de depósitos geológicos conocidos como campos de gas natural , siendo la extracción de gas de veta de carbón una fuente importante (véase extracción de metano de lecho de carbón , un método para extraer metano de un depósito de carbón , mientras que la recuperación mejorada de metano de lecho de carbón es un método para recuperar metano de vetas de carbón no explotables). Está asociado con otros combustibles de hidrocarburos y, a veces, acompañado de helio y nitrógeno . El metano se produce a niveles superficiales (baja presión) por descomposición anaeróbica de materia orgánica y metano reelaborado de las profundidades de la superficie de la Tierra. En general, los sedimentos que generan gas natural están enterrados a mayor profundidad y a temperaturas más altas que los que contienen petróleo .
El metano generalmente se transporta a granel por gasoductos en su forma de gas natural, o por buques metaneros en su forma licuada; pocos países lo transportan en camión.
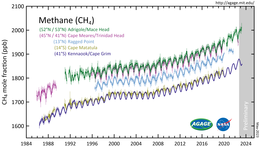
El metano es un importante gas de efecto invernadero , responsable de alrededor del 30% del aumento de las temperaturas globales desde la revolución industrial. [57]
El metano tiene un potencial de calentamiento global (GWP) de 29,8 ± 11 en comparación con el CO2 (potencial de 1) durante un período de 100 años, y de 82,5 ± 25,8 durante un período de 20 años. [58] Esto significa que, por ejemplo, una fuga de una tonelada de metano equivale a emitir 82,5 toneladas de dióxido de carbono. La quema de metano y la producción de dióxido de carbono también reducen el impacto de los gases de efecto invernadero en comparación con la simple emisión de metano a la atmósfera.

A medida que el metano se convierte gradualmente en dióxido de carbono (y agua) en la atmósfera, estos valores incluyen el forzamiento climático del dióxido de carbono producido a partir del metano en estas escalas de tiempo.
Las emisiones anuales globales de metano son actualmente de aproximadamente 580 Mt, [59] de las cuales el 40% proviene de fuentes naturales y el 60% restante se origina de la actividad humana, conocidas como emisiones antropogénicas. La mayor fuente antropogénica es la agricultura , responsable de alrededor de una cuarta parte de las emisiones, seguida de cerca por el sector energético , que incluye las emisiones del carbón, el petróleo, el gas natural y los biocombustibles. [60]
Las concentraciones históricas de metano en la atmósfera mundial han oscilado entre 300 y 400 nmol/mol durante los períodos glaciares, comúnmente conocidos como eras de hielo , y entre 600 y 700 nmol/mol durante los períodos cálidos interglaciares . Un sitio web de la NASA de 2012 afirmó que los océanos eran una fuente potencial importante de metano del Ártico, [61] pero estudios más recientes asocian el aumento de los niveles de metano con la actividad humana. [10]
El monitoreo global de las concentraciones atmosféricas de metano comenzó en la década de 1980. [10] La concentración atmosférica de metano de la Tierra ha aumentado un 160% desde los niveles preindustriales de mediados del siglo XVIII. [10] En 2013, el metano atmosférico representó el 20% del forzamiento radiativo total de todos los gases de efecto invernadero de larga duración y mezclados a nivel global. [62] Entre 2011 y 2019, el aumento promedio anual de metano en la atmósfera fue de 1866 ppb. [11] De 2015 a 2019 se registraron fuertes aumentos en los niveles de metano atmosférico. [63] [64]
En 2019, la concentración atmosférica de metano fue mayor que en cualquier otro momento de los últimos 800.000 años. Como se afirma en el AR6 del IPCC , "desde 1750, los aumentos en las concentraciones de CO2 (47%) y CH4 (156%) superan con creces, y los aumentos en N2O ( 23 % ) son similares, a los cambios naturales multimilenarios entre períodos glaciales e interglaciales durante al menos los últimos 800.000 años (nivel de confianza muy alto)". [ 11] [a] [65]
En febrero de 2020, se informó que las emisiones fugitivas y el venteo de gases de la industria de los combustibles fósiles pueden haber sido subestimadas significativamente. [66] [67] El mayor aumento anual ocurrió en 2021 y el porcentaje abrumador fue causado por la actividad humana. [10]
El cambio climático puede aumentar los niveles atmosféricos de metano al incrementar la producción de metano en los ecosistemas naturales, lo que genera una retroalimentación del cambio climático . [42] [68] Otra explicación para el aumento de las emisiones de metano podría ser una desaceleración de la reacción química que elimina el metano de la atmósfera. [69]
Más de 100 países han firmado el Compromiso Global sobre el Metano, lanzado en 2021, en el que prometen reducir sus emisiones de metano en un 30% para 2030. [70] Esto podría evitar un calentamiento global de 0,2 ˚C para 2050, aunque se han hecho llamamientos para que se asuman mayores compromisos para alcanzar este objetivo. [71] El informe de 2022 de la Agencia Internacional de la Energía afirma que "las oportunidades más rentables para la reducción del metano se encuentran en el sector energético, especialmente en las operaciones de petróleo y gas". [72]
Los clatratos de metano (también conocidos como hidratos de metano) son jaulas sólidas de moléculas de agua que atrapan moléculas individuales de metano. Se han encontrado importantes reservorios de clatratos de metano en el permafrost ártico y a lo largo de los márgenes continentales debajo del fondo del océano dentro de la zona de estabilidad del clatrato de gas , ubicada a altas presiones (1 a 100 MPa; el extremo inferior requiere una temperatura más baja) y bajas temperaturas (< 15 °C; el extremo superior requiere una presión más alta). [73] Los clatratos de metano pueden formarse a partir de metano biogénico, metano termogénico o una mezcla de los dos. Estos depósitos son tanto una fuente potencial de combustible de metano como un posible contribuyente al calentamiento global. [74] [75] La masa global de carbono almacenado en clatratos de gas aún es incierta y se ha estimado tan alta como 12,500 Gt de carbono y tan baja como 500 Gt de carbono. [48] La estimación ha disminuido con el tiempo con una estimación más reciente de ≈1800 Gt de carbono. [76] Una gran parte de esta incertidumbre se debe a nuestra brecha de conocimiento en las fuentes y sumideros de metano y la distribución de clatratos de metano a escala global. Por ejemplo, una fuente de metano fue descubierta relativamente recientemente en una dorsal de expansión ultralenta en el Ártico. [47] Algunos modelos climáticos sugieren que el régimen actual de emisión de metano desde el fondo del océano es potencialmente similar al del período del Máximo Térmico del Paleoceno-Eoceno ( PETM ) hace unos 55,5 millones de años, aunque no hay datos que indiquen que el metano de la disociación de clatratos alcance actualmente la atmósfera. [76] La liberación de metano del Ártico desde el permafrost y los clatratos de metano del fondo marino es una consecuencia potencial y una causa adicional del calentamiento global ; esto se conoce como la hipótesis del cañón de clatratos . [77] [78] [79] [80] Los datos de 2016 indican que el permafrost del Ártico se descongela más rápido de lo previsto. [81]

El metano “degrada la calidad del aire y afecta negativamente la salud humana, el rendimiento agrícola y la productividad de los ecosistemas”. [82]
El metano es extremadamente inflamable y puede formar mezclas explosivas con el aire. Las explosiones de gas metano son responsables de muchos desastres mineros mortales. [83] Una explosión de gas metano fue la causa del desastre de la mina de carbón Upper Big Branch en Virginia Occidental el 5 de abril de 2010, matando a 29 personas. [84] La liberación accidental de gas natural también ha sido un foco importante en el campo de la ingeniería de seguridad , debido a liberaciones accidentales pasadas que concluyeron en la formación de desastres de fuego de chorro . [85] [86]
La fuga de gas metano de 2015-2016 en Aliso Canyon, California, fue considerada la peor en términos de su efecto ambiental en la historia de Estados Unidos. [87] [88] [89] También fue descrita como más dañina para el medio ambiente que la fuga de Deepwater Horizon en el Golfo de México. [90]
En mayo de 2023, The Guardian publicó un informe en el que acusaba a Turkmenistán de ser el peor país del mundo en cuanto a emisiones de metano . Los datos recopilados por los investigadores de Kayrros indican que dos grandes yacimientos de combustibles fósiles de Turkmenistán filtraron 2,6 millones y 1,8 millones de toneladas métricas de metano solo en 2022, lo que provocó que se expulsaran a la atmósfera el equivalente a 366 millones de toneladas de CO2, superando así las emisiones anuales de CO2 del Reino Unido . [91]
El metano también es asfixiante si la concentración de oxígeno se reduce por debajo del 16 % aproximadamente por desplazamiento, ya que la mayoría de las personas pueden tolerar una reducción del 21 % al 16 % sin efectos nocivos . La concentración de metano a la que el riesgo de asfixia se vuelve significativo es mucho mayor que la concentración del 5 al 15 % en una mezcla inflamable o explosiva. Los gases de escape de metano pueden penetrar en el interior de los edificios cercanos a los vertederos y exponer a los ocupantes a niveles significativos de metano. Algunos edificios tienen sistemas de recuperación especialmente diseñados debajo de sus sótanos para capturar activamente este gas y ventilarlo fuera del edificio.
El metano es abundante en muchas partes del Sistema Solar y potencialmente podría ser recolectado en la superficie de otro cuerpo del Sistema Solar (en particular, utilizando la producción de metano a partir de materiales locales encontrados en Marte [92] o Titán ), proporcionando combustible para un viaje de regreso. [28] [93]
Se ha detectado metano en todos los planetas del Sistema Solar y en la mayoría de las lunas más grandes. [ cita requerida ] Con la posible excepción de Marte , se cree que proviene de procesos abióticos . [94] [95]

El rover Curiosity ha documentado fluctuaciones estacionales de los niveles de metano atmosférico en Marte. Estas fluctuaciones alcanzaron su punto máximo al final del verano marciano, con 0,6 partes por mil millones. [96] [97] [98] [99] [100] [101] [102] [103]
Se ha propuesto el metano como posible propulsor de cohetes en futuras misiones a Marte debido en parte a la posibilidad de sintetizarlo en el planeta mediante la utilización de recursos in situ . [104] Se puede utilizar una adaptación de la reacción de metanización de Sabatier con un lecho catalizador mixto y un cambio inverso de agua-gas en un solo reactor para producir metano y oxígeno a partir de las materias primas disponibles en Marte, utilizando agua del subsuelo marciano y dióxido de carbono en la atmósfera marciana . [92]
El metano podría producirse mediante un proceso no biológico llamado serpentinización [b] que involucra agua, dióxido de carbono y el mineral olivino , que se sabe que es común en Marte. [105]

Se ha detectado metano en gran abundancia en Titán , la luna más grande de Saturno ; constituye una parte importante de su atmósfera y también existe en forma líquida en su superficie, donde constituye la mayor parte del líquido en los vastos lagos de hidrocarburos de Titán; se cree que el segundo más grande de ellos es metano casi puro en composición. [106]
La presencia de lagos estables de metano líquido en Titán, así como el hecho de que la superficie de Titán es altamente activa químicamente y rica en compuestos orgánicos, ha llevado a los científicos a considerar la posibilidad de que exista vida dentro de los lagos de Titán, utilizando metano como solvente en lugar de agua para la vida en la Tierra [107] y utilizando hidrógeno en la atmósfera para derivar energía con acetileno , de la misma manera que la vida en la Tierra utiliza glucosa . [108]
-Portrait-Portr_02303.tif/lossy-page1-440px-ETH-BIB-Volta,_Alessandro_(1745-1827)-Portrait-Portr_02303.tif.jpg)
El descubrimiento del metano se atribuye al físico italiano Alessandro Volta , quien caracterizó numerosas propiedades, incluido su límite de inflamabilidad y su origen a partir de materia orgánica en descomposición. [109]
Volta se sintió motivado inicialmente por los informes de su amigo, el padre Carlo Guiseppe Campi, sobre la presencia de aire inflamable en los pantanos. Durante un viaje de pesca al lago Maggiore , a caballo entre Italia y Suiza , en noviembre de 1776, notó la presencia de burbujas en los pantanos cercanos y decidió investigar. Volta recogió el gas que salía del pantano y demostró que era inflamable. [109] [110]
Volta señala que observaciones similares de aire inflamable existían previamente en la literatura científica, incluida una carta escrita por Benjamin Franklin . [111]
Tras el desastre de la mina Felling de 1812, en el que perecieron 92 hombres, Sir Humphry Davy estableció que el temido grisú era en realidad, en gran parte, metano. [112]
El nombre "metano" fue acuñado en 1866 por el químico alemán August Wilhelm von Hofmann . [113] [114] El nombre se derivó de metanol .
Etimológicamente, la palabra metano se acuña a partir del sufijo químico " -ane ", que denota sustancias pertenecientes a la familia de los alcanos; y la palabra metilo , que se deriva del alemán Methyl (1840) o directamente del francés méthyle , que es una formación inversa del francés méthylène (que corresponde al inglés "metileno"), cuya raíz fue acuñada por Jean-Baptiste Dumas y Eugène Péligot en 1834 a partir del griego μέθυ methy (vino) (relacionado con el inglés "mead") y ὕλη hyle (que significa "madera"). El radical recibe este nombre porque se detectó por primera vez en el metanol , un alcohol aislado por primera vez por destilación de madera. El sufijo químico -ane proviene del sufijo químico coordinante -ine que a su vez proviene del sufijo femenino latino -ina que se aplica para representar abstractos. La coordinación de "-ano", "-eno", "-ona", etc. fue propuesta en 1866 por el químico alemán August Wilhelm von Hofmann . [115]
La abreviatura CH 4 -C puede significar la masa de carbono contenida en una masa de metano, y la masa de metano es siempre 1,33 veces la masa de CH 4 -C. [116] [117] CH 4 -C también puede significar la relación metano-carbono, que es 1,33 en masa. [118] El metano a escalas de la atmósfera se mide comúnmente en teragramos (Tg CH 4 ) o millones de toneladas métricas (MMT CH 4 ), que significan lo mismo. [119] También se utilizan otras unidades estándar, como nanomol (nmol, una milmillonésima parte de un mol), mol (mol), kilogramo y gramo .
Metano es un nombre conservado (ver P-12.3) que se prefiere al nombre sistemático 'carbano', un nombre nunca recomendado para reemplazar al metano, pero utilizado para derivar los nombres 'carbeno' y 'carbino' para los radicales H 2 C 2• y HC 3• , respectivamente.
El gas natural comprimido se promociona como el combustible alternativo de "combustión más limpia" disponible, ya que la simplicidad de la molécula de metano reduce las emisiones de los tubos de escape de diferentes contaminantes entre un 35 y un 97%. No tan dramática es la reducción de las emisiones netas de gases de efecto invernadero, que es aproximadamente la misma que la del etanol de grano de maíz, con una reducción de aproximadamente el 20% con respecto a la gasolina.
A diferencia del queroseno, el GNL se puede utilizar para autopresurizar su tanque. Esto, conocido como represurización autógena, elimina la necesidad de sistemas costosos y complejos que aprovechan las escasas reservas de helio de la Tierra. El GNL también posee características de combustión limpia incluso a bajo acelerador, lo que simplifica la reutilización del motor en comparación con los combustibles de queroseno.