La escualeno sintasa ( SQS ) o farnesil-difosfato:farnesil-difosfato farnesil transferasa es una enzima localizada en la membrana del retículo endoplasmático . La SQS participa en la vía biosintética de isoprenoides , catalizando una reacción de dos pasos en la que dos moléculas idénticas de farnesil pirofosfato (FPP) se convierten en escualeno , con el consumo de NADPH . [2] La catálisis por SQS es el primer paso comprometido en la síntesis de esteroles , ya que el escualeno producido se convierte exclusivamente en varios esteroles, como el colesterol , a través de una vía compleja de múltiples pasos. La SQS pertenece a la familia de proteínas escualeno/fitoeno sintasa .
La escualeno sintasa se ha caracterizado en animales, plantas y levaduras. [3] En términos de estructura y mecánica, la escualeno sintasa se parece mucho a la fitoeno sintasa (PHS), otra preniltransferasa . La PHS cumple una función similar a la SQS en plantas y bacterias, catalizando la síntesis de fitoeno , un precursor de los compuestos carotenoides . [4]
La escualeno sintasa (SQS) se localiza exclusivamente en la membrana del retículo endoplasmático (RE). [5] La SQS está anclada a la membrana por un dominio corto que abarca la membrana en el extremo C. [6] El dominio catalítico del extremo N de la enzima sobresale hacia el citosol , donde se unen los sustratos solubles . [2] Las formas mamíferas de la SQS tienen aproximadamente 47 kDa y constan de ~416 aminoácidos . La estructura cristalina de la SQS humana se determinó en 2000 y reveló que la proteína estaba compuesta completamente de hélices α . La enzima está plegada en un solo dominio , caracterizado por un gran canal central. Los sitios activos de ambas semirreacciones catalizadas por la SQS se encuentran dentro de este canal. Un extremo del canal está abierto al citosol, mientras que el otro extremo forma un bolsillo hidrofóbico . [5] SQS contiene dos secuencias conservadas ricas en aspartato , que se cree que participan directamente en el mecanismo catalítico. [7] Estos motivos ricos en aspartato son una de varias características estructurales conservadas en las enzimas biosintéticas de isoprenoides de clase I, aunque estas enzimas no comparten homología de secuencia . [5]

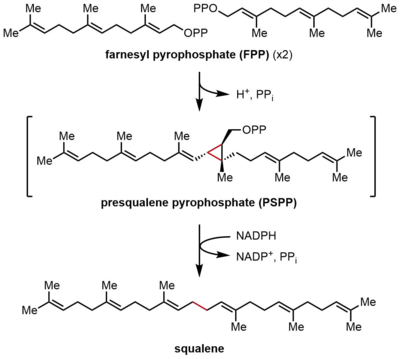
La escualeno sintasa (SQS) cataliza la dimerización reductora del pirofosfato de farnesilo (FPP), en la que dos moléculas idénticas de FPP se convierten en una molécula de escualeno. La reacción se produce en dos pasos, y procede a través del intermediario pirofosfato de prescualeno (PSPP). El FPP es un compuesto alílico soluble que contiene 15 átomos de carbono (C 15 ), mientras que el escualeno es un isoprenoide insoluble, C 30. [2] [4] Esta reacción es una síntesis de terpenos de cabeza a cabeza , porque las dos moléculas de FPP están unidas en la posición C4 y forman un enlace 1-1'. Esto contrasta con los enlaces 1'-4 que son mucho más comunes en la biosíntesis de isopreno que los enlaces 4-4'. [8] [9] El mecanismo de reacción de SQS requiere un catión divalente , a menudo Mg 2+ , para facilitar la unión de los grupos pirofosfato en FPP. [10]
En la primera semirreacción, dos moléculas idénticas de pirofosfato de farnesilo (FPP) se unen a la escualeno sintasa (SQS) de manera secuencial. Las moléculas de FPP se unen a regiones distintas de la enzima y con diferentes afinidades de unión. [11] Comenzando en la parte superior del ciclo catalítico a continuación, la reacción comienza con la ionización de FPP para generar un carbocatión alílico . Un residuo de tirosina (Tyr-171) juega un papel fundamental en este paso al servir como donante de protones para facilitar la abstracción de pirofosfato. Además, el anión fenolato resultante puede estabilizar el carbocatión resultante a través de interacciones catión-π , que serían particularmente fuertes debido a la naturaleza altamente rica en electrones del anión fenolato. El catión alílico generado es luego atacado por la olefina de una segunda molécula de FPP, lo que proporciona un carbocatión terciario. El anión fenolato generado previamente sirve entonces como base para abstraer un protón de este aducto para formar un producto de ciclopropano, pirofosfato de prescualeno (PSPP). El PSPP creado permanece asociado con SQS para la segunda reacción. [5] [10] La importancia de un residuo de tirosina en este proceso fue demostrada por estudios de mutagénesis con SQS de rata (rSQS), [7] y por el hecho de que Tyr-171 se conserva en todos los SQS conocidos (y PHS ). [2] En rSQS, Tyr-171 se convirtió en los residuos aromáticos Phe y Trp , así como en el residuo que contiene hidroxilo Ser . Ninguno de estos mutantes fue capaz de convertir FPP en PSPP o escualeno, lo que demuestra que los anillos aromáticos o los alcoholes por sí solos son insuficientes para convertir FPP en PSPP.
En la segunda semirreacción de SQS, el pirofosfato de prescualeno (PSPP) se mueve a un segundo sitio de reacción dentro de SQS. Se cree que mantener el PSPP en el canal central de SQS protege al intermediario reactivo de reaccionar con agua. [5] A partir del PSPP, el escualeno se forma mediante una serie de reordenamientos de carbocationes. [12] [13] El proceso comienza con la ionización del pirofosfato, dando un catión ciclopropilcarbinilo. El catión se reordena mediante una migración 1,2 de un enlace C–C de ciclopropano al carbocatión, formando el enlace que se muestra en azul para dar un carbocatión ciclobutilo. Posteriormente, ocurre una segunda migración 1,2 para formar otro catión ciclopropilcarbinilo, con el catión descansando sobre un carbono terciario. Este carbocatión resultante luego abre su anillo mediante un hidruro liberado por NADPH , lo que da lugar al escualeno, que luego es liberado por SQS en la membrana del retículo endoplásmico . [2]
Si bien los reordenamientos ciclopropilcarbinil-ciclopropilcarbinil pueden realizarse a través de intermediarios discretos de catión ciclobutilo, el supuesto catión ciclobutilo no pudo ser atrapado en los estudios modelo. Por lo tanto, el catión ciclobutilo puede ser en realidad un estado de transición entre los dos cationes ciclopropilcarbinilo, en lugar de un intermediario discreto. La estereoquímica de los intermediarios y la geometría de la olefina en el producto final está determinada por la naturaleza suprafacial de los desplazamientos 1,2 y los requisitos estereoelectrónicos . Si bien se han propuesto otros mecanismos, el mecanismo que se muestra arriba está respaldado por el aislamiento de rillingol, que es el alcohol formado al atrapar el segundo catión ciclopropilcarbinilo con agua.

El FPP es un intermediario metabólico importante en la vía del mevalonato que representa un punto de ramificación principal en las vías de los terpenoides . [2] [14] El FPP se utiliza para formar varias clases importantes de compuestos además de esteroles ( a través del escualeno), incluyendo ubiquinona [15] y dolicoles . [16] SQS cataliza el primer paso comprometido en la biosíntesis de esteroles a partir de FPP y, por lo tanto, es importante para controlar el flujo hacia productos de esteroles frente a productos no esteroles. La actividad de SQS está íntimamente relacionada con la actividad de la HMG-CoA reductasa , que cataliza el paso limitante de la velocidad de la vía del mevalonato. Los altos niveles de colesterol derivado de LDL inhiben significativamente la actividad de la HMG-CoA reductasa, ya que el mevalonato ya no es necesario para la producción de esteroles. Sin embargo, se observa actividad residual de la HMG-CoA reductasa incluso con niveles muy altos de LDL, de modo que el FPP se puede fabricar para formar productos no esteroles esenciales para el crecimiento celular. [17] Para evitar que este FPP residual se utilice para la síntesis de esteroles cuando los esteroles son abundantes, la actividad de SQS disminuye significativamente cuando los niveles de LDL son altos. [18] Esta supresión de la actividad de SQS se considera mejor como un mecanismo de control de flujo, en lugar de una forma de regular los niveles de colesterol. Esto se debe a que la HMG-CoA reductasa es el factor de control más importante para regular la síntesis de colesterol (su actividad se inhibe en un 98% cuando los niveles de LDL son altos). [17]
La regulación de SQS ocurre principalmente a nivel de la transcripción del gen SQS . [2] La clase de factores de transcripción de la proteína de unión al elemento regulador de esteroles (SREBP) es central para regular los genes involucrados en la homeostasis del colesterol y es importante para controlar los niveles de transcripción de SQS. Cuando los niveles de esteroles son bajos, una forma inactiva de SREBP se escinde para formar el factor de transcripción activo, que se mueve al núcleo para inducir la transcripción del gen SQS. De los tres factores de transcripción SREBP conocidos, solo SREBP-1a y SREBP-2 activan la transcripción del gen SQS en hígados de ratones transgénicos. [19] [20] En células HepG2 cultivadas , SREBP-1a parece más importante que SREBP-2 en el control de la activación del promotor SQS . [21] Sin embargo, se ha demostrado que los promotores SQS responden de manera diferente a SREBP-1a y SREBP-2 en diferentes sistemas experimentales.
Además de los SREBP, se necesitan factores de transcripción accesorios para la activación máxima del promotor SQS. Los estudios del promotor que utilizan ensayos del gen reportero de la luciferasa revelaron que los factores de transcripción Sp1 y NF-Y y/o CREB también son importantes para la activación del promotor SQS. NF-Y y/o CREB son necesarios para que SREBP-1a active completamente el promotor SQS, aunque Sp1 también es necesario para que SREBP-2 lo haga.
Haga clic en los genes, proteínas y metabolitos que aparecen a continuación para acceder a los artículos correspondientes. [§ 1]
La escualeno sintasa (SQS) es una enzima que participa en la vía biosintética de los isoprenoides. La SQS sintasa cataliza el punto de ramificación entre la biosíntesis de esteroles y no esteroles, y destina el pirofosfato de farnesilo (FPP) exclusivamente a la producción de esteroles. [2] Un esterol importante producido por esta vía es el colesterol , que se utiliza en las membranas celulares y para la síntesis de hormonas . [22] La SQS compite con varias otras enzimas por el uso de FPP, ya que es un precursor de una variedad de terpenoides. Las disminuciones en la actividad de la SQS limitan el flujo de FPP a la vía de los esteroles y aumentan la producción de productos no esteroles. Los productos no esteroles importantes incluyen ubiquinona , dolicoles , hemo A y proteínas farnesiladas [23]
El desarrollo de ratones knock out para la escualeno sintasa ha demostrado que la pérdida de la escualeno sintasa es letal y que la enzima es esencial para el desarrollo del sistema nervioso central . [24]
La escualeno sintasa es un objetivo para la regulación de los niveles de colesterol. Se ha demostrado que el aumento de la expresión de SQS eleva los niveles de colesterol en ratones. [24] Por lo tanto, los inhibidores de SQS son de gran interés en el tratamiento de la hipercolesterolemia y la prevención de la enfermedad cardíaca coronaria (ECC) . [25] También se ha sugerido que las variantes de esta enzima pueden ser parte de una asociación genética con la hipercolesterolemia. [26]
Se ha demostrado que los inhibidores de la escualeno sintasa disminuyen la síntesis de colesterol, así como los niveles plasmáticos de triglicéridos . [22] [27] Los inhibidores de la SQS pueden proporcionar una alternativa a los inhibidores de la HMG-CoA reductasa (estatinas), que tienen efectos secundarios problemáticos para algunos pacientes. [28] Los inhibidores de la escualeno sintasa que se han investigado para su uso en la prevención de enfermedades cardiovasculares incluyen lapaquistat (TAK-475), ácido zaragozico y RPR 107393. [29] [30] A pesar de alcanzar la fase II de ensayos clínicos , el lapaquistat se suspendió en 2008. [31] [32]
Actualmente se está investigando la inhibición del homólogo de la escualeno sintasa en Staphylococcus aureus como terapia antibacteriana basada en factores de virulencia . [33]