Los ácidos siálicos son una clase de azúcares alfa-cetoácidos con una cadena principal de nueve carbonos . [1] El término "ácido siálico" (del griego σίαλον (síalon) ' saliva ') fue introducido por primera vez por el bioquímico sueco Gunnar Blix en 1952. El miembro más común de este grupo es el ácido N -acetilneuramínico (Neu5Ac o NANA) que se encuentra en animales y algunos procariotas .
Los ácidos siálicos se encuentran ampliamente distribuidos en los tejidos animales y formas relacionadas se encuentran en menor medida en otros organismos como en algunas microalgas , [2] bacterias y arqueas . [3] [4] [5] [6] Los ácidos siálicos son comúnmente parte de las glicoproteínas , glicolípidos o gangliósidos , donde decoran el final de las cadenas de azúcar en la superficie de las células o proteínas solubles. [7] Sin embargo, también se han observado ácidos siálicos en embriones de Drosophila y otros insectos. [8] Generalmente, las plantas parecen no contener ni mostrar ácidos siálicos. [9]
En los seres humanos, el cerebro tiene el mayor contenido de ácido siálico, donde estos ácidos juegan un papel importante en la transmisión neuronal y la estructura de los gangliósidos en la sinaptogénesis . [7] Se conocen más de 50 tipos de ácido siálico, todos los cuales pueden obtenerse a partir de una molécula de ácido neuramínico sustituyendo su grupo amino o uno de sus grupos hidroxilo. [1] En general, el grupo amino lleva un grupo acetilo o glicolilo, pero se han descrito otras modificaciones. Estas modificaciones junto con los enlaces han demostrado ser expresiones específicas de tejido y reguladas por el desarrollo , por lo que algunas de ellas solo se encuentran en ciertos tipos de glicoconjugados en células específicas. [8] Los sustituyentes hidroxilo pueden variar considerablemente; se han encontrado grupos acetilo , lactilo, metilo , sulfato y fosfato . [10]
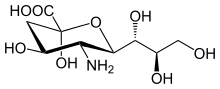
La familia del ácido siálico incluye muchos derivados del ácido neuramínico , un azúcar de nueve carbonos , pero estos ácidos rara vez aparecen libres en la naturaleza. Normalmente se pueden encontrar como componentes de cadenas de oligosacáridos de mucinas, glicoproteínas y glicolípidos que ocupan posiciones terminales, no reductoras, de carbohidratos complejos tanto en áreas de membrana externa como interna donde están muy expuestos y desarrollan funciones importantes. [7]
La numeración de los átomos de carbono comienza en el carbono carboxilato y continúa a lo largo de la cadena. La configuración que coloca al carboxilato en posición axial es el anómero alfa.
El anómero alfa es la forma que se encuentra cuando el ácido siálico se une a los glicanos. Sin embargo, en solución, se encuentra principalmente (más del 90%) en la forma beta-anomérica. Se ha descubierto una enzima bacteriana con actividad mutarotasa del ácido siálico , NanM, que es capaz de equilibrar rápidamente las soluciones de ácido siálico hasta la posición de equilibrio en reposo de alrededor del 90% beta/10% alfa. [11]
A diferencia de otros animales, los humanos son genéticamente incapaces de producir la variante del ácido siálico, el ácido N-glicolilneuramínico (Neu5Gc). Sin embargo, pequeñas cantidades de Neu5Gc detectadas en el tejido humano pueden ser incorporadas a partir de fuentes exógenas (nutrientes). [12]
El ácido siálico es sintetizado por la glucosamina 6 fosfato y el acetil-CoA a través de una transferasa , dando como resultado N -acetilglucosamina-6-P. Esta se convierte en N -acetilmanosamina-6-P a través de la epimerización , que reacciona con el fosfoenolpiruvato produciendo N -acetilneuramínico-9-P (ácido siálico). Para que se active para entrar en el proceso de biosíntesis de oligosacáridos de la célula, se le añade un nucleósido monofosfato, que proviene de un trifosfato de citidina , convirtiendo el ácido siálico en citidina monofosfato-ácido siálico (CMP-ácido siálico). Este compuesto se sintetiza en el núcleo de la célula animal. [13] [14]
En los sistemas bacterianos, los ácidos siálicos también pueden ser biosintetizados por una aldolasa . Esta enzima utiliza, por ejemplo, un derivado de manosa como sustrato, insertando tres carbonos del piruvato en la estructura del ácido siálico resultante. Estas enzimas pueden utilizarse para la síntesis quimioenzimática de derivados del ácido siálico. [15]
Las glucoproteínas que contienen ácido siálico ( sialoglicoproteínas ) se unen a la selectina en los seres humanos y otros organismos. Las células cancerosas metastásicas a menudo expresan una alta densidad de glucoproteínas ricas en ácido siálico. Esta sobreexpresión de ácido siálico en las superficies crea una carga negativa en las membranas celulares. Esto crea repulsión entre las células (oposición celular) [16] y ayuda a que estas células cancerosas en etapa avanzada ingresen al torrente sanguíneo. Experimentos recientes han demostrado la presencia de ácido siálico en la matriz extracelular secretada por el cáncer . [17]
Los oligosacáridos ricos en ácido siálico presentes en los glicoconjugados (glicolípidos, glicoproteínas, proteoglicanos) que se encuentran en las membranas superficiales ayudan a mantener el agua en la superficie de las células [ cita requerida ] . Las regiones ricas en ácido siálico contribuyen a crear una carga negativa en las superficies de las células. Dado que el agua es una molécula polar con cargas positivas parciales en ambos átomos de hidrógeno, es atraída por las superficies y membranas celulares. Esto también contribuye a la captación de fluidos celulares.
Los residuos de ácido siálico están presentes en las glicoproteínas de mucina del moco. [18]
El ácido siálico puede "ocultar" los antígenos de manosa en la superficie de las células huésped o bacterias de la lectina que se une a la manosa. [ cita requerida ] Esto evita la activación del complemento .
El ácido siálico en forma de ácido polisiálico es una modificación postraduccional inusual que se produce en las moléculas de adhesión celular neuronal (NCAM). En la sinapsis , la fuerte carga negativa del ácido polisiálico impide la reticulación de las NCAM en las células.
La administración de estrógenos a ratones castrados produce una reducción dosis-dependiente del contenido de ácido siálico en la vagina. Por el contrario, el contenido de ácido siálico en la vagina de los ratones es una medida de la potencia del estrógeno. Las sustancias de referencia son el estradiol para la aplicación subcutánea y el etinilestradiol para la administración oral. [19]
Los ácidos siálicos se encuentran en todas las superficies celulares de los vertebrados y algunos invertebrados, y también en ciertas bacterias que interactúan con los vertebrados.
Muchos virus, como el serotipo Ad26 [20] de adenovirus ( Adenoviridae ), rotavirus ( Reoviridae ) y virus de la influenza ( Orthomyxoviridae ), pueden utilizar estructuras sialiladas del huésped para unirse a su célula huésped objetivo. Los ácidos siálicos proporcionan un buen objetivo para estos virus, ya que están altamente conservados y son abundantes en grandes cantidades en prácticamente todas las células. Como era de esperar, los ácidos siálicos también juegan un papel importante en varias infecciones virales humanas. Los virus de la influenza tienen glicoproteínas de actividad de hemaglutinina (HA) en sus superficies que se unen a los ácidos siálicos que se encuentran en la superficie de los eritrocitos humanos y en las membranas celulares del tracto respiratorio superior. Esta es la base de la hemaglutinación cuando los virus se mezclan con células sanguíneas y la entrada del virus en las células del tracto respiratorio superior. Los medicamentos antigripales ampliamente utilizados ( oseltamivir y zanamivir ) son análogos del ácido siálico que interfieren en la liberación de virus recién generados de las células infectadas al inhibir la enzima viral neuraminidasa . [21]
Algunas bacterias también utilizan estructuras sialiladas del huésped para la unión y el reconocimiento. Por ejemplo, la evidencia indica que los ácidos siálicos libres pueden comportarse como una señal para algunas bacterias específicas, como Pneumococcus . El ácido siálico libre posiblemente puede ayudar a la bacteria a reconocer que ha llegado a un entorno de vertebrados adecuado para su colonización. Las modificaciones de Sias, como el grupo N -glicolilo en la posición 5 o los grupos O -acetilo en la cadena lateral, pueden reducir la acción de las sialidasas bacterianas. [21]
La síntesis y degradación del ácido siálico se distribuyen en diferentes compartimentos de la célula. La síntesis comienza en el citosol, donde la N -acetilmanosamina 6 fosfato y el fosfoenolpiruvato dan lugar al ácido siálico. Posteriormente, el fosfato Neu5Ac 9 es activado en el núcleo por un residuo de monofosfato de citidina (CMP) a través de la CMP-Neu5Ac sintasa. Aunque el enlace entre el ácido siálico y otros compuestos tiende a ser un enlace α, este en concreto es el único que es un enlace β. El CMP-Neu5Ac es luego transportado al retículo endoplasmático o al aparato de Golgi, donde puede ser transferido a una cadena de oligosacáridos, convirtiéndose en un nuevo glicoconjugado. Este enlace puede ser modificado por O- acetilación u O- metilación . Cuando el glicoconjugado está maduro es transportado a la superficie celular.
La sialidasa es una de las enzimas más importantes del catabolismo del ácido siálico. Puede provocar la eliminación de residuos de ácido siálico de la superficie celular o de sialoglicoconjugados séricos. Por lo general, en los animales superiores, los glicoconjugados que son propensos a degradarse son capturados por endocitosis. Después de la fusión del endosoma tardío con el lisosoma, las sialidasas lisosomales eliminan los residuos de ácido siálico. La actividad de estas sialidasas se basa en la eliminación de grupos O -acetilo. Las moléculas de ácido siálico libres son transportadas al citosol a través de la membrana del lisosoma. Allí, pueden reciclarse y activarse nuevamente para formar otra molécula de glicoconjugado naciente en el aparato de Golgi. Los ácidos siálicos también pueden degradarse a acilmanosamina y piruvato con la enzima citosólica acilneuraminato liasa.
Algunas enfermedades graves pueden depender de la presencia o ausencia de algunas enzimas relacionadas con el metabolismo del ácido siálico. La sialidosis y la deficiencia de ácido siálico con mutaciones en el gen NANS (ver más abajo) serían ejemplos de este tipo de trastorno. [22]
Las crías de rata suplementadas con ácido siálico mostraron un mejor aprendizaje y memoria cuando eran adultas. [23] Se observó una relación entre la suplementación dietética con ácido siálico y la función cognitiva en lechones que habían sido alimentados con altas dosis de ácido siálico. [24]

Los ácidos siálicos están relacionados con varias enfermedades diferentes observadas en los seres humanos.
Las mutaciones recesivas bialélicas en el gen de síntesis de ácido siálico, la sintetasa del ácido N-acetil-neuramínico ( NANS ), en humanos pueden provocar una enfermedad grave que se caracteriza por discapacidad intelectual y baja estatura, lo que resalta la importancia del ácido siálico en el desarrollo cerebral. [25] Un ensayo terapéutico con una suplementación a corto plazo de ácido siálico administrada por vía oral no ha logrado demostrar un efecto beneficioso significativo sobre los parámetros bioquímicos [26]
La enfermedad de Salla es una enfermedad extremadamente rara que se considera la forma más leve de los trastornos de acumulación de ácido siálico libre [27] aunque su forma infantil se considera una variante agresiva y las personas que la padecen tienen retraso mental. [ 28] Es un trastorno autosómico recesivo causado por una mutación del cromosoma 6. [29] Afecta principalmente al sistema nervioso [27] y es causado por una irregularidad de almacenamiento lisosomal que proviene de un déficit de un transportador de ácido siálico específico ubicado en la membrana lisosomal [30] Actualmente, no existe cura para esta enfermedad y el tratamiento es de apoyo, centrándose en el control de los síntomas. [27]
Las subfracciones de colesterol LDL que están implicadas en la causa de la aterosclerosis tienen niveles reducidos de ácido siálico. [31] Estas incluyen partículas LDL pequeñas de alta densidad y LDL electronegativas. [31] Los niveles reducidos de ácido siálico en partículas LDL pequeñas de alta densidad aumentan la afinidad de esas partículas por los proteoglicanos en las paredes arteriales . [31]
Todas las cepas del virus de la influenza A necesitan ácido siálico para conectarse con las células. Existen diferentes formas de ácidos siálicos que tienen diferente afinidad con la variedad del virus de la influenza A. Esta diversidad es un hecho importante que determina qué especies pueden ser infectadas. [32] Cuando un determinado virus de la influenza A es reconocido por un receptor de ácido siálico, la célula tiende a endocitar el virus, por lo que la célula se infecta.
Los ácidos siálicos son muy abundantes en los tejidos de los vertebrados, donde participan en muchos procesos biológicos diferentes. Originalmente descubiertos dentro del linaje de animales Deuterostome, los ácidos siálicos pueden considerarse en realidad como un subconjunto de una familia más antigua de monosacáridos de cadena principal de 9 carbonos llamados ácidos nonulosónicos (NulOs), que más recientemente también se han encontrado en Eubacteria y Archaea. [33] Muchas bacterias patógenas incorporan ácido siálico en las características de la superficie celular como su lipopolisacárido o polisacáridos de la cápsula, lo que les ayuda a evadir la respuesta inmune innata del huésped. [34] Un estudio reciente a nivel del genoma examinó un gran conjunto de genomas microbianos secuenciados, que indicó que las vías biosintéticas para producir ácidos nonulosónicos (NulOs) están mucho más ampliamente distribuidas a lo largo del árbol filogenético de la vida de lo que se creía anteriormente. [35] Este hallazgo está además respaldado por estudios recientes de tinción de lectina y un estudio a nivel molecular sobre ácidos no ulúsónicos procariotas, que muestran que también muchas cepas no patógenas y puramente ambientales producen ácidos siálicos bacterianos (NulOs). [36] [37] Algunas bacterias ( anammox ) producen NulOs que además del grupo alfa-cetoácido muy ácido también muestran grupos básicos (neutralizantes) (aminas libres). [38] Se han producido ácidos siálicos de superficie celular comparables mediante remodelación química para manipular la carga de la superficie celular produciendo una amina libre en C5, que neutraliza el grupo carboxilo cargado negativamente en C1. [39]
{{cite book}}: CS1 maint: DOI inactivo a partir de septiembre de 2024 ( enlace ){{cite book}}: CS1 maint: DOI inactivo a partir de septiembre de 2024 ( enlace ) CS1 maint: ubicación ( enlace )