El curio es un elemento químico sintético ; su símbolo es Cm y su número atómico es 96. Este elemento actínido transuránico recibió su nombre en honor a los eminentes científicos Marie y Pierre Curie , ambos conocidos por sus investigaciones sobre la radiactividad . El curio fue creado intencionalmente por primera vez por el equipo de Glenn T. Seaborg , Ralph A. James y Albert Ghiorso en 1944, utilizando el ciclotrón de Berkeley . Bombardearon el elemento recién descubierto plutonio (el isótopo 239 Pu ) con partículas alfa . Luego, esto se envió al Laboratorio Metalúrgico de la Universidad de Chicago , donde finalmente se separó e identificó una pequeña muestra de curio. El descubrimiento se mantuvo en secreto hasta después del final de la Segunda Guerra Mundial . La noticia se hizo pública en noviembre de 1947. La mayor parte del curio se produce bombardeando uranio o plutonio con neutrones en reactores nucleares : una tonelada de combustible nuclear gastado contiene ~20 gramos de curio.
El curio es un metal duro, denso y plateado con un punto de fusión y ebullición elevado para un actínido. Es paramagnético en condiciones ambientales , pero se vuelve antiferromagnético al enfriarse, y también se observan otras transiciones magnéticas en muchos compuestos de curio. En los compuestos, el curio suele tener valencia +3 y, a veces, +4; la valencia +3 es predominante en las soluciones. El curio se oxida fácilmente y sus óxidos son una forma dominante de este elemento. Forma complejos fuertemente fluorescentes con varios compuestos orgánicos, pero no hay evidencia de su incorporación a bacterias y arqueas . Si entra en el cuerpo humano, el curio se acumula en los huesos, los pulmones y el hígado, donde promueve el cáncer .
Todos los isótopos conocidos del curio son radiactivos y tienen una masa crítica pequeña para una reacción nuclear en cadena . El isótopo más estable, 247 Cm, tiene una vida media de 15,6 millones de años; los isótopos de curio de vida más larga emiten predominantemente partículas alfa . Los generadores termoeléctricos de radioisótopos pueden utilizar el calor de este proceso, pero esto se ve obstaculizado por la rareza y el alto costo del curio. El curio se utiliza para fabricar actínidos más pesados y el radionúclido 238 Pu para fuentes de energía en marcapasos cardíacos artificiales y RTG para naves espaciales. Sirvió como fuente α en los espectrómetros de rayos X de partículas alfa de varias sondas espaciales, incluidos los exploradores marcianos Sojourner , Spirit , Opportunity y Curiosity y el módulo de aterrizaje Philae en el cometa 67P/Churyumov–Gerasimenko , para analizar la composición y estructura de la superficie. Los investigadores han propuesto usar curio como combustible en reactores nucleares. [5]


Aunque es probable que el curio se hubiera producido en experimentos nucleares anteriores, así como en el reactor de fisión nuclear natural de Oklo, Gabón, fue sintetizado , aislado e identificado intencionalmente por primera vez en 1944, en la Universidad de California, Berkeley , por Glenn T. Seaborg , Ralph A. James y Albert Ghiorso . [6] En sus experimentos, utilizaron un ciclotrón de 60 pulgadas (150 cm) . [7]
El curio fue identificado químicamente en el Laboratorio Metalúrgico (ahora Laboratorio Nacional Argonne ) de la Universidad de Chicago . Fue el tercer elemento transuránico en ser descubierto, aunque es el cuarto de la serie (el elemento más ligero, el americio, aún era desconocido). [8] [9]
La muestra se preparó de la siguiente manera: primero se aplicó una solución de nitrato de plutonio sobre una lámina de platino de ~0,5 cm2 de área, se evaporó la solución y el residuo se convirtió en óxido de plutonio(IV) (PuO2 ) mediante recocido . Después de la irradiación del óxido con ciclotrón, el recubrimiento se disolvió con ácido nítrico y luego se precipitó como hidróxido utilizando una solución acuosa concentrada de amoníaco . El residuo se disolvió en ácido perclórico y se realizó una separación adicional mediante intercambio iónico para producir un cierto isótopo de curio. La separación del curio y el americio fue tan minuciosa que el grupo de Berkeley inicialmente llamó a esos elementos pandemonium (del griego para todos los demonios o infierno ) y delirium (del latín para locura ). [10] [11]
El curio-242 se fabricó en julio-agosto de 1944 bombardeando 239 Pu con partículas α para producir curio con la liberación de un neutrón :
El curio-242 se identificó de forma inequívoca por la energía característica de las partículas α emitidas durante la desintegración:
La vida media de esta desintegración alfa se midió primero en 150 días y luego se corrigió a 162,8 días. [12]
En una reacción similar en marzo de 1945 se produjo otro isótopo, 240 Cm:
La vida media de desintegración α de 240 Cm se determinó correctamente como 26,7 días. [12]
El descubrimiento del curio y el americio en 1944 estuvo estrechamente relacionado con el Proyecto Manhattan , por lo que los resultados fueron confidenciales y desclasificados solo en 1945. Seaborg filtró la síntesis de los elementos 95 y 96 en el programa de radio estadounidense para niños, Quiz Kids , cinco días antes de la presentación oficial en una reunión de la American Chemical Society el 11 de noviembre de 1945, cuando un oyente preguntó si se había descubierto algún nuevo elemento transuránico además del plutonio y el neptunio durante la guerra. [10] El descubrimiento del curio ( 242 Cm y 240 Cm), su producción y sus compuestos fueron posteriormente patentados enumerando solo a Seaborg como inventor. [13]
El elemento recibió su nombre en honor a Marie Curie y su esposo Pierre Curie , conocidos por descubrir el radio y por su trabajo en el campo de la radiactividad . Siguió el ejemplo del gadolinio , un elemento lantánido situado por encima del curio en la tabla periódica, que recibió su nombre en honor al explorador de tierras raras Johan Gadolin : [14]
Como nombre para el elemento de número atómico 96, nos gustaría proponer "curio", con símbolo Cm. La evidencia indica que el elemento 96 contiene siete electrones 5f y, por lo tanto, es análogo al elemento gadolinio, con sus siete electrones 4f en la serie regular de tierras raras. Sobre esta base, el elemento 96 recibe el nombre de los Curie de una manera análoga a la denominación del gadolinio, en la que se homenajeó al químico Gadolin. [8]
Las primeras muestras de curio eran apenas visibles y se identificaron por su radiactividad. Louis Werner e Isadore Perlman fabricaron la primera muestra sustancial de 30 μg de hidróxido de curio-242 en la Universidad de California, Berkeley en 1947 bombardeando americio -241 con neutrones. [15] [16] [17] En 1950, WWT Crane, JC Wallmann y BB Cunningham obtuvieron cantidades macroscópicas de fluoruro de curio(III) . Su susceptibilidad magnética era muy cercana a la del GdF 3, lo que proporcionó la primera evidencia experimental de la valencia +3 del curio en sus compuestos. [15] El metal curio se produjo recién en 1951 mediante la reducción de CmF 3 con bario . [18] [19]

3·H2O_PL_420_nm.jpg/440px-Cm(HDPA)3·H2O_PL_420_nm.jpg)
El curio, un elemento sintético y radiactivo, es un metal duro y denso de aspecto blanco plateado y propiedades físicas y químicas similares al gadolinio . Su punto de fusión de 1344 °C es significativamente más alto que el de los elementos anteriores, el neptunio (637 °C), el plutonio (639 °C) y el americio (1176 °C). En comparación, el gadolinio se funde a 1312 °C. El curio hierve a 3556 °C. Con una densidad de 13,52 g/cm 3 , el curio es más ligero que el neptunio (20,45 g/cm 3 ) y el plutonio (19,8 g/cm 3 ), pero más pesado que la mayoría de los demás metales. De las dos formas cristalinas del curio, la α-Cm es más estable en condiciones ambientales. Tiene una simetría hexagonal, grupo espacial P6 3 /mmc, parámetros de red a = 365 pm y c = 1182 pm, y cuatro unidades de fórmula por celda unitaria . [20] El cristal consiste en un empaquetamiento cerrado doblemente hexagonal con la secuencia de capas ABAC y, por lo tanto, es isotípico con α-lantano. A una presión >23 GPa , a temperatura ambiente, α-Cm se convierte en β-Cm, que tiene simetría cúbica centrada en las caras , grupo espacial Fm 3 m y constante de red a = 493 pm. [20] Con una compresión adicional a 43 GPa, el curio se convierte en una estructura ortorrómbica γ-Cm similar al α-uranio, sin que se observen transiciones adicionales hasta 52 GPa. Estas tres fases de curio también se denominan Cm I, II y III. [21] [22]
El curio tiene propiedades magnéticas peculiares. Su elemento vecino, el americio, no muestra ninguna desviación del paramagnetismo de Curie-Weiss en todo el rango de temperaturas, pero el α-Cm se transforma a un estado antiferromagnético al enfriarse a 65–52 K, [23] [24] y el β-Cm exhibe una transición ferromagnética a ~205 K. Los pnictidos de curio muestran transiciones ferromagnéticas al enfriarse: 244 CmN y 244 CmAs a 109 K, 248 CmP a 73 K y 248 CmSb a 162 K. El análogo lantánido del curio, el gadolinio, y sus pnictidos, también muestran transiciones magnéticas al enfriarse, pero el carácter de la transición es algo diferente: Gd y GdN se vuelven ferromagnéticos, y GdP, GdAs y GdSb muestran un ordenamiento antiferromagnético. [25]
Según los datos magnéticos, la resistividad eléctrica del curio aumenta con la temperatura (aproximadamente el doble entre 4 y 60 K) y luego se mantiene casi constante hasta la temperatura ambiente. Hay un aumento significativo de la resistividad con el tiempo (~10 μΩ·cm/h ) debido al daño propio de la red cristalina por desintegración alfa. Esto hace que sea incierta la verdadera resistividad del curio (~125 μΩ·cm ). La resistividad del curio es similar a la del gadolinio y los actínidos plutonio y neptunio, pero significativamente mayor que la del americio, uranio, polonio y torio . [3] [26]
Bajo iluminación ultravioleta, los iones de curio(III) muestran una fluorescencia amarilla-naranja fuerte y estable con un máximo en el rango de 590–640 nm dependiendo de su entorno. [27] La fluorescencia se origina a partir de las transiciones del primer estado excitado 6 D 7/2 y el estado fundamental 8 S 7/2 . El análisis de esta fluorescencia permite monitorear las interacciones entre los iones Cm(III) en complejos orgánicos e inorgánicos. [28]

El ion curio en solución casi siempre tiene un estado de oxidación +3 , el estado de oxidación más estable para el curio. [29] Un estado de oxidación +4 se observa principalmente en unas pocas fases sólidas, como CmO 2 y CmF 4 . [30] [31] El curio (IV) acuoso solo se conoce en presencia de oxidantes fuertes como el persulfato de potasio , y se reduce fácilmente a curio (III) por radiólisis e incluso por el agua misma. [32] El comportamiento químico del curio es diferente al de los actínidos torio y uranio, y es similar al americio y muchos lantánidos . En solución acuosa, el ion Cm 3+ es incoloro a verde pálido; [33] El ion Cm 4+ es amarillo pálido. [34] La absorción óptica del ion Cm 3+ contiene tres picos agudos a 375,4, 381,2 y 396,5 nm y su fuerza se puede convertir directamente en la concentración de los iones. [35] El estado de oxidación +6 solo se informó una vez en solución en 1978, como el ion curilo ( CmO2+
2): esto se preparó a partir de la desintegración beta del americio-242 en el ion americio (V)242
AmO+
2. [2] La imposibilidad de obtener Cm(VI) a partir de la oxidación de Cm(III) y Cm(IV) puede deberse al alto potencial de ionización de Cm 4+ /Cm 3+ y a la inestabilidad de Cm(V). [32]
Los iones de curio son ácidos de Lewis duros y, por lo tanto, forman complejos más estables con bases duras. [36] El enlace es principalmente iónico, con un pequeño componente covalente. [37] El curio en sus complejos exhibe comúnmente un entorno de coordinación de 9 pliegues, con una geometría molecular prismática trigonal tricapada . [38]
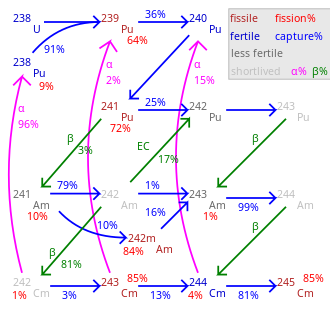
Se conocen alrededor de 19 radioisótopos y 7 isómeros nucleares , 233 Cm a 251 Cm; ninguno es estable . Las vidas medias más largas son 15,6 millones de años ( 247 Cm) y 348.000 años ( 248 Cm). Otros de larga duración son 245 Cm (8500 años), 250 Cm (8300 años) y 246 Cm (4760 años). El curio-250 es inusual: en su mayoría (~86%) se desintegra por fisión espontánea . Los isótopos más utilizados son 242 Cm y 244 Cm con vidas medias de 162,8 días y 18,1 años, respectivamente. [12]
Todos los isótopos que van desde 242 Cm a 248 Cm, así como 250 Cm, experimentan una reacción nuclear en cadena autosostenida y, por lo tanto, en principio pueden ser un combustible nuclear en un reactor. Como en la mayoría de los elementos transuránicos, la sección eficaz de fisión nuclear es especialmente alta para los isótopos de curio de masa impar 243 Cm, 245 Cm y 247 Cm. Estos se pueden utilizar en reactores de neutrones térmicos , mientras que una mezcla de isótopos de curio solo es adecuada para reactores reproductores rápidos, ya que los isótopos de masa par no son fisionables en un reactor térmico y se acumulan a medida que aumenta la combustión. [42] El combustible de óxido mixto (MOX), que se utilizará en reactores de potencia, debe contener poco o nada de curio porque la activación neutrónica de 248 Cm creará californio . El californio es un fuerte emisor de neutrones y contaminaría la parte final del ciclo del combustible y aumentaría la dosis al personal del reactor. Por lo tanto, si se van a utilizar actínidos menores como combustible en un reactor de neutrones térmicos, el curio debería excluirse del combustible o colocarse en barras de combustible especiales donde sea el único actínido presente. [43]
La tabla adjunta enumera las masas críticas de los isótopos de curio para una esfera, sin moderador ni reflector. Con un reflector de metal (30 cm de acero), las masas críticas de los isótopos impares son de unos 3-4 kg. Cuando se utiliza agua (con un espesor de ~20-30 cm) como reflector, la masa crítica puede ser tan pequeña como 59 gramos para 245 Cm, 155 gramos para 243 Cm y 1550 gramos para 247 Cm. Existe una incertidumbre significativa en estos valores de masa crítica. Si bien suele ser del orden del 20 %, algunos grupos de investigación enumeraron los valores para 242 Cm y 246 Cm como 371 kg y 70,1 kg, respectivamente. [42] [45]
El curio no se utiliza actualmente como combustible nuclear debido a su baja disponibilidad y alto precio. [46] 245 Cm y 247 Cm tienen una masa crítica muy pequeña y, por lo tanto, podrían usarse en armas nucleares tácticas , pero no se sabe que se haya fabricado ninguna. El curio-243 no es adecuado para esto, debido a su corta vida media y fuerte emisión α, que causaría un calor excesivo. [47] El curio-247 sería muy adecuado debido a su larga vida media, que es 647 veces más larga que el plutonio-239 (utilizado en muchas armas nucleares existentes ).

El isótopo de vida más larga, el 247 Cm, tiene una vida media de 15,6 millones de años; por lo que cualquier curio primordial , es decir, presente en la Tierra cuando se formó, ya debería haberse desintegrado. Su presencia pasada como radionucleido extinto es detectable como un exceso de su primogénito primordial de larga vida, el 235 U. [48] Es posible que existan trazas de 242 Cm de forma natural en los minerales de uranio debido a la captura de neutrones y la desintegración beta ( 238 U → 239 Pu → 240 Pu → 241 Am → 242 Cm), aunque las cantidades serían minúsculas y esto no ha sido confirmado: incluso con estimaciones "extremadamente generosas" para las posibilidades de absorción de neutrones, la cantidad de 242 Cm presente en 1 × 10 8 kg de pechblenda de uranio al 18% no sería ni siquiera un átomo. [49] [50] [51] Probablemente también se traigan a la Tierra trazas de 247 Cm en los rayos cósmicos , pero esto tampoco ha sido confirmado. [49] También existe la posibilidad de que el 244 Cm se produzca como hija de la doble desintegración beta del 244 Pu natural . [49] [52]
El curio se produce artificialmente en pequeñas cantidades con fines de investigación. También se presenta como uno de los productos de desecho en el combustible nuclear gastado . [53] [54] El curio está presente en la naturaleza en algunas áreas utilizadas para pruebas de armas nucleares . [55] El análisis de los escombros en el sitio de prueba de la primera arma termonuclear de los Estados Unidos , Ivy Mike (1 de noviembre de 1952, atolón Enewetak ), además de einstenio , fermio , plutonio y americio , también reveló isótopos de berkelio, californio y curio, en particular 245 Cm, 246 Cm y cantidades más pequeñas de 247 Cm, 248 Cm y 249 Cm. [56]
Los compuestos atmosféricos de curio son poco solubles en solventes comunes y se adhieren principalmente a partículas del suelo. El análisis del suelo reveló una concentración de curio aproximadamente 4000 veces mayor en las partículas arenosas del suelo que en el agua presente en los poros del suelo. Se midió una proporción aún mayor de aproximadamente 18 000 en suelos francos . [57]
Los elementos transuránicos, desde el americio hasta el fermio, incluido el curio, se producían de forma natural en el reactor de fisión nuclear natural de Oklo , pero ya no lo hacen. [58]
También se ha sospechado que el curio y otros actínidos no primordiales existen en el espectro de la estrella de Przybylski . [59]
El curio se fabrica en pequeñas cantidades en los reactores nucleares , y hasta ahora solo se han acumulado kilogramos de 242 Cm y 244 Cm, y gramos o incluso miligramos para isótopos más pesados. De ahí el alto precio del curio, que se ha cotizado a 160-185 USD por miligramo, [15] con una estimación más reciente de 2.000 USD/g para 242 Cm y 170 USD/g para 244 Cm. [60] En los reactores nucleares, el curio se forma a partir de 238 U en una serie de reacciones nucleares. En la primera cadena, 238 U captura un neutrón y se convierte en 239 U, que a través de la desintegración β − se transforma en 239 Np y 239 Pu.
Una posterior captura de neutrones seguida de una desintegración β − produce americio ( 241 Am) que a su vez se convierte en 242 Cm:
Para fines de investigación, el curio se obtiene irradiando no uranio sino plutonio, que se encuentra disponible en grandes cantidades en el combustible nuclear gastado. Para la irradiación se utiliza un flujo de neutrones mucho mayor, lo que da lugar a una cadena de reacción diferente y a la formación de 244 Cm: [9]
El curio-244 alfa se desintegra en 240 Pu, pero también absorbe neutrones, de ahí una pequeña cantidad de isótopos de curio más pesados. De ellos, el 247 Cm y el 248 Cm son populares en la investigación científica debido a sus largas vidas medias. Pero la tasa de producción de 247 Cm en reactores de neutrones térmicos es baja porque es propenso a la fisión debido a los neutrones térmicos. [61] La síntesis de 250 Cm por captura de neutrones es poco probable debido a la corta vida media del intermediario 249 Cm (64 min), que β − se desintegra en el isótopo de berkelio 249 Bk. [61]
La cascada de reacciones (n,γ) anterior da como resultado una mezcla de diferentes isótopos de curio. Su separación posterior a la síntesis es complicada, por lo que se desea una síntesis selectiva. El curio-248 es el preferido para fines de investigación debido a su larga vida media. La forma más eficiente de preparar este isótopo es mediante la desintegración α del isótopo de californio 252 Cf, que está disponible en cantidades relativamente grandes debido a su larga vida media (2,65 años). De esta manera, se producen alrededor de 35–50 mg de 248 Cm por año. La reacción asociada produce 248 Cm con una pureza isotópica del 97%. [61]
Otro isótopo, 245 Cm, se puede obtener para investigación a partir de la desintegración α de 249 Cf; este último isótopo se produce en pequeñas cantidades a partir de la desintegración β − de 249 Bk .

La mayoría de las rutinas de síntesis producen una mezcla de isótopos de actínidos como óxidos , de los cuales se necesita separar un isótopo dado de curio. Un procedimiento de ejemplo podría ser disolver el combustible del reactor gastado (por ejemplo, combustible MOX ) en ácido nítrico y eliminar la mayor parte del uranio y el plutonio utilizando una extracción de tipo PUREX ( extracción de plutonio - UR anium ) con fosfato de tributilo en un hidrocarburo. Luego, los lantánidos y los actínidos restantes se separan del residuo acuoso ( refinado ) mediante una extracción basada en diamida para dar, después de la extracción, una mezcla de actínidos y lantánidos trivalentes. Luego, un compuesto de curio se extrae selectivamente utilizando técnicas de centrifugación y cromatografía de múltiples pasos con un reactivo apropiado. [62] El complejo de bis -triazinil bipiridina se ha propuesto recientemente como un reactivo de este tipo que es altamente selectivo para el curio. [63] La separación del curio del americio, un compuesto químicamente muy similar, también se puede realizar mediante el tratamiento de una suspensión de sus hidróxidos en bicarbonato de sodio acuoso con ozono a temperatura elevada. Tanto el americio como el curio están presentes en soluciones principalmente en el estado de valencia +3; el americio se oxida a complejos solubles de Am(IV), pero el curio permanece inalterado y, por lo tanto, se puede aislar mediante centrifugación repetida. [64]
El curio metálico se obtiene por reducción de sus compuestos. Inicialmente se utilizó para ello el fluoruro de curio(III). La reacción se realizó en un ambiente libre de agua y oxígeno, en un aparato fabricado con tantalio y tungsteno , utilizando bario elemental o litio como agentes reductores. [9] [18] [65] [66] [67]
Otra posibilidad es la reducción del óxido de curio (IV) utilizando una aleación de magnesio y zinc en una masa fundida de cloruro de magnesio y fluoruro de magnesio . [68]
El curio reacciona fácilmente con el oxígeno formando principalmente óxidos de Cm2O3 y CmO2 , [ 55] pero también se conoce el óxido divalente CmO. [69] El CmO2 negro se puede obtener quemando oxalato de curio ( Cm
2(DO
2Oh
4)
3), nitrato ( Cm(NO
3)
3), o hidróxido en oxígeno puro. [31] [70] Al calentar a 600–650 °C al vacío (aproximadamente 0,01 Pa ), se transforma en el Cm 2 O 3 blanquecino : [31] [71]
O bien, Cm2O3 se puede obtener reduciendo CmO2 con hidrógeno molecular : [ 72 ]
También se conocen varios óxidos ternarios del tipo M(II)CmO 3 , donde M representa un metal divalente, como el bario. [73]
Se ha informado que la oxidación térmica de trazas de hidruro de curio (CmH 2–3 ) produce una forma volátil de CmO 2 y el trióxido volátil CmO 3 , uno de los dos ejemplos conocidos del muy raro estado +6 para el curio. [2] Se informó que otra especie observada se comportaba de manera similar a un supuesto tetróxido de plutonio y se caracterizó tentativamente como CmO 4 , con curio en el extremadamente raro estado +8; [74] pero nuevos experimentos parecen indicar que el CmO 4 no existe, y también han puesto en duda la existencia de PuO 4. [75]
El fluoruro de curio(III) incoloro (CmF 3 ) se puede obtener añadiendo iones de fluoruro a soluciones que contienen curio(III). Por otra parte, el fluoruro de curio(IV) tetravalente marrón (CmF 4 ) solo se obtiene haciendo reaccionar el fluoruro de curio(III) con flúor molecular : [9]
Se conocen una serie de fluoruros ternarios de la forma A 7 Cm 6 F 31 (A = metal alcalino ). [76]
El cloruro de curio(III) incoloro (CmCl 3 ) se obtiene mediante la reacción del hidróxido de curio (Cm(OH) 3 ) con gas de cloruro de hidrógeno anhidro . Se puede transformar en otros haluros, como el bromuro de curio(III) (incoloro a verde claro) y el yoduro de curio(III) (incoloro), al reaccionar con la sal de amoniaco del haluro correspondiente a temperaturas de ~400–450 °C: [77]
O bien, se puede calentar el óxido de curio a ~600 °C con el ácido correspondiente (como el bromhídrico para el bromuro de curio). [78] [79] La hidrólisis en fase de vapor del cloruro de curio (III) produce oxicloruro de curio: [80]
Los sulfuros, seleniuros y telururos de curio se han obtenido tratando el curio con azufre gaseoso , selenio o telurio al vacío a temperatura elevada. [81] [82] Los pnictidos de curio del tipo CmX son conocidos por el nitrógeno , el fósforo , el arsénico y el antimonio . [9] Se pueden preparar haciendo reaccionar hidruro de curio (III) (CmH 3 ) o curio metálico con estos elementos a temperatura elevada. [83]

También se conocen complejos organometálicos análogos al uranoceno para otros actínidos, como el torio, el protactinio, el neptunio, el plutonio y el americio. La teoría de orbitales moleculares predice un complejo estable de "curoceno" (η 8 -C 8 H 8 ) 2 Cm, pero aún no se ha informado experimentalmente. [84] [85]
Formación de los complejos del tipo Cm(nC
3yo
7-BTP)
3(BTP = 2,6-di(1,2,4-triazin-3-il)piridina), en soluciones que contienen iones nC 3 H 7 -BTP y Cm 3+ ha sido confirmado por EXAFS . Algunos de estos complejos de tipo BTP interactúan selectivamente con el curio y, por lo tanto, son útiles para separarlo de los lantánidos y otros actínidos. [27] [86] Los iones Cm 3+ disueltos se unen a muchos compuestos orgánicos, como el ácido hidroxámico , [87] la urea , [88] la fluoresceína , [89] y el trifosfato de adenosina . [90] Muchos de estos compuestos están relacionados con la actividad biológica de varios microorganismos . Los complejos resultantes muestran una fuerte emisión de color amarillo anaranjado bajo la excitación con luz UV, lo que es conveniente no solo para su detección, sino también para estudiar las interacciones entre el ion Cm 3+ y los ligandos a través de cambios en la vida media (del orden de ~0,1 ms) y el espectro de fluorescencia. [28] [87] [88] [89] [90]
El curio no tiene importancia biológica. [91] Hay algunos informes sobre la biosorción de Cm 3+ por bacterias y arqueas , pero no hay evidencia de incorporación de curio en ellas. [92] [93]

El curio es uno de los elementos aislables más radiactivos. Sus dos isótopos más comunes, 242 Cm y 244 Cm, son fuertes emisores alfa (energía 6 MeV); tienen vidas medias bastante cortas, 162,8 días y 18,1 años, y dan hasta 120 W/g y 3 W/g de calor, respectivamente. [15] [94] [95] Por lo tanto, el curio se puede utilizar en su forma de óxido común en generadores termoeléctricos de radioisótopos como los de las naves espaciales. Esta aplicación se ha estudiado para el isótopo 244 Cm, mientras que el 242 Cm se abandonó debido a su precio prohibitivo, alrededor de 2000 USD/g. El 243 Cm con una vida media de ~30 años y un buen rendimiento energético de ~1,6 W/g podría ser un combustible adecuado, pero da cantidades significativas de rayos gamma y beta dañinos a partir de productos de desintegración radiactiva. Como emisor de rayos α, el 244 Cm necesita mucho menos protección contra la radiación, pero tiene una alta tasa de fisión espontánea y, por lo tanto, una gran cantidad de neutrones y radiación gamma. En comparación con un isótopo generador termoeléctrico competidor, como el 238 Pu, el 244 Cm emite 500 veces más neutrones y su mayor emisión gamma requiere una protección que es 20 veces más gruesa: 2 pulgadas (51 mm) de plomo para una fuente de 1 kW, en comparación con 0,1 pulgadas (2,5 mm) para el 238 Pu. Por lo tanto, este uso del curio se considera actualmente poco práctico. [60]
Un uso más prometedor del 242 Cm es la fabricación del 238 Pu, un radioisótopo mejor para generadores termoeléctricos como los marcapasos. Las rutas alternativas para el 238 Pu utilizan la reacción (n,γ) del 237 Np, o bombardeo de uranio con deuterón , aunque ambas reacciones siempre producen 236 Pu como subproducto no deseado, ya que este último se desintegra en 232 U con una fuerte emisión gamma. [96] El curio es un material de partida común para fabricar elementos transuránicos superiores y superpesados . Por tanto, bombardear el 248 Cm con neón ( 22 Ne), magnesio ( 26 Mg) o calcio ( 48 Ca ) produce isótopos de seaborgio ( 265 Sg), hasio ( 269 Hs y 270 Hs) y livermorio ( 292 Lv, 293 Lv y posiblemente 294 Lv). [97] El californio se descubrió cuando un objetivo de curio-242 del tamaño de un microgramo fue irradiado con partículas alfa de 35 MeV utilizando el ciclotrón de 60 pulgadas (150 cm) en Berkeley:
En este experimento sólo se produjeron unos 5.000 átomos de californio. [98]
Los isótopos de curio de masa impar 243 Cm, 245 Cm y 247 Cm son altamente fisionables y pueden liberar energía adicional en un reactor nuclear de espectro térmico . Todos los isótopos de curio son fisionables en reactores de neutrones rápidos. Este es uno de los motivos de la menor separación y transmutación de actínidos en el ciclo del combustible nuclear , lo que ayuda a reducir la radiotoxicidad a largo plazo del combustible nuclear usado o gastado .

La aplicación más práctica de 244 Cm, aunque bastante limitada en volumen total, es como fuente de partículas α en espectrómetros de rayos X de partículas alfa (APXS). Estos instrumentos se instalaron en los exploradores de Marte Sojourner , Mars , Mars 96 y Mars Exploration Rovers y en el módulo de aterrizaje Philae [99] , así como en el Laboratorio Científico de Marte para analizar la composición y la estructura de las rocas en la superficie del planeta Marte . [100] El APXS también se utilizó en las sondas lunares Surveyor 5-7, pero con una fuente de 242 Cm. [57] [101] [102]
Una configuración APXS elaborada tiene un cabezal sensor que contiene seis fuentes de curio con una tasa de desintegración total de varias decenas de milicurios (aproximadamente un gigabecquerel ). Las fuentes se coliman sobre una muestra y se analizan los espectros de energía de las partículas alfa y los protones dispersos desde la muestra (el análisis de protones se realiza solo en algunos espectrómetros). Estos espectros contienen información cuantitativa sobre todos los elementos principales de la muestra, excepto hidrógeno, helio y litio. [103]
Debido a su radiactividad, el curio y sus compuestos deben manipularse en laboratorios apropiados bajo disposiciones especiales. Si bien el curio en sí mismo emite principalmente partículas α que son absorbidas por capas delgadas de materiales comunes, algunos de sus productos de desintegración emiten fracciones significativas de rayos beta y gamma, que requieren una protección más elaborada. [55] Si se consume, el curio se excreta en unos pocos días y solo el 0,05% se absorbe en la sangre. Desde allí, aproximadamente el 45% va al hígado , el 45% a los huesos y el 10% restante se excreta. En los huesos, el curio se acumula en el interior de las interfaces con la médula ósea y no se redistribuye significativamente con el tiempo; su radiación destruye la médula ósea y, por lo tanto, detiene la creación de glóbulos rojos . La vida media biológica del curio es de aproximadamente 20 años en el hígado y 50 años en los huesos. [55] [57] El curio se absorbe en el cuerpo mucho más fuertemente por inhalación, y la dosis total permitida de 244 Cm en forma soluble es de 0,3 μ Ci . [15] La inyección intravenosa de soluciones que contenían 242 Cm y 244 Cm a ratas aumentó la incidencia de tumores óseos , y la inhalación promovió el cáncer de pulmón y de hígado . [55]
Los isótopos de curio están inevitablemente presentes en el combustible nuclear gastado (aproximadamente 20 g/tonelada). [104] Los isótopos 245 Cm– 248 Cm tienen tiempos de desintegración de miles de años y deben eliminarse para neutralizar el combustible para su eliminación. [105] Este procedimiento implica varios pasos, donde primero se separa el curio y luego se convierte mediante bombardeo de neutrones en reactores especiales en nucleidos de vida corta. Este procedimiento, la transmutación nuclear , aunque está bien documentado para otros elementos, aún se está desarrollando para el curio. [27]
{{cite web}}: CS1 maint: nombres numéricos: lista de autores ( enlace ){{cite web}}: CS1 maint: copia archivada como título ( enlace ) CS1 maint: bot: estado de URL original desconocido ( enlace )