
La girificación es el proceso de formación de los pliegues característicos de la corteza cerebral . [1]
El pico de dicho pliegue se llama giro (pl. gyri ), y su valle se llama surco (pl. sulci ). Las neuronas de la corteza cerebral residen en una fina capa de materia gris , de solo 2 a 4 mm de espesor, en la superficie del cerebro. [2] Gran parte del volumen interior está ocupado por materia blanca , que consiste en largas proyecciones axónicas hacia y desde las neuronas corticales que residen cerca de la superficie. La girificación permite que una mayor superficie cortical y, por lo tanto, una mayor funcionalidad cognitiva quepan dentro de un cráneo más pequeño .
En la mayoría de los mamíferos , la girificación comienza durante el desarrollo fetal . Los primates , los cetáceos y los ungulados tienen circunvoluciones corticales extensas, con unas pocas excepciones de especies, mientras que los pequeños roedores como la rata y el ratón no tienen ninguna. La girificación en algunos animales, por ejemplo el hurón , continúa hasta bien entrada la vida posnatal. [3]
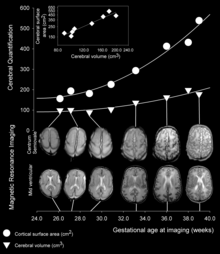
A medida que avanza el desarrollo fetal, los giros y surcos comienzan a tomar forma con la aparición de hendiduras cada vez más profundas en la superficie de la corteza. No todos los giros comienzan a desarrollarse al mismo tiempo. En cambio, los giros corticales primarios se forman primero (comenzando ya en la semana gestacional 10 en humanos), seguidos por los giros secundarios y terciarios más adelante en el desarrollo. [4] Uno de los primeros y más prominentes surcos es el surco lateral (también conocido como fisura lateral o fisura de Silvio ), seguido de otros como el surco central , que separa la corteza motora ( giro precentral ) de la corteza somatosensorial ( giro poscentral ). [5] La mayoría de los giros y surcos corticales comienzan a tomar forma entre las semanas 24 y 38 de gestación , y continúan ampliándose y madurando después del nacimiento.
Se cree que una ventaja de la girificación es una mayor velocidad de comunicación entre las células cerebrales, ya que los pliegues corticales permiten que las células estén más cerca unas de otras, lo que requiere menos tiempo y energía para transmitir impulsos eléctricos neuronales, denominados potenciales de acción . [6] Hay evidencia que sugiere una relación positiva entre la girificación y la velocidad de procesamiento de la información cognitiva, así como una mejor memoria de trabajo verbal . [7] Además, debido a que un cráneo grande requiere una pelvis más grande durante el parto , con la dificultad implícita en el bipedalismo , es más fácil dar a luz un cráneo más pequeño. [8] [9]
Los mecanismos de la girificación cortical no se comprenden bien y en la literatura científica se debaten varias hipótesis. Una hipótesis popular que se remonta a la época de Retzius a fines del siglo XIX afirma que las fuerzas mecánicas de pandeo debidas a la expansión del tejido cerebral hacen que la superficie cortical se pliegue. [10] Muchas teorías posteriores han estado vagamente vinculadas a esta hipótesis.
No se cree que una restricción externa del crecimiento del cráneo cause la girificación. Esto se debe principalmente a que el primordio del cráneo durante el período de desarrollo del cerebro fetal aún no está osificado (endurecido en el hueso a través de la calcificación ). El tejido que cubre la corteza cerebral embrionaria son varias capas delgadas de ectodermo (futura piel) y mesénquima (futuro músculo y tejido conectivo , incluido el futuro cráneo). Estas capas delgadas crecen fácilmente junto con la expansión cortical pero, finalmente, el mesénquima craneal se diferencia en cartílago ; la osificación de las placas craneales no ocurre hasta más tarde en el desarrollo. El cráneo humano continúa creciendo sustancialmente junto con el cerebro después del nacimiento hasta que las placas craneales finalmente se fusionan después de varios años. Estudios experimentales en animales han demostrado además que el plegamiento cortical puede ocurrir sin restricciones externas. [11] Por lo tanto, se cree que el crecimiento craneal está impulsado por el crecimiento del cerebro; ahora se piensa que los factores mecánicos y genéticos intrínsecos al cerebro son los principales impulsores de la girificación. [6] El único papel observado que el cráneo puede desempeñar en la girificación es el aplanamiento de las circunvoluciones a medida que el cerebro madura después de que las placas craneales se fusionan. [11]
Una teoría alternativa sugiere que las fuerzas de tensión axonal entre áreas corticales altamente interconectadas atraen áreas corticales locales unas hacia otras, induciendo pliegues. [12] Este modelo ha sido criticado: una simulación numérica por computadora no pudo producir un patrón de plegamiento biológicamente realista. [13] Un estudio mostró que la girificación puede inducirse experimentalmente en el ratón embrionario, pero en etapas tempranas en ausencia de conexiones axónicas. [14]
Más recientemente, se ha propuesto la teoría de la expansión tangencial diferencial, que afirma que los patrones de plegamiento del cerebro son el resultado de diferentes tasas de expansión tangencial entre diferentes áreas corticales. [15] Se propone que esto se debe a diferencias areales en las tasas de división progenitora temprana.
Las condiciones iniciales del cerebro tienen una fuerte influencia en su nivel final de girificación. En particular, existe una relación inversa entre el grosor cortical y la girificación. Se ha descubierto que las áreas del cerebro con valores bajos de grosor tienen niveles más altos de girificación. Lo contrario también es cierto, es decir, que las áreas del cerebro con valores altos de grosor tienen niveles más bajos de girificación. [6]
Existe cierta controversia sobre las tasas de crecimiento a través de las cuales se desarrollan las capas corticales y subcorticales del cerebro. El crecimiento puramente isotrópico sugiere que las capas de materia gris (capa externa) y blanca (núcleo interno) crecen cada una a tasas separadas, que son uniformes en todas las dimensiones. El crecimiento tangencial sugiere que la materia gris crece a una tasa más rápida que la materia blanca interna y que la tasa de crecimiento de la materia gris determina la tasa de crecimiento de la materia blanca. Aunque ambos métodos son diferenciales, ya que la corteza crece más rápidamente que la subcorteza, se ha sugerido el crecimiento tangencial como un modelo más plausible. [6]
Los pliegues en la superficie del cerebro se forman como resultado de la inestabilidad, y los modelos de crecimiento tangencial alcanzan niveles de inestabilidad que provocan pliegues con mayor frecuencia que los modelos isotrópicos. Este nivel se denomina punto crítico, en el que los modelos prefieren liberar energía potencial desestabilizando y formando pliegues para volverse más estables. [6]
El patrón de los giros y surcos corticales no es aleatorio; la mayoría de las circunvoluciones principales se conservan entre individuos y también se encuentran en todas las especies. Esta reproducibilidad puede sugerir que los mecanismos genéticos pueden especificar la ubicación de los giros principales. Los estudios de gemelos monocigóticos y dicigóticos de finales de la década de 1990 respaldan esta idea, [16] particularmente con respecto a los giros y surcos primarios, mientras que hay más variabilidad entre los giros secundarios y terciarios. [17] Por lo tanto, se puede plantear la hipótesis de que los pliegues secundarios y terciarios podrían ser más sensibles a factores genéticos y ambientales. [18] El primer gen informado que influye en la girificación fue Trnp1 . [19] Los niveles de expresión local de Trnp1 pueden determinar la posición futura de los pliegues/giros en desarrollo en los cerebros humanos. [19] [20] [21] Los genes que influyen en la dinámica de las células progenitoras corticales, la neurogénesis y la migración neuronal, así como los genes que influyen en el desarrollo de los circuitos corticales y las proyecciones axónicas pueden contribuir a la girificación. Trnp1 es un factor de unión al ADN que se ha demostrado que regula otros genes que regulan la proliferación de células progenitoras corticales, actuando así como un gen regulador maestro. [6] [19] Además, se ha informado recientemente que las vías de señalización del factor de crecimiento de fibroblastos (FGF) y Sonic Hedgehog (SHH) pueden inducir pliegues corticales, con un complemento completo de capas corticales, en ratones que viven hasta la edad adulta. [14] [22] Estos factores FGF y Shh regulan la proliferación de células madre corticales y la dinámica de la neurogénesis. También se han encontrado funciones para la beta-catenina (parte de la vía Wnt ) y niveles apropiados de muerte celular de las células progenitoras corticales. [23] [24]

Las células madre corticales, conocidas como células gliales radiales (RGC), residen en la zona ventricular y generan las neuronas glutamatérgicas excitatorias de la corteza cerebral. [25] [26] Estas células proliferan rápidamente a través de la autorrenovación en etapas tempranas del desarrollo, expandiendo el grupo de progenitoras y aumentando el área de superficie cortical. En esta etapa, el patrón de áreas corticales está genéticamente programado por un sistema de centros de señalización a través del proceso de patrón cortical , y el mapa primordial de áreas funcionales corticales en esta etapa se llama " protomapa ". [27] La neurogénesis cortical comienza a agotar el grupo de células progenitoras, sujeta a las influencias de muchas señales genéticas como los factores de crecimiento de fibroblastos (FGF) y Notch . [28] Las RGC generan precursores neuronales intermedios que se dividen aún más en la zona subventricular (SVZ), amplificando el número de neuronas corticales que se producen. [29] Las fibras largas de las CGR se proyectan a través de la corteza en desarrollo hasta la superficie pial del cerebro, y estas fibras sirven como guías físicas para la migración neuronal. [30] Una segunda clase de CGR, denominadas CGR basales (bRGC), forman un tercer grupo progenitor en la SVZ externa. [31] Las CGR basales son generalmente mucho más abundantes en los mamíferos superiores. Tanto las CGR clásicas como las bRGC descritas recientemente representan señales guía que llevan a las neuronas recién nacidas a su destino en la corteza. Un mayor número de bRGC aumenta la densidad de fibras guía en una disposición que de otro modo se desplegaría y perdería densidad de fibras. [32] La literatura científica señala diferencias en la dinámica de la proliferación y la diferenciación neuronal en cada una de estas zonas progenitoras en las especies de mamíferos, y dichas diferencias pueden explicar las grandes diferencias en el tamaño cortical y la girificación entre los mamíferos. Una hipótesis sugiere que ciertas células progenitoras generan neuronas abundantes destinadas a las capas corticales externas, lo que provoca un mayor aumento de la superficie en las capas externas en comparación con las capas corticales internas. [32] Aún no está claro cómo puede funcionar esto sin otros elementos mecanicistas. [33] [34]
Se ha utilizado un «índice de girificación» (IG) como medida de la magnitud de las circunvoluciones corticales en la superficie del cerebro de los mamíferos. [6] [35] Los cerebros de reptiles y aves no muestran girificación. Los mamíferos con un IG alto son generalmente más grandes que aquellos con un IG bajo; por ejemplo, la ballena piloto y el delfín mular muestran los valores de IG más altos. El cerebro humano, aunque más grande que el de un caballo, muestra un IG similar. Los roedores generalmente muestran los IG más bajos. No obstante, algunos roedores muestran girencefalia y algunas especies de primates son bastante lisencefálicas. [36]
Mota y Herculano-Houzel (2015) encontraron una relación lineal entre los mamíferos expresada en términos de girificación. [37] Sugieren un modelo que combina mediciones morfométricas (espesor cortical, área expuesta y área total) que podría ser una forma de describir la girificación.
Se dice que una corteza cerebral que carece de circunvoluciones superficiales es lisencefálica, lo que significa "de cerebro liso". [38] Durante el desarrollo embrionario, todos los cerebros de los mamíferos comienzan como estructuras lisencefálicas derivadas del tubo neural . Algunos, como los cerebros de los ratones, permanecen lisencefálicos durante la edad adulta. Se ha demostrado que las especies lisencefálicas poseen muchas de las señales moleculares necesarias para lograr la girificación, pero una gran variedad de genes están involucrados en la regulación de la proliferación de progenitores neuronales y los procesos neurogénicos que subyacen a la girificación. Se plantea la hipótesis de que las diferencias espaciotemporales en estas vías moleculares, incluidas FGF, Shh y Trnp1 y probablemente muchas otras, determinan el momento y la extensión de la girificación en varias especies. [19] [22]
La lisencefalia es una enfermedad humana. En los seres humanos con lisencefalia, una gran cantidad de neuronas no logran llegar a la corteza externa durante la migración neuronal y permanecen debajo de la placa cortical. [39] Este desplazamiento produce no solo defectos en las conexiones corticales, sino también un engrosamiento de la corteza, lo que concuerda con la idea de que un cerebro con una corteza más gruesa tendrá un menor grado de girificación. [40]
La polimicrogiria es una enfermedad en la que el cerebro tiene una corteza excesivamente contorneada. Aunque en la superficie el cerebro parece liso con algunos surcos, al observar el interior del cerebro se revela una estructura contorneada con una gran cantidad de pliegues secundarios y terciarios. [40] Las imágenes cerebrales con resonancia magnética revelan que un cerebro con polimicrogiria tiene una corteza delgada, lo que es coherente con la idea de que un cerebro con una corteza delgada tendrá un alto nivel de girificación. [39] [40] Se ha demostrado que una amplia variedad de genes, cuando mutan, causan polimicrogiria en humanos, que van desde mTORopatías (p. ej., AKT3) hasta canalopatías (canales de sodio, " SCN3A "). [41]
Los pacientes con autismo tienen niveles generales más altos de girificación cortical, [42] pero solo en los lóbulos temporal, parietal y occipital, así como en parte de la corteza cingulada. [43] Se ha descubierto que los niveles más altos de girificación se relacionan con una mayor conectividad local en los cerebros autistas, lo que sugiere hiperconectividad.
Se ha planteado la hipótesis de que Trnp1 , que fue capaz de inducir la girificación en modelos animales, está asociado con trastornos de la girificación en algunos casos de autismo, pero una revisión en 2012 encontró solo un caso informado de una mutación, en un paciente con síndrome de Rett (no TEA). [44]
Se ha descubierto que los pliegues del cerebro de los seres humanos autistas experimentan ligeros cambios de ubicación en las primeras etapas del desarrollo cerebral. En concreto, aparecen diferentes patrones en el surco frontal superior, la cisura de Silvio, el giro frontal inferior, el giro temporal superior y los surcos olfativos. [45] Estas áreas están relacionadas con la memoria de trabajo, el procesamiento emocional, el lenguaje y la mirada, [46] y su diferencia de ubicación y nivel de girificación en comparación con un cerebro humano neurotípico podría explicar algunas conductas alteradas en los pacientes autistas.
Una enfermedad más frecuente, la esquizofrenia , también se ha asociado con anomalías estructurales en el cerebro. Se observa una reducción del grosor cortical y un aumento de la girificación, similar a los cambios que se observan en las personas con autismo . [39] [47]
Las malformaciones corticales inducidas por el virus Zika se deben a una infección durante el embarazo y generalmente se clasifican como microcefalia o "cerebro pequeño". Debido a la gran reducción del volumen de la corteza cerebral en la microcefalia, los cambios en la girificación no son inesperados. Los estudios del mecanismo de las malformaciones de Zika indican que el defecto principal se debe a la infección de las células gliales radiales y la posterior muerte celular. [48] [49] La muerte de las células madre corticales causa la pérdida de todas las células hijas esperadas y, por lo tanto, el alcance de la malformación depende del momento de la infección, así como de su gravedad durante el cronograma de proliferación de células madre neuronales y neurogénesis. En general, se esperaría que las infecciones tempranas produzcan una malformación más grave. [50] [51] Las malformaciones de microcefalia y girificación son permanentes y no se conocen tratamientos.
La girificación cortical se puede medir en términos del índice de girificación (IG), [52] dimensionalidad fractal [53] y una combinación de términos como área, espesor y volumen. [37] El IG se define como la relación entre el área total y el área expuesta ("perímetro del cerebro delineado en secciones coronales bidimensionales"). [54] FreeSurfer , un software de reconstrucción de superficies, es una de las herramientas disponibles para medir el IG. [55]