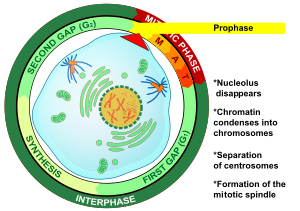

La profase (del griego antiguo προ- (pro-) 'antes' y φάσις (phásis) 'apariencia') es la primera etapa de la división celular tanto en la mitosis como en la meiosis . Después de la interfase , el ADN ya se ha replicado cuando la célula entra en profase. Los principales acontecimientos de la profase son la condensación del retículo de cromatina y la desaparición del nucléolo . [3]
La microscopía se puede utilizar para visualizar los cromosomas condensados a medida que avanzan a través de la meiosis y la mitosis . [4]
Se utilizan diversas tinciones de ADN para tratar las células de modo que los cromosomas condensados puedan visualizarse a medida que pasan por la profase. [4]
La técnica de bandas G de Giemsa se utiliza comúnmente para identificar cromosomas de mamíferos , pero utilizar la tecnología en células vegetales fue originalmente difícil debido al alto grado de compactación cromosómica en las células vegetales. [5] [4] Las bandas G se realizaron completamente para los cromosomas vegetales en 1990. [6] Durante la profase meiótica y mitótica , la tinción de Giemsa se puede aplicar a las células para obtener bandas G en los cromosomas . [2] La tinción de plata, una tecnología más moderna, junto con la tinción de Giemsa se puede utilizar para obtener imágenes del complejo sinaptonémico a lo largo de las diversas etapas de la profase meiótica . [7] Para realizar las bandas G , los cromosomas deben estar fijados y, por lo tanto, no es posible realizarlo en células vivas. [8]
Las tinciones fluorescentes como DAPI se pueden utilizar tanto en células animales como vegetales vivas . Estas tinciones no forman bandas en los cromosomas , sino que permiten sondear el ADN de regiones y genes específicos . El uso de la microscopía fluorescente ha mejorado enormemente la resolución espacial . [9]
La profase es la primera etapa de la mitosis en las células animales y la segunda etapa de la mitosis en las células vegetales . [10] Al comienzo de la profase hay dos copias idénticas de cada cromosoma en la célula debido a la replicación en interfase . Estas copias se denominan cromátidas hermanas y están unidas por un elemento de ADN llamado centrómero . [11] Los principales eventos de la profase son: la condensación de los cromosomas , el movimiento de los centrosomas , la formación del huso mitótico y el comienzo de la descomposición de los nucléolos . [3]
El ADN que se replicó en interfase se condensa a partir de cadenas de ADN con longitudes que alcanzan los 0,7 μm hasta los 0,2-0,3 μm. [3] Este proceso emplea el complejo de condensina . [11] Los cromosomas condensados constan de dos cromátidas hermanas unidas en el centrómero . [12]
Durante la profase en las células animales , los centrosomas se separan lo suficiente como para ser resueltos utilizando un microscopio óptico . [3] La actividad de los microtúbulos en cada centrosoma aumenta debido al reclutamiento de γ-tubulina . Los centrosomas replicados de la interfase se separan hacia polos opuestos de la célula, impulsados por proteínas motoras asociadas al centrosoma . [13] Los microtúbulos interpolares interdigitados de cada centrosoma interactúan entre sí, lo que ayuda a mover los centrosomas a polos opuestos. [13] [3]
Los microtúbulos involucrados en el andamiaje de la interfase se descomponen a medida que los centrosomas replicados se separan. [3] El movimiento de los centrosomas a polos opuestos está acompañado en las células animales por la organización de conjuntos de microtúbulos radiales individuales (asters) por cada centriolo. [13] Los microtúbulos interpolares de ambos centrosomas interactúan, uniendo los conjuntos de microtúbulos y formando la estructura básica del huso mitótico . [13] Las células vegetales no tienen centrosomas y los cromosomas pueden nuclear el ensamblaje de microtúbulos en el aparato mitótico . [13] En las células vegetales , los microtúbulos se reúnen en polos opuestos y comienzan a formar el aparato del huso en lugares llamados focos. [10] El huso mitótico es de gran importancia en el proceso de mitosis y eventualmente segregará las cromátidas hermanas en metafase . [3]
Los nucléolos comienzan a descomponerse en la profase, lo que da como resultado la interrupción de la producción de ribosomas. [3] Esto indica una redirección de la energía celular del metabolismo celular general a la división celular . [3] La envoltura nuclear permanece intacta durante este proceso. [10]
La meiosis implica dos rondas de segregación cromosómica y, por lo tanto, experimenta una profase dos veces, lo que da como resultado la profase I y la profase II. [12] La profase I es la fase más compleja de toda la meiosis porque los cromosomas homólogos deben aparearse e intercambiar información genética . [3] : 98 La profase II es muy similar a la profase mitótica . [12]
La profase I se divide en cinco fases: leptoteno, zigoteno, paquiteno, diploteno y diacinesis. Además de los eventos que ocurren en la profase mitótica , varios eventos cruciales ocurren dentro de estas fases, como el apareamiento de cromosomas homólogos y el intercambio recíproco de material genético entre estos cromosomas homólogos . La profase I ocurre a diferentes velocidades dependiendo de la especie y el sexo . Muchas especies detienen la meiosis en el diploteno de la profase I hasta la ovulación . [3] : 98 En los humanos, pueden pasar décadas mientras los ovocitos permanecen detenidos en la profase I solo para completar rápidamente la meiosis I antes de la ovulación . [12]
En la primera etapa de la profase I, leptoteno (del griego "delicado"), los cromosomas comienzan a condensarse. Cada cromosoma está en un estado diploide y consta de dos cromátidas hermanas ; sin embargo, la cromatina de las cromátidas hermanas aún no está lo suficientemente condensada como para poder ser resoluble en el microscopio . [3] : 98 Las regiones homólogas dentro de pares de cromosomas homólogos comienzan a asociarse entre sí. [2]
En la segunda fase de la profase I, cigoteno (del griego "conjugación"), todos los cromosomas derivados de la madre y el padre han encontrado su pareja homóloga . [3] : 98 Los pares homólogos luego experimentan sinapsis, un proceso por el cual el complejo sinaptonémico (una estructura proteínica) alinea las regiones correspondientes de información genética en las cromátidas no hermanas derivadas de la madre y el padre de pares de cromosomas homólogos . [3] : 98 [12] Los cromosomas homólogos apareados unidos por el complejo sinaptonémico se denominan bivalentes o tétradas. [10] [3] : 98 Los cromosomas sexuales (X e Y) no forman sinapsis completamente porque solo una pequeña región de los cromosomas es homóloga. [3] : 98
El nucléolo se mueve desde una posición central a una periférica en el núcleo . [14]
La tercera fase de la profase I, paquiteno (del griego "grueso"), comienza al completarse la sinapsis. [3] : 98 La cromatina se ha condensado lo suficiente como para que los cromosomas ahora se puedan resolver en microscopía . [10] Las estructuras llamadas nódulos de recombinación se forman en el complejo sinaptonémico de bivalentes . Estos nódulos de recombinación facilitan el intercambio genético entre las cromátidas no hermanas del complejo sinaptonémico en un evento conocido como entrecruzamiento o recombinación genética. [3] : 98 Pueden ocurrir múltiples eventos de recombinación en cada bivalente. En los humanos, ocurre un promedio de 2 a 3 eventos en cada cromosoma. [13] : 681
En la cuarta fase de la profase I, diploteno (del griego "doble"), se completa el entrecruzamiento . [3] : 99 [10] Los cromosomas homólogos retienen un conjunto completo de información genética; sin embargo, los cromosomas homólogos ahora son de ascendencia materna y paterna mixta. [3] : 99 Las uniones visibles llamadas quiasmas mantienen unidos a los cromosomas homólogos en los lugares donde se produjo la recombinación a medida que se disuelve el complejo sinaptonémico . [12] [3] : 99 Es en esta etapa donde se produce el arresto meiótico en muchas especies . [3] : 99
En la quinta y última fase de la profase I, diacinesis (del griego "doble movimiento"), se ha producido la condensación completa de la cromatina y las cuatro cromátidas hermanas se pueden ver en los bivalentes con microscopio . El resto de la fase se asemeja a las primeras etapas de la prometafase mitótica , ya que la profase meiótica termina con el aparato del huso comenzando a formarse y la membrana nuclear comenzando a descomponerse. [10] [3] : 99
La profase II de la meiosis es muy similar a la profase de la mitosis . La diferencia más notable es que la profase II se produce con un número haploide de cromosomas en contraposición al número diploide de la profase mitótica. [12] [10] Tanto en las células animales como en las vegetales , los cromosomas pueden descondensarse durante la telofase I, lo que requiere que se vuelvan a condensar en la profase II. [3] : 100 [10] Si los cromosomas no necesitan volver a condensarse, la profase II a menudo avanza muy rápidamente, como se ve en el organismo modelo Arabidopsis . [10]
Los mamíferos y las aves hembras nacen con todos los ovocitos necesarios para futuras ovulaciones, y estos ovocitos se detienen en la etapa de profase I de la meiosis . [15] En los humanos, por ejemplo, los ovocitos se forman entre tres y cuatro meses de gestación dentro del feto y, por lo tanto, están presentes en el nacimiento. Durante esta etapa de detención de la profase I ( dictado ), que puede durar décadas, cuatro copias del genoma están presentes en los ovocitos. El significado adaptativo de la detención de la profase I aún no se entiende completamente. Sin embargo, se ha propuesto que la detención de los ovocitos en la etapa de cuatro copias del genoma puede proporcionar la redundancia informativa necesaria para reparar el daño en el ADN de la línea germinal . [15] El proceso de reparación utilizado parece ser la reparación recombinacional homóloga . [15] [16] Los ovocitos detenidos en profase tienen una alta capacidad para la reparación eficiente de daños en el ADN . [16] La capacidad de reparación del ADN parece ser un mecanismo clave de control de calidad en la línea germinal femenina y un determinante crítico de la fertilidad . [16]

La diferencia más notable entre la profase en las células vegetales y las animales se produce porque las células vegetales carecen de centriolos . La organización del aparato del huso está asociada en cambio con focos en polos opuestos de la célula o está mediada por cromosomas. Otra diferencia notable es la preprofase , un paso adicional en la mitosis vegetal que da lugar a la formación de la banda de preprofase , una estructura compuesta de microtúbulos . En la profase mitótica I de las plantas, esta banda desaparece. [10]
La profase I en la meiosis es la iteración más compleja de la profase que ocurre tanto en las células vegetales como en las animales . [3] Para garantizar que el apareamiento de cromosomas homólogos y la recombinación del material genético se produzcan correctamente, existen puntos de control celulares . La red de puntos de control meióticos es un sistema de respuesta al daño del ADN que controla la reparación de roturas de doble cadena , la estructura de la cromatina y el movimiento y apareamiento de cromosomas . [17] El sistema consta de múltiples vías (incluido el punto de control de recombinación meiótica ) que evitan que la célula entre en la metafase I con errores debido a la recombinación. [18]