Los compuestos de diazonio o sales de diazonio son un grupo de compuestos orgánicos que comparten un grupo funcional común [R−N + ≡N]X − donde R puede ser cualquier grupo orgánico, como un alquilo o un arilo , y X es un anión inorgánico u orgánico, como un haluro . El compuesto original donde R es hidrógeno es el diazenilio .
Según la cristalografía de rayos X, el enlace C−N + ≡N es lineal en las sales de diazonio típicas. La distancia de enlace N + ≡N en el tetrafluoroborato de bencenodiazonio es 1,083(3) Å , [1] que es casi idéntica a la de la molécula de dinitrógeno (N≡N).
Las constantes de energía libre lineales σ m y σ p indican que el grupo diazonio es fuertemente atractor de electrones. Por lo tanto, los fenoles y ácidos benzoicos sustituidos con diazonio tienen valores de p K a muy reducidos en comparación con sus contrapartes no sustituidas. El p K a del protón fenólico del 4-hidroxibencenodiazonio es 3,4, [2] frente a 9,9 para el propio fenol. En otras palabras, el grupo diazonio reduce el p K a (mejora la acidez) en un millón de veces. Esto también hace que las sales de arenodiazonio tengan una reactividad reducida cuando hay grupos donadores de electrones en el anillo aromático. [3]
La estabilidad de las sales de arenodiazonio es muy sensible al contraión. El cloruro de fenildiazonio es peligrosamente explosivo, pero el tetrafluoroborato de bencenodiazonio se maneja fácilmente en el laboratorio. [ cita requerida ]
Las sales de alcanodiazonio carecen de importancia sintética debido a su reactividad extrema e incontrolada hacia la sustitución S N 2 / S N 1 / E1. Sin embargo, estos cationes son de interés teórico. Además, se cree que el carboxilato de metildiazonio es un intermediario en la metilación de ácidos carboxílicos por diazometano , una transformación común. [4] [5]
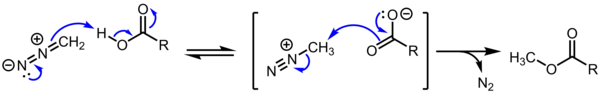
La pérdida de N 2 es favorable tanto entálpica como entrópicamente:
En el caso de las especies de alcanodiazonio secundario y terciario, se calcula que el cambio entálpico es cercano a cero o negativo, con una barrera de activación mínima. Por lo tanto, las especies de alcanodiazonio secundario y (especialmente) terciario son especies no ligadas, inexistentes o, en el mejor de los casos, intermediarios extremadamente fugaces. [6]
Se estima que el p K a acuoso del metildiazonio ( [CH 3 N 2 ] + ) es <10. [7]
El proceso de formación de compuestos de diazonio se denomina "diazotación", "diazoniación" o "diazotización". La reacción fue descrita por primera vez por Peter Griess en 1858, quien posteriormente descubrió varias reacciones de esta nueva clase de compuestos. Lo más común es que las sales de diazonio se preparen mediante el tratamiento de aminas aromáticas con ácido nitroso y ácido adicional. Por lo general, el ácido nitroso se genera in situ (en el mismo matraz) a partir de nitrito de sodio y el exceso de ácido mineral (generalmente HCl acuoso, H 2 SO 4 , p - H 3 CC 6 H 4 SO 3 H o H[BF 4 ] ):

Las sales de cloruro del catión diazonio, preparadas tradicionalmente a partir de anilina, nitrito de sodio y ácido clorhídrico , son inestables a temperatura ambiente y se preparan clásicamente a 0 – 5 °C. Sin embargo, se pueden aislar compuestos de diazonio como sales de tetrafluoroborato o tosilato , [8] que son sólidos estables a temperatura ambiente. [9] A menudo se prefiere que la sal de diazonio permanezca en solución, pero tienden a sobresaturarse . Los operadores han resultado heridos o incluso muertos por una cristalización inesperada de la sal seguida de su detonación. [10]
Debido a estos peligros, los compuestos de diazonio no suelen aislarse, sino que se utilizan in situ . Este enfoque se ilustra en la preparación de un compuesto de arenesulfonilo: [11]
El primer y todavía principal uso de las sales de diazonio es el acoplamiento azoico , que se explota en la producción de colorantes azoicos . [12] [13] En algunos casos, las telas teñidas resistentes al agua simplemente se sumergen en una solución acuosa del compuesto de diazonio, seguido de la inmersión en una solución del acoplador (el anillo rico en electrones que sufre una sustitución electrofílica). En este proceso, el compuesto de diazonio es atacado por, es decir, acoplado a, sustratos ricos en electrones. Cuando los socios de acoplamiento son arenos como anilinas y fenoles, el proceso es un ejemplo de sustitución aromática electrofílica :
Los colores profundos de los colorantes reflejan su conjugación extendida . Un colorante azoico popular es el amarillo de anilina , producido a partir de anilina . [14] El naftalen-2-ol (beta-naftol) produce un colorante rojo anaranjado intenso. El naranja de metilo es un ejemplo de colorante azoico que se utiliza en el laboratorio como indicador de pH . [14]
Otra clase de socios de acoplamiento comercialmente importante son las amidas acetoacéticas, como lo ilustra la preparación del Pigmento Amarillo 12, un pigmento diarilida . [15]
Los cationes arendiazonio experimentan varias reacciones en las que el grupo N 2 es reemplazado por otro grupo o ion. [16] [17]
El cloruro de bencenodiazonio calentado con cloruro cuproso o bromuro cuproso respectivamente disuelto en HCl o HBr produce clorobenceno o bromobenceno , respectivamente.
En la reacción de Gattermann (existen otras " reacciones de Gattermann "), el cloruro de bencenodiazonio se calienta con polvo de cobre y HCl o HBr para producir clorobenceno y bromobenceno respectivamente. [18]
Los cationes arendiazonio reaccionan con yoduro de potasio para dar yoduro de arilo: [19]
El fluorobenceno se produce por descomposición térmica del tetrafluoroborato de bencenodiazonio . La conversión se denomina reacción de Balz-Schiemann . [20]
La reacción tradicional de Balz-Schiemann ha sido objeto de muchas motivaciones, por ejemplo, utilizando hexafluorofosfato(V) ( [PF 6 ] − ) y hexafluoroantimoniato(V) ( [SbF 6 ] − ) en lugar de tetrafluoroborato ( [BF 4 ] − ). La diazotación se puede efectuar con sales de nitrosonio como hexafluoroantimoniato(V) de nitrosonio [NO] + [SbF 6 ] − . [21]
Un par de cationes diazonio se pueden acoplar para dar biarilos . Esta conversión se ilustra mediante el acoplamiento de la sal de diazonio derivada del ácido antranílico para dar ácido difénico ( (C 6 H 4 CO 2 H) 2 ). [22] En una reacción relacionada, la misma sal de diazonio sufre pérdida de N 2 y CO 2 para dar bencina . [23]
Los cationes arendiazonio reducidos con ácido hipofosforoso , [24] etanol , [25] estannita de sodio [26] o tiosulfato de sodio alcalino [27] dan benceno:
Una forma alternativa sugerida por Baeyer y Pfitzinger es reemplazar el grupo diazo con H: primero convertirlo en hidrazina tratándolo con SnCl2 y luego oxidarlo en hidrocarburo hirviéndolo con solución de sulfato cúprico. [28]
Los fenoles se producen calentando soluciones acuosas de sales de arenediazonio: [29] [30] [31] [32]
Esta reacción se conoce con el nombre alemán de Phenolverkochung ("reducción de la temperatura para producir fenoles"). El fenol formado puede reaccionar con la sal de diazonio y, por lo tanto, la reacción se lleva a cabo en presencia de un ácido que suprime esta reacción posterior. [ 33] También es posible una hidroxilación de tipo Sandmeyer utilizando Cu2O y Cu2 + en agua.
El nitrobenceno se puede obtener mediante el tratamiento del fluoroborato de bencenodiazonio con nitrito de sodio en presencia de cobre. Alternativamente, la diazotación de la anilina se puede realizar en presencia de óxido cuproso, que genera nitrito cuproso in situ:
El grupo ciano no suele poder introducirse mediante sustitución nucleofílica de haloarenos , pero estos compuestos pueden prepararse fácilmente a partir de sales de diazonio. Un ejemplo ilustrativo es la preparación de benzonitrilo utilizando el reactivo cianuro cuproso :
Esta reacción es un tipo especial de reacción de Sandmeyer .
En 2013 , dos grupos de investigación informaron sobre trifluorometilaciones de sales de diazonio . Goossen informó sobre la preparación de un complejo CuCF3 a partir de CuSCN, TMSCF3 y Cs2CO3 . Por el contrario, Fu informó sobre la trifluorometilación utilizando el reactivo de Umemoto ( tetrafluoroborato de S -trifluorometildibenzotiofenio) y polvo de Cu (condiciones de tipo Gattermann). Se pueden describir mediante la siguiente ecuación :
El corchete indica que es probable que haya otros ligandos en el cobre, pero se omiten.
Las sales de diazonio se pueden convertir en tioles mediante un procedimiento de dos pasos. El tratamiento del cloruro de bencenodiazonio con etilxantato de potasio seguido de la hidrólisis del éster de xantato intermedio produce tiofenol :
El grupo arilo se puede acoplar a otro mediante sales de arenodiazonio. Por ejemplo, el tratamiento del cloruro de bencenodiazonio con benceno (un compuesto aromático) en presencia de hidróxido de sodio da lugar a difenilo :
Esta reacción se conoce como reacción de Gomberg-Bachmann . También se logra una conversión similar al tratar el cloruro de bencenodiazonio con etanol y polvo de cobre.
Un grupo Bpin (pinacolatoboro), de uso en reacciones de acoplamiento cruzado de Suzuki-Miyaura , se puede instalar mediante la reacción de una sal de diazonio con bis(pinacolato)diboro en presencia de peróxido de benzoilo (2 mol %) como iniciador:. [34] Alternativamente, se puede lograr una borilación similar utilizando complejos de carbonilo de metales de transición, incluido el decacarbonilo de dimanganeso. [35]
Se puede introducir un grupo formilo , –CHO, tratando la sal de aril diazonio con formaldoxima ( H 2 C=NOH ), seguido de hidrólisis de la aril aldoxima para dar el aril aldehído. [36] Esta reacción se conoce como la reacción de Beech. [37]
El cloruro de bencenodiazonio reacciona con compuestos que contienen enlaces dobles activados para producir productos fenilados. La reacción se denomina arilación de Meerwein :
En sus reacciones con complejos metálicos, los cationes diazonio se comportan de manera similar al NO + . Por ejemplo, los complejos metálicos de baja valencia se agregan con sales de diazonio. Los complejos ilustrativos son [Fe(CO) 2 (PPh3 ) 2 ( N2Ph )] + y el complejo quiral en metal Fe (CO)(NO)(PPh3 ) ( N2Ph ) [39] .
En una aplicación potencial en nanotecnología , las sales de diazonio tetrafluoroborato de 4-clorobencenodiazonio funcionalizan de manera muy eficiente los nanotubos de pared simple . [40] Para exfoliar los nanotubos, se mezclan con un líquido iónico en un mortero . La sal de diazonio se agrega junto con carbonato de potasio , y después de moler la mezcla a temperatura ambiente, la superficie de los nanotubos se cubre con grupos clorofenilo con una eficiencia de 1 en 44 átomos de carbono. Estos sustituyentes agregados evitan que los tubos formen haces íntimos debido a las grandes fuerzas de cohesión entre ellos, lo cual es un problema recurrente en la tecnología de nanotubos.
También es posible funcionalizar obleas de silicio con sales de diazonio formando una monocapa de arilo . En un estudio, la superficie de silicio se lava con fluoruro de hidrógeno de amonio dejándola cubierta con enlaces silicio-hidrógeno (pasivación por hidruro). [41] La reacción de la superficie con una solución de sal de diazonio en acetonitrilo durante 2 horas en la oscuridad es un proceso espontáneo a través de un mecanismo de radicales libres : [42]

Hasta ahora, el injerto de sales de diazonio en metales se ha logrado en superficies de hierro , cobalto , níquel , platino , paladio , zinc , cobre y oro . [43] También se ha informado del injerto en superficies de diamante. [44] Una pregunta interesante planteada es la posición real del grupo arilo en la superficie. Un estudio in silico [45] demuestra que en los elementos del período 4 del titanio al cobre, la energía de enlace disminuye de izquierda a derecha porque aumenta el número de electrones d. Los metales a la izquierda del hierro se colocan inclinados hacia la superficie o planos sobre ella, lo que favorece la formación del enlace pi del metal al carbono , y los de la derecha del hierro se colocan en posición vertical, lo que favorece la formación del enlace sigma del metal al carbono . Esto también explica por qué el injerto de sales de diazonio hasta ahora ha sido posible con los metales a la derecha del hierro en la tabla periódica .
Las sales de diazonio se pueden reducir con cloruro estannoso ( SnCl 2 ) a los correspondientes derivados de hidrazina . Esta reacción es particularmente útil en la síntesis de indol de Fischer de compuestos de triptano e indometacina . El uso de ditionito de sodio es una mejora con respecto al cloruro estannoso, ya que es un agente reductor más económico y con menos problemas ambientales.
Los iones de alcanodiazonio , que rara vez se encuentran en la química orgánica, están implicados como agentes causantes de los carcinógenos. En concreto, se cree que las nitrosaminas sufren una activación metabólica para producir especies de alcanodiazonio.

Los haluros de diazonio sólidos suelen ser peligrosamente explosivos y se han reportado muertes y lesiones. [10]
La naturaleza de los aniones afecta la estabilidad de la sal. Los percloratos de arenodiazonio, como el perclorato de nitrobencenodiazonio, se han utilizado para iniciar explosivos.
{{cite book}}: Mantenimiento de CS1: ubicación ( enlace )