Las bacterias verdes del azufre son un filo , Chlorobiota , [4] de bacterias fotoautotróficas anaeróbicas obligadas que metabolizan el azufre. [5]
Las bacterias verdes del azufre no son móviles (excepto Chloroherpeton thalassium , que puede planear) y son capaces de realizar fotosíntesis anoxigénica . [5] [6] Viven en ambientes acuáticos anaeróbicos. [7] A diferencia de las plantas, las bacterias verdes del azufre utilizan principalmente iones de sulfuro como donantes de electrones. [8] Son autótrofos que utilizan el ciclo inverso del ácido tricarboxílico para realizar la fijación del carbono . [9] También son mixótrofos y reducen el nitrógeno. [10] [11]
Las bacterias verdes del azufre son bacterias gramnegativas con forma de bastón o esférica. Algunos tipos de bacterias verdes del azufre tienen vacuolas de gas que les permiten moverse. Son fotolitoautótrofas y utilizan la energía de la luz y compuestos de azufre reducido como fuente de electrones. [12] Los donantes de electrones incluyen H 2 , H 2 S, S. El principal pigmento fotosintético en estas bacterias es la bacterioclorofila c o d en las especies verdes y e en las especies marrones, y se encuentra en los clorosomas y las membranas plasmáticas. [7] Los clorosomas son una característica única que les permite capturar luz en condiciones de poca luz. [13]
La mayoría de las bacterias verdes del azufre son mesófilas , prefieren temperaturas moderadas y todas viven en ambientes acuáticos. Requieren condiciones anaeróbicas y azufre reducido; por lo general se encuentran en los primeros milímetros del sedimento. Son capaces de realizar la fotosíntesis en condiciones de poca luz. [7]
Se descubrió que el Mar Negro , un entorno extremadamente anóxico, albergaba una gran población de bacterias verdes de azufre a unos 100 m de profundidad. Debido a la falta de luz disponible en esta región del mar, la mayoría de las bacterias eran fotosintéticamente inactivas. La actividad fotosintética detectada en la quimioclina de sulfuro sugiere que las bacterias necesitan muy poca energía para el mantenimiento celular. [14]
Se ha descubierto una especie de bacteria verde del azufre que vive cerca de una fumarola negra frente a la costa de México, a una profundidad de 2.500 m en el océano Pacífico . A esta profundidad, la bacteria, denominada GSB1, vive del tenue resplandor de la chimenea térmica, ya que la luz solar no puede penetrar hasta esa profundidad. [15]
También se han encontrado bacterias verdes de azufre viviendo en colonias de arrecifes de coral en Taiwán; constituyen la mayor parte de la "capa verde" de estas colonias. Es probable que desempeñen un papel en el sistema coralino y podría existir una relación simbiótica entre las bacterias y el coral huésped. [16] El coral podría proporcionar un entorno anaeróbico y una fuente de carbono para las bacterias. Las bacterias pueden proporcionar nutrientes y desintoxicar el coral oxidando el sulfuro. [17]
En los manantiales de azufre se ha encontrado un tipo de bacteria verde del azufre, la Chlorobaculum tepidum . Estos organismos son termófilos , a diferencia de la mayoría de las demás bacterias verdes del azufre. [7]
Las bacterias verdes del azufre pertenecen a la familia Chlorobiaceae. Hay cuatro géneros: Chloroherpeton , Prosthecochloris , Chlorobium y Chlorobaculum . Las características utilizadas para distinguir entre estos géneros incluyen algunas propiedades metabólicas, pigmentos, morfología celular y espectros de absorción. Sin embargo, es difícil distinguir estas propiedades y, por lo tanto, la división taxonómica a veces no está clara. [24]
En general, los clorobios tienen forma de varilla o de vibroide y algunas especies contienen vesículas de gas. Pueden desarrollarse como células individuales o agregadas. Pueden ser de color verde o marrón oscuro. Las cepas verdes utilizan los pigmentos fotosintéticos Bchl c o d con carotenoides clorobactenos y las cepas marrones utilizan el pigmento fotosintético Bchl e con carotenoides isorenieratenos. Se requieren bajas cantidades de sal para el crecimiento. [24]
Las prosthecochloris están formadas por células vibroides, ovoides o con forma de bastón. Comienzan como células individuales que forman apéndices que no se ramifican, denominados prosthecas no ramificadas. También pueden formar vesículas de gas. Los pigmentos fotosintéticos presentes incluyen Bchl c, d o e. Además, la sal es necesaria para el crecimiento. [24]
Los clorobaculum se desarrollan como células individuales y generalmente tienen forma de vibroide o de bastón. Algunas de ellas pueden formar vesículas de gas. Los pigmentos fotosintéticos de este género son Bchl c, d o e . Algunas especies requieren NaCl (cloruro de sodio) para crecer. Los miembros de este género solían ser parte del género Chlorobium, pero han formado un linaje separado. [24]
El género Chloroherpeton es único porque sus miembros son móviles. Son bastones largos y flexibles que pueden desplazarse deslizándose. Son de color verde y contienen el pigmento fotosintético Bchl c , así como γ-caroteno . La sal es necesaria para el crecimiento. [24]
Las bacterias verdes del azufre utilizan un centro de reacción de tipo I para la fotosíntesis. Los centros de reacción de tipo I son el homólogo bacteriano del fotosistema I (PSI) en plantas y cianobacterias . Los centros de reacción GSB contienen bacterioclorofila a y se conocen como centros de reacción P840 debido a la longitud de onda de excitación de 840 nm que impulsa el flujo de electrones. En las bacterias verdes del azufre, el centro de reacción está asociado con un gran complejo de antena llamado clorosoma que captura y canaliza la energía de la luz al centro de reacción. Los clorosomas tienen un pico de absorción en la región roja lejana del espectro entre 720 y 750 nm porque contienen bacterioclorofilas c, d y e. [25] Un complejo proteico llamado complejo Fenna-Matthews-Olson (FMO) está ubicado físicamente entre los clorosomas y el RC P840. El complejo FMO ayuda a transferir eficientemente la energía absorbida por la antena al centro de reacción.
Los centros de reacción PSI y Tipo I son capaces de reducir la ferredoxina (Fd), un fuerte reductor que puede utilizarse para fijar el CO
2y reducir el NAD + . Una vez que el centro de reacción (RC) le ha dado un electrón al Fd, este se convierte en un agente oxidante (P840 + ) con un potencial de reducción de alrededor de +300 mV. Si bien esto no es lo suficientemente positivo como para quitarle electrones al agua y sintetizar O
2( mi
0= +820 mV), puede aceptar electrones de otras fuentes como H
2S , tiosulfato o Fe2+
iones. [26] Este transporte de electrones desde donadores como H
2La transferencia de S al aceptor Fd se denomina flujo electrónico lineal o transporte electrónico lineal. La oxidación de iones de sulfuro conduce a la producción de azufre como producto de desecho que se acumula en forma de glóbulos en el lado extracelular de la membrana. Estos glóbulos de azufre dan a las bacterias verdes del azufre su nombre. Cuando se agota el sulfuro, los glóbulos de azufre se consumen y se oxidan aún más a sulfato. Sin embargo, la vía de oxidación del azufre no se entiende bien. [8]
En lugar de pasar los electrones a Fd, los grupos Fe-S en el centro de reacción P840 pueden transferir los electrones a la menaquinona (MQ: MQH
2) que devuelve los electrones al P840 + a través de una cadena de transporte de electrones (CTE). En el camino de regreso a la RC, los electrones de MQH2 pasan a través de un complejo de citocromo bc 1 (similar al complejo III de las mitocondrias) que bombea H+
iones a través de la membrana. El potencial electroquímico de los protones a través de la membrana se utiliza para sintetizar ATP por la ATP sintasa F o F 1 . Este transporte cíclico de electrones es responsable de convertir la energía de la luz en energía celular en forma de ATP. [25]
Las bacterias verdes del azufre oxidan compuestos inorgánicos de azufre para utilizarlos como donantes de electrones en la fotosíntesis anaeróbica, específicamente en la fijación de dióxido de carbono. Por lo general, prefieren utilizar sulfuro en lugar de otros compuestos de azufre como donante de electrones, aunque también pueden utilizar tiosulfato o H 2 . [27] El intermediario suele ser azufre, que se deposita fuera de la célula, [28] y el producto final es sulfato. El azufre, que se deposita extracelularmente, se encuentra en forma de glóbulos de azufre, que luego pueden oxidarse por completo. [27]
Los mecanismos de oxidación del azufre en las bacterias verdes del azufre no están bien caracterizados. Algunas enzimas que se cree que están involucradas en la oxidación del sulfuro incluyen el flavocitocromo c, la sulfuro:quinona oxidorreductasa y la enzima SO
incógnitaEl flavocitocromo puede catalizar la transferencia de electrones a los citocromos desde el sulfuro, y estos citocromos podrían entonces mover los electrones al centro de reacción fotosintética. Sin embargo, no todas las bacterias verdes del azufre producen esta enzima, lo que demuestra que no es necesaria para la oxidación del sulfuro. La sulfuro:quinona oxidorreductasa (SQR) también ayuda con el transporte de electrones, pero, cuando está sola, se ha descubierto que produce tasas reducidas de oxidación del sulfuro en las bacterias verdes del azufre, lo que sugiere que existe un mecanismo diferente y más eficaz. [27] Sin embargo, la mayoría de las bacterias verdes del azufre contienen un homólogo del gen SQR. [29] La oxidación del tiosulfato a sulfato podría ser catalizada por las enzimas en el SO
incógnitasistema. [27]
Se cree que las enzimas y los genes relacionados con el metabolismo del azufre se obtuvieron mediante transferencia horizontal de genes durante la evolución de las bacterias verdes del azufre. [29]
Las bacterias verdes del azufre son fotoautótrofas : no solo obtienen energía de la luz, sino que pueden crecer utilizando dióxido de carbono como su única fuente de carbono. Fijan el dióxido de carbono utilizando el ciclo inverso del ácido tricarboxílico (rTCA) [9], donde la energía se consume para reducir el dióxido de carbono, en lugar de oxidarlo como se ve en el ciclo directo del TCA , [9] para sintetizar piruvato y acetato . Estas moléculas se utilizan como materias primas para sintetizar todos los bloques de construcción que una célula necesita para generar macromoléculas . El ciclo rTCA es altamente eficiente energéticamente, lo que permite que las bacterias crezcan en condiciones de poca luz. [30] Sin embargo, tiene varias enzimas sensibles al oxígeno que limitan su eficiencia en condiciones aeróbicas. [30]
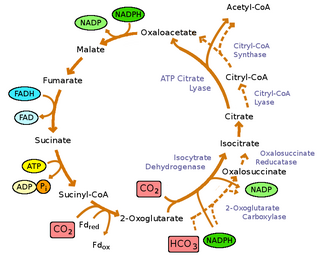
Las reacciones de inversión del ciclo oxidativo del ácido tricarboxílico son catalizadas por cuatro enzimas: [9]
Sin embargo, el ciclo oxidativo del ácido tricloroacético (OTCA) todavía está presente en las bacterias verdes del azufre. El OTCA puede asimilar el acetato, sin embargo, el OTCA parece estar incompleto en las bacterias verdes del azufre debido a la ubicación y la regulación negativa del gen durante el crecimiento fototrófico. [9]
Las bacterias verdes del azufre suelen denominarse fotoautótrofas obligadas, ya que no pueden crecer en ausencia de luz incluso si se les proporciona materia orgánica. [9] [26] Sin embargo, presentan una forma de mixotrofia donde pueden consumir compuestos orgánicos simples en presencia de luz y CO 2 . [9] En presencia de CO 2 o HCO 3 − , algunas bacterias verdes del azufre pueden utilizar acetato o piruvato. [9]
La mixotrofia en las bacterias verdes del azufre se modela mejor con la bacteria verde del azufre representativa Chlorobaculum tepidum . [31] La mixotrofia ocurre durante la biosíntesis de aminoácidos/utilización de carbono y metabolismo energético. [32] La bacteria utiliza electrones, generados a partir de la oxidación del azufre, y la energía que captura de la luz para hacer funcionar el rTCA. C. tepidum también exhibe el uso de piruvato y acetato como fuente de carbono orgánico. [32]
Un ejemplo de mixotrofia en C. tepidum que combina autotrofia y heterotrofia es su síntesis de acetil-CoA. C. tepidum puede generar acetil-CoA de forma autotrófica a través del ciclo del rTCA, o puede generarlo de forma heterotrófica a partir de la absorción de acetato. Una actividad mixotrófica similar ocurre cuando se utiliza piruvato para la biosíntesis de aminoácidos, pero el crecimiento mixotrófico utilizando acetato produce tasas de crecimiento más altas. [31] [32]
En el metabolismo energético, C. tepidum depende de las reacciones de luz para producir energía (NADPH y NADH) porque las vías típicamente responsables de la producción de energía (vía oxidativa de la pentosa fosfato y ciclo normal del TCA) son solo parcialmente funcionales. [32] Los fotones absorbidos de la luz se utilizan para producir NADPH y NADH, los cofactores del metabolismo energético. C. tepidum también genera energía en forma de ATP utilizando la fuerza motriz de protones derivada de la oxidación de sulfuro. [31] Producción de energía a partir de la oxidación de sulfuro y la absorción de fotones a través de bacterioclorofilas . [32]
La mayoría de las bacterias verdes del azufre son diazótrofas : pueden reducir el nitrógeno a amoníaco que luego se utiliza para sintetizar aminoácidos. [33] La fijación de nitrógeno entre las bacterias verdes del azufre es generalmente típica de un fotótrofo anoxigénico y requiere la presencia de luz. Las bacterias verdes del azufre exhiben actividad de un sistema de secreción de tipo 1 y una ferredoxina-NADP+ oxidorreductasa para generar hierro reducido, un rasgo que evolucionó para apoyar la fijación de nitrógeno. [34] Al igual que las bacterias púrpuras del azufre, pueden regular la actividad de la nitrogenasa postraduccionalmente en respuesta a las concentraciones de amoníaco. Su posesión de genes nif , aunque evolutivamente distintos, puede sugerir que sus habilidades de fijación de nitrógeno surgieron en dos eventos diferentes o a través de un ancestro compartido muy distante. [33]
Entre los ejemplos de bacterias verdes del azufre capaces de fijar nitrógeno se incluyen los géneros Chlorobium y Pelodictyon , excluyendo a P. phaeoclathratiforme . Prosthecochloris aestuarii y Chloroherpeton thalassium también entran en esta categoría. [33] Su fijación de N 2 está muy extendida y desempeña un papel importante en la disponibilidad general de nitrógeno para los ecosistemas. Las bacterias verdes del azufre que viven en los arrecifes de coral, como Prosthecochloris , son cruciales para generar nitrógeno disponible en un entorno ya de por sí limitado en nutrientes. [16]