La entrega de genes es el proceso de introducir material genético extraño, como ADN o ARN , en las células huésped . [1] La entrega de genes debe llegar al genoma de la célula huésped para inducir la expresión génica . [2] La entrega exitosa de genes requiere que la entrega del gen extraño permanezca estable dentro de la célula huésped y pueda integrarse en el genoma o replicarse independientemente de él. [3] Esto requiere que se sintetice ADN extraño como parte de un vector , que está diseñado para ingresar a la célula huésped deseada y entregar el transgén al genoma de esa célula. [4] Los vectores utilizados como método para la administración de genes se pueden dividir en dos categorías, virus recombinantes y vectores sintéticos (virales y no virales). [2] [5]
En eucariotas multicelulares complejos (más específicamente weissmanistas ), si el transgén se incorpora a las células de la línea germinal del huésped , la célula huésped resultante puede pasar el transgén a su progenie . Si el transgén se incorpora a células somáticas , el transgén permanecerá en la línea de células somáticas y, por tanto, en su organismo huésped. [6]
La entrega de genes es un paso necesario en la terapia génica para la introducción o silenciamiento de un gen para promover un resultado terapéutico en pacientes y también tiene aplicaciones en la modificación genética de cultivos. Existen muchos métodos diferentes de administración de genes para diversos tipos de células y tejidos. [6]
Los vectores virales surgieron en la década de 1980 como una herramienta para la expresión transgénica. En 1983, Albert Siegel describió el uso de vectores virales en la expresión de transgenes de plantas, aunque aún no estaba disponible la manipulación viral mediante clonación de ADNc. [7] El primer virus que se utilizó como vector de vacuna fue el virus vaccinia en 1984 como una forma de proteger a los chimpancés contra la hepatitis B. [8] La administración de genes no virales fue reportada por primera vez en 1943 por Avery et al. quienes mostraron un cambio de fenotipo celular a través de la exposición al ADN exógeno . [9]

Hay una variedad de métodos disponibles para entregar genes a las células huésped. Cuando los genes se entregan a bacterias o plantas, el proceso se llama transformación y cuando se usan para entregar genes a animales, se llama transfección . Esto se debe a que la transformación tiene un significado diferente en relación con los animales, indicando una progresión hacia un estado canceroso. [10] Para algunas bacterias no se necesitan métodos externos para introducir genes, ya que son naturalmente capaces de absorber ADN extraño . [11] La mayoría de las células requieren algún tipo de intervención para hacer que la membrana celular sea permeable al ADN y permitir que el ADN se inserte de manera estable en el genoma del huésped .
Los métodos químicos de administración de genes pueden utilizar compuestos naturales o sintéticos para formar partículas que faciliten la transferencia de genes a las células. [2] Estos vectores sintéticos tienen la capacidad de unir electrostáticamente ADN o ARN y compactar la información genética para acomodar transferencias genéticas más grandes. [5] Los vectores químicos generalmente ingresan a las células por endocitosis y pueden proteger el material genético de la degradación. [6]
Uno de los métodos más simples consiste en alterar el entorno de la célula y luego estresarla dándole un choque térmico . Normalmente, las células se incuban en una solución que contiene cationes divalentes (a menudo cloruro de calcio ) en condiciones de frío, antes de exponerlas a un pulso de calor. El cloruro de calcio altera parcialmente la membrana celular, lo que permite que el ADN recombinante ingrese a la célula huésped. Se sugiere que exponer las células a cationes divalentes en condiciones de frío puede cambiar o debilitar la estructura de la superficie celular, haciéndola más permeable al ADN. Se cree que el pulso de calor crea un desequilibrio térmico a través de la membrana celular, lo que obliga al ADN a ingresar a las células a través de los poros celulares o de la pared celular dañada.
Otro método simple implica el uso de fosfato de calcio para unir el ADN y luego exponerlo a células cultivadas. La solución, junto con el ADN, es encapsulada por las células y una pequeña cantidad de ADN puede integrarse en el genoma. [12]
Se pueden utilizar liposomas y polímeros como vectores para introducir ADN en las células. Los liposomas cargados positivamente se unen al ADN cargado negativamente, mientras que se pueden diseñar polímeros que interactúen con el ADN. [2] Forman lipoplexes y poliplexes respectivamente, que luego son absorbidos por las células. [13] Los dos sistemas también pueden combinarse. [6] Los vectores no virales basados en polímeros utilizan polímeros para interactuar con el ADN y formar poliplexes. [6]
El uso de nanopartículas orgánicas e inorgánicas diseñadas es otro enfoque no viral para la administración de genes. [14] [15]
La entrega artificial de genes puede estar mediada por métodos físicos que utilizan la fuerza para introducir material genético a través de la membrana celular. [2]

La electroporación es un método para promover la competencia . Las células reciben una descarga breve con un campo eléctrico de 10-20 kV /cm, lo que se cree que crea agujeros en la membrana celular a través de los cuales puede entrar el ADN plasmídico. Después de la descarga eléctrica, los mecanismos de reparación de la membrana celular cierran rápidamente los agujeros.

Otro método utilizado para transformar células vegetales es la biolística , en la que partículas de oro o tungsteno se recubren con ADN y luego se inyectan en células vegetales jóvenes o embriones de plantas. [16] Parte del material genético ingresa a las células y las transforma. Este método se puede utilizar en plantas que no son susceptibles a la infección por Agrobacterium y también permite la transformación de los plástidos de las plantas . Las células vegetales también se pueden transformar mediante electroporación, que utiliza una descarga eléctrica para hacer que la membrana celular sea permeable al ADN plasmídico. Debido al daño causado a las células y al ADN, la eficiencia de transformación de la biolística y la electroporación es menor que la transformación agrobacteriana. [17]
La microinyección es donde se inyecta ADN a través de la envoltura nuclear de la célula directamente en el núcleo . [11]
La sonoporación es la permeación transitoria de las membranas celulares asistida por ultrasonidos , normalmente en presencia de microburbujas de gas . [18] La sonoporación permite la entrada de material genético en las células. [19] [20]
La fotoporación es cuando se utilizan pulsos de láser para crear poros en una membrana celular para permitir la entrada de material genético.
La magnetofección utiliza partículas magnéticas complejadas con ADN y un campo magnético externo concentra partículas de ácido nucleico en las células objetivo.
Se puede utilizar un efecto capilar hidrodinámico para manipular la permeabilidad celular.
En las plantas, el ADN a menudo se inserta mediante recombinación mediada por Agrobacterium , [21] aprovechando la secuencia de ADN T de Agrobacterium que permite la inserción natural de material genético en las células vegetales. [22] El tejido vegetal se corta en trozos pequeños y se sumergen en un líquido que contiene Agrobacterium suspendido . Las bacterias se adherirán a muchas de las células vegetales expuestas por los cortes. La bacteria utiliza la conjugación para transferir un segmento de ADN llamado ADN-T desde su plásmido a la planta. El ADN transferido se dirige al núcleo de la célula vegetal y se integra en el ADN genómico de la planta huésped. El ADN-T plásmido se integra de forma semialeatoria en el genoma de la célula huésped. [23]
Modificando el plásmido para expresar el gen de interés, los investigadores pueden insertar el gen elegido de forma estable en el genoma de la planta. Las únicas partes esenciales del ADN-T son sus dos pequeñas repeticiones fronterizas (25 pares de bases), de las cuales al menos una es necesaria para la transformación de las plantas. [24] [25] Los genes que se introducirán en la planta se clonan en un vector de transformación de plantas que contiene la región de ADN-T del plásmido . Un método alternativo es la agroinfiltración . [26] [27]
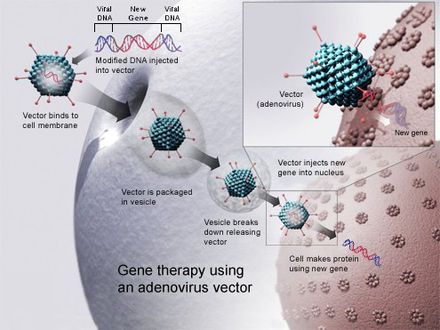
La entrega de genes mediada por virus utiliza la capacidad de un virus para inyectar su ADN dentro de una célula huésped y aprovecha la propia capacidad del virus para replicar e implementar su propio material genético. Los métodos virales de administración de genes tienen más probabilidades de inducir una respuesta inmune, pero tienen una alta eficiencia. [6] La transducción es el proceso que describe la inserción de ADN mediada por virus en la célula huésped. Los virus son una forma particularmente eficaz de administración de genes porque la estructura del virus evita la degradación a través de los lisosomas del ADN que entrega al núcleo de la célula huésped. [28] En la terapia génica, un gen destinado a ser administrado se empaqueta en una partícula viral con replicación deficiente para formar un vector viral . [29] Los virus utilizados para la terapia génica hasta la fecha incluyen retrovirus, adenovirus, virus adenoasociados y virus del herpes simple. Sin embargo, existen inconvenientes en el uso de virus para introducir genes en las células. Los virus sólo pueden introducir trozos muy pequeños de ADN en las células, esto requiere mucha mano de obra y existen riesgos de sitios de inserción aleatorios, efectos citopáticos y mutagénesis. [30]
La entrega de genes basada en vectores virales utiliza un vector viral para entregar material genético a la célula huésped. Esto se hace utilizando un virus que contiene el gen deseado y eliminando la parte del genoma del virus que es infecciosa. [2] Los virus son eficientes en la entrega de material genético al núcleo de la célula huésped, que es vital para la replicación. [2]
Los virus basados en ARN se desarrollaron debido a su capacidad de transcribir directamente a partir de transcripciones de ARN infeccioso. Los vectores de ARN se expresan rápidamente y se expresan en la forma específica, ya que no se requiere procesamiento [fuente necesaria]. Los vectores retrovirales incluyen oncoretrovirales, lentivirales y virus espumoso humano, son vectores virales basados en ARN que invierten la transcripción y se integran en el genoma del huésped, lo que permite la expresión transgénica a largo plazo. [2]
Los vectores virales basados en ADN incluyen Adenoviridae , virus adenoasociados y virus del herpes simple . [2]
Varios de los métodos utilizados para facilitar la entrega de genes tienen aplicaciones con fines terapéuticos. La terapia génica utiliza la entrega de genes para entregar material genético con el objetivo de tratar una enfermedad o afección en la célula. La administración de genes en entornos terapéuticos utiliza vectores no inmunogénicos capaces de tener especificidad celular que pueden administrar una cantidad adecuada de expresión transgénica para causar el efecto deseado. [3]
Los avances en genómica han permitido identificar una variedad de nuevos métodos y objetivos genéticos para posibles aplicaciones. Los microarrays de ADN utilizados en una variedad de secuenciaciones de próxima generación pueden identificar miles de genes simultáneamente, con software analítico que analiza patrones de expresión genética y genes ortólogos en especies modelo para identificar funciones. [31] Esto ha permitido identificar una variedad de posibles vectores para su uso en terapia génica. Como método para crear una nueva clase de vacuna, se ha utilizado la administración de genes para generar un vector biosintético híbrido para administrar una posible vacuna. Este vector supera las barreras tradicionales para la administración de genes al combinar E. coli con un polímero sintético para crear un vector que mantiene el ADN plasmídico y al mismo tiempo tiene una mayor capacidad para evitar la degradación por los lisosomas de las células diana. [32]
{{cite book}}: CS1 maint: location (link)