Una proteína de transporte de membrana (o simplemente transportador ) es una proteína de membrana [1] involucrada en el movimiento de iones , moléculas pequeñas y macromoléculas , como otra proteína , a través de una membrana biológica . Las proteínas de transporte son proteínas transmembrana integrales ; es decir, existen permanentemente dentro y atraviesan la membrana a través de la cual transportan sustancias. Las proteínas pueden ayudar en el movimiento de sustancias mediante difusión facilitada , transporte activo , ósmosis o difusión inversa . Los dos tipos principales de proteínas implicadas en dicho transporte se clasifican en términos generales como canales o transportadores . Ejemplos de proteínas canal/portadoras incluyen el uniportador GLUT 1 , los canales de sodio y los canales de potasio . Los transportadores de solutos y las SLC atípicas [2] son transportadores secundarios activos o facilitadores en humanos. [3] [4] En conjunto, los transportadores y canales de membrana se conocen como transportoma. [5] Los transportomas gobiernan la entrada y salida celular no sólo de iones y nutrientes sino también de fármacos.
Un portador no está abierto simultáneamente al entorno extracelular e intracelular. O su puerta interior está abierta o su puerta exterior está abierta. Por el contrario, un canal puede estar abierto a ambos entornos al mismo tiempo, permitiendo que las moléculas se difundan sin interrupción. Los portadores tienen sitios de unión, pero los poros y canales no. [6] [7] [8] Cuando se abre un canal, millones de iones pueden pasar a través de la membrana por segundo, pero normalmente sólo de 100 a 1000 moléculas pasan a través de una molécula portadora al mismo tiempo. [9] Cada proteína transportadora está diseñada para reconocer solo una sustancia o un grupo de sustancias muy similares. La investigación ha correlacionado defectos en proteínas portadoras específicas con enfermedades específicas. [10]
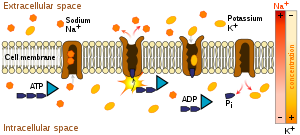
El transporte activo es el movimiento de una sustancia a través de una membrana en contra de su gradiente de concentración. Esto suele ser para acumular altas concentraciones de moléculas que una célula necesita, como glucosa o aminoácidos. Si el proceso utiliza energía química, como el trifosfato de adenosina (ATP), se denomina transporte activo primario . Las proteínas de transporte de membrana que son impulsadas directamente por la hidrólisis de ATP se denominan bombas de ATPasa . [11] Este tipo de bombas dirigen la hidrólisis exergónica del ATP al movimiento desfavorable de las moléculas en contra de su gradiente de concentración. Ejemplos de bombas de ATPasa incluyen ATPasa de tipo P , ATPasas de tipo V , ATPasas de tipo F y casetes de unión ABC . [ cita necesaria ]
El transporte activo secundario implica el uso de un gradiente electroquímico y no utiliza energía producida en la célula. [12] El transporte activo secundario comúnmente utiliza tipos de proteínas portadoras, típicamente simportadoras y antiportadoras . Las proteínas simportadoras acoplan el transporte de una molécula a favor de su gradiente de concentración con el transporte de otra molécula en contra de su gradiente de concentración, y ambas moléculas se difunden en la misma dirección . Las proteínas antiportadoras transportan una molécula a favor de su gradiente de concentración para transportar otra molécula en contra de su gradiente de concentración, pero las moléculas se difunden en direcciones opuestas . Como los simportadores y antiportadores participan en el acoplamiento del transporte de dos moléculas, comúnmente se les denomina cotransportadores . A diferencia de las proteínas de canal que solo transportan sustancias a través de las membranas de forma pasiva, las proteínas transportadoras pueden transportar iones y moléculas de forma pasiva mediante difusión facilitada o mediante transporte activo secundario. [13] Se requiere una proteína transportadora para mover partículas de áreas de baja concentración a áreas de alta concentración. Estas proteínas transportadoras tienen receptores que se unen a una molécula específica (sustrato) que necesita transporte. La molécula o ion a transportar (el sustrato) primero debe unirse a un sitio de unión en la molécula portadora, con una cierta afinidad de unión. Después de la unión, y mientras el sitio de unión mira en la misma dirección, el portador capturará u ocluirá (absorberá y retendrá) el sustrato dentro de su estructura molecular y provocará una translocación interna de modo que la abertura en la proteína ahora mire hacia el otro lado de la proteína. la membrana plasmática. [14] El sustrato de la proteína transportadora se libera en ese sitio, de acuerdo con su afinidad de unión allí. [ cita necesaria ]

La difusión facilitada es el paso de moléculas o iones a través de una membrana biológica a través de proteínas de transporte específicas y no requiere aporte de energía. La difusión facilitada se utiliza especialmente en el caso de grandes moléculas polares e iones cargados; Una vez que dichos iones se disuelven en agua, no pueden difundir libremente a través de las membranas celulares debido a la naturaleza hidrófoba de las colas de ácidos grasos de los fosfolípidos que forman las bicapas. El tipo de proteínas portadoras utilizadas en la difusión facilitada es ligeramente diferente de las utilizadas en el transporte activo. Siguen siendo proteínas transportadoras transmembrana, pero son canales transmembrana cerrados, lo que significa que no se translocan internamente ni requieren ATP para funcionar. El sustrato se toma en un lado del transportador cerrado y, sin utilizar ATP, el sustrato se libera en la célula. La difusión facilitada no requiere el uso de ATP ya que la difusión facilitada, como la difusión simple, transporta moléculas o iones a lo largo de su gradiente de concentración. [15]
La ósmosis es la difusión pasiva de agua a través de una membrana celular desde un área de alta concentración a un área de baja concentración. Dado que la ósmosis es un proceso pasivo, como la difusión facilitada y la difusión simple, no requiere el uso de ATP. La ósmosis es importante para regular el equilibrio de agua y sal dentro de las células, por lo que desempeña un papel fundamental en el mantenimiento de la homeostasis. [16] Las acuaporinas son proteínas integrales de membrana que permiten el paso rápido de agua y glicerol a través de las membranas. Los monómeros de acuaporina constan de seis dominios de hélice alfa transmembrana y estos monómeros pueden ensamblarse para formar las proteínas de acuaporina. Como cuatro de estos monómeros se unen para formar la proteína acuaporina, se la conoce como homotetrámero , lo que significa que está formada por cuatro subunidades idénticas. [17] [18] Todas las acuaporinas son proteínas integrales de membrana tetraméricas y el agua pasa a través de cada canal de monómero individual en lugar de entre los cuatro canales. Dado que las acuaporinas son canales transmembrana para la difusión de agua, los canales que forman la acuaporina suelen estar revestidos con cadenas laterales hidrófilas para permitir el paso del agua.
El transporte inverso , o inversión del transportador , es un fenómeno en el que los sustratos de una proteína transportadora de membrana se mueven en dirección opuesta a la de su movimiento típico por parte del transportador. [19] [20] [21] [22] [23] La inversión del transportador generalmente ocurre cuando una proteína de transporte de membrana es fosforilada por una proteína quinasa particular , que es una enzima que agrega un grupo fosfato a las proteínas. [19] [20]
(Agrupados por categorías de la base de datos de Clasificación de Transporter )
La difusión facilitada ocurre dentro y fuera de la membrana celular a través de canales/poros y portadores/portadores.
Nota:
Los canales están en estado abierto o cerrado. Cuando un canal se abre con un ligero cambio conformacional, se abre a ambos entornos simultáneamente (extracelular e intracelular).

Los poros están continuamente abiertos a ambos ambientes, porque no sufren cambios conformacionales. Siempre están abiertos y activos.
También denominadas proteínas portadoras o portadoras secundarias.


Los translocadores de grupos proporcionan un mecanismo especial para la fosforilación de los azúcares a medida que se transportan a las bacterias (translocación del grupo PEP).
Los portadores de transferencia de electrones transmembrana en la membrana incluyen portadores de dos electrones, como las oxidorreductasas de enlace disulfuro (DsbB y DsbD en E. coli), así como portadores de un electrón como la NADPH oxidasa. A menudo, estas proteínas redox no se consideran proteínas de transporte.
Cada proteína transportadora, especialmente dentro de la misma membrana celular, es específica de un tipo o familia de moléculas. GLUT1 es una proteína transportadora con nombre que se encuentra en casi todas las membranas de las células animales y que transporta glucosa a través de la bicapa. Esta proteína es uniportadora , es decir, transporta la glucosa a lo largo de su concentración en una dirección singular. Es un portador de proteínas de membrana integral con un interior hidrófilo, lo que le permite unirse a la glucosa. Como GLUT 1 es un tipo de proteína transportadora, sufrirá un cambio conformacional para permitir que la glucosa ingrese al otro lado de la membrana plasmática. [24] GLUT 1 se encuentra comúnmente en las membranas de los glóbulos rojos de los mamíferos. [25]
Si bien hay muchos ejemplos de canales dentro del cuerpo humano, dos notables son los canales de sodio y potasio. Los canales de potasio suelen participar en el transporte de iones de potasio a través de la membrana celular hacia el exterior de la célula, lo que ayuda a mantener el potencial de membrana negativo de las células. Como hay más canales de potasio que canales de sodio, sale más potasio de la célula que sodio hacia la célula, por lo que el potencial de membrana es negativo. Los canales de sodio suelen participar en el transporte de iones de sodio a través de la membrana celular hacia el interior de la célula. Estos canales se asocian comúnmente con neuronas excitables, ya que una entrada de sodio puede desencadenar la despolarización, que a su vez propaga un potencial de acción. [26] Como estas proteínas son tipos de proteínas de canal, no sufren un cambio de conformación después de unirse a sus respectivos sustratos.
Otras proteínas portadoras específicas también ayudan al cuerpo a funcionar de manera importante. Los citocromos operan en la cadena de transporte de electrones como proteínas transportadoras de electrones. [12]
Varias enfermedades hereditarias implican defectos en las proteínas portadoras de una sustancia o grupo de células en particular. La cisteinuria (cisteína en la orina y la vejiga) es una enfermedad que involucra proteínas transportadoras de cisteína defectuosas en las membranas de las células renales. Este sistema de transporte normalmente elimina la cisteína del líquido destinado a convertirse en orina y devuelve este aminoácido esencial a la sangre. Cuando este transportador falla, grandes cantidades de cisteína permanecen en la orina, donde es relativamente insoluble y tiende a precipitar. Esta es una de las causas de los cálculos urinarios. [27] Se ha demostrado que algunas proteínas portadoras de vitaminas están sobreexpresadas en pacientes con enfermedades malignas. Por ejemplo, se ha demostrado que los niveles de proteína transportadora de riboflavina (RCP) están significativamente elevados en personas con cáncer de mama . [28]
Anderle, P., Barbacioru, C., Bussey, K., Dai, Z., Huang, Y., Papp, A., Reinhold, W., Sadee, W., Shankavaram, U. y Weinstein, J. (2004). Canales y transportadores de membrana: papel del transportoma en la quimiosensibilidad y quimiorresistencia del cáncer. Investigación del cáncer, 54, 4294-4301.