En química orgánica , los arinos [1] y los bencinos [2] son una clase de especies químicas altamente reactivas derivadas de un anillo aromático mediante la eliminación de dos sustituyentes . Los arinos son ejemplos de didehidroarenos (1,2-dideshidroarenos en este caso), aunque también se conocen 1,3- y 1,4-dideshidroarenos. [3] [4] [5] Los arinos son ejemplos de alquinos sometidos a alta tensión .
La representación alquino del benceno es la más encontrada. Generalmente se describe que los arinos tienen un triple enlace tenso. [6]

Las limitaciones geométricas del triple enlace del benceno dan como resultado una menor superposición de los orbitales p en el plano y, por tanto, un triple enlace más débil. [7] Radziszewski asignó la frecuencia de vibración del triple enlace en el benceno a 1846 cm -1 , [8] lo que indica un triple enlace más débil que en el alquino no tenso con una frecuencia de vibración de aproximadamente 2150 cm -1 . Sin embargo, el benceno se parece más a un alquino tenso que a un diradical, como se ve por la gran brecha singlete-triplete y la reactividad similar a la de un alquino. [3]

El LUMO del arino es mucho más bajo que el LUMO de los alquinos no tensos, lo que lo convierte en una mejor combinación energética para el HOMO de los nucleófilos. Por tanto, el benceno posee carácter electrófilo y sufre reacciones con nucleófilos. [9] En 1968 se presentó un análisis detallado de MO del benceno. [10]

Debido a su extrema reactividad, los arinos deben generarse in situ . Como ocurre con otros intermedios reactivos , el benceno debe quedar atrapado; de lo contrario, se dimeriza a bifenileno .
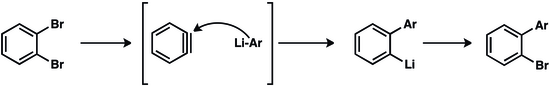
Las primeras rutas hacia el benceno implicaban la deshidrohalogenación de haluros de arilo :

Estas reacciones requieren una base fuerte y altas temperaturas. Los arenos 1,2-disustituidos sirven como precursores de los bencinos en condiciones más suaves. El benceno se genera mediante la deshalogenación del 1-bromo-2-fluorobenceno por magnesio. [11] El ácido antranílico se puede convertir en 2-diazoniobenceno-1-carboxilato mediante diazotización y neutralización. Aunque explosiva, [12] esta especie zwitteriónica es un precursor conveniente y económico del benceno. [13]

Otro método se basa en triflatos de trimetilsililarilo . [14] El desplazamiento del fluoruro del grupo trimetilsililo induce la eliminación del triflato y la liberación de bencino:

Una reacción de hexadehidro Diels-Alder (HDDA) implica la cicloadición de 1,3-diino y alquino. [15]

La N -aminación de 1 H -benzotriazol con ácido hidroxilamina - O -sulfónico genera un intermedio que puede oxidarse a benceno con un rendimiento casi cuantitativo con acetato de plomo (IV) . [dieciséis]

Incluso a bajas temperaturas, los arinos son extremadamente reactivos. Su reactividad se puede clasificar en tres clases principales: (1) adiciones nucleofílicas, (2) reacciones pericíclicas y (3) inserción de enlaces.
Tras el tratamiento con nucleófilos básicos, los haluros de arilo desprotonan alfa al grupo saliente, lo que resulta en deshidrohalogenación . Los estudios de intercambio isotópico indican que para los fluoruros de arilo y, a veces, los cloruros de arilo, el proceso de eliminación se produce en dos pasos: la desprotonación, seguida de la expulsión del nucleófilo. Por tanto, el proceso es formalmente análogo al mecanismo E1cb de compuestos alifáticos. Los bromuros y yoduros de arilo, por otro lado, generalmente parecen sufrir eliminación mediante un mecanismo E2 sincoplanar concertado. [17] [18] El benceno resultante forma productos de adición, generalmente por adición nucleofílica y protonación. La generación del intermedio bencino es el paso lento de la reacción. [19]

Las reacciones de "acoplamiento de arino" permiten la generación de compuestos de bifenilo que son valiosos en la industria farmacéutica, la agricultura y como ligandos en muchas transformaciones catalizadas por metales. [20]
El producto metal-areno también puede agregarse a otro arino, lo que lleva a una polimerización por crecimiento de cadena . El uso de cianuro de cobre (I) como iniciador para agregar al primer arino produjo polímeros que contenían hasta aproximadamente 100 unidades de areno. [21]
Cuando el grupo saliente (LG) y el sustituyente (Y) son mutuamente orto o para, sólo es posible un intermediario bencino. Sin embargo, cuando LG es meta de Y, entonces son posibles los resultados regioquímicos (A y B). Si Y es un aceptor de electrones, entonces HB es más ácido que HA, lo que da como resultado que se genere el regioisómero B. De manera análoga, si Y es donante de electrones, se genera el regioisómero A, ya que ahora H A es el protón más ácido.

Hay dos posibles regioisómeros de benceno con sustituyente (Y): el triple enlace puede ubicarse entre C2 y C3 o entre C3 y C4. Los sustituyentes orto al grupo saliente darán lugar al triple enlace entre C2 y C3. Para Y y LG conducirán al regioisómero con triple enlace entre C3 y C4. El sustituyente meta puede proporcionar ambos regioisómeros como se describe anteriormente. En el caso de un triple enlace ubicado entre C2 y C3, los sustituyentes aceptores de electrones (EWG), por ejemplo CF3, dirigirán la adición del nucleófilo para colocar el carbanión lo más cerca posible de EWG. Sin embargo, los sustituyentes donadores de electrones (EDG), por ejemplo CH3, proporcionarán poca selectividad entre productos. En el regioisómero donde el triple enlace se encuentra entre C3 y C4, el efecto del sustituyente sobre la adición de nucleófilos disminuye y a menudo se obtienen mezclas de productos para y meta. [19]

El benceno sufre una rápida dimerización para formar bifenileno. Algunas rutas para obtener benceno conducen a un rendimiento especialmente rápido y alto en esta reacción posterior. [13] [16] La trimerización da trifenileno . [22]
Los bencinos pueden sufrir reacciones de ciclación [4+2] . Cuando se genera en presencia de antraceno , se produce tripticeno . [11] En este método, el mecanismo concertado de la reacción de Diels-Alder entre benceno y furano se muestra a continuación. Se cree que otras cicloadiciones de bencino [4+2] se realizan mediante un mecanismo gradual.

Un ejemplo clásico es la síntesis de 1,2,3,4-tetrafenilnaftaleno . [23] El tetrabromobenceno puede reaccionar con butillitio y furano para formar un tetrahidroantraceno [24]

Las cicloadiciones [4+2] de arinos se han aplicado comúnmente a la síntesis total de productos naturales. Sin embargo, la principal limitación de este enfoque es la necesidad de utilizar dienos restringidos, como furano y ciclopentadieno. [14] En 2009, Buszek y sus colaboradores sintetizaron herbindol A utilizando arino [4+2]-cicloadición. [25] 6,7-indolino se somete a cicloadición [4+2] con ciclopentadieno para producir un producto tetracíclico complejo.

Los bencinos sufren cicloadición [2+2] con una amplia gama de alquenos. Debido a la naturaleza electrófila del benceno, los alquenos que contienen sustituyentes donadores de electrones funcionan mejor para esta reacción. [26]
Debido a la importante formación de subproductos, la química del arino [2+2] rara vez se utiliza en la síntesis total de productos naturales. [14] Sin embargo, existen varios ejemplos. En 1982, Stevens y sus colaboradores informaron sobre una síntesis de taxodiona que utilizaba cicloadición [2+2] entre un acetal arino y ceteno. [27]

Mori y sus colaboradores realizaron una cociclación [2+2+2] catalizada por paladio de arino y diino en su síntesis total de taiwaninas C. [28]

El primer ejemplo de reacción de inserción de enlace σ arino es la síntesis de melleína en 1973. [29]

Si el benceno es 1,2-dideshidrobenceno, son posibles dos isómeros más: 1,3-dideshidrobenceno y 1,4-dideshidrobenceno. [3] Sus energías en silico son, respectivamente, 106, 122 y 138 kcal/mol (444, 510 y 577 kJ/mol). [30] Los isómeros 1,2 y 1,3 tienen estados fundamentales singulete, mientras que para el 1,4-dideshidrobenceno la brecha es menor.

Se ha estudiado la interconversión de los 1,2-, 1,3- y 1,4-dideshidrobencenos. [30] [31] Se ha postulado que se produce una conversión de 1,2 a 1,3-dideshidrobenceno en la pirólisis (900 °C) de los precursores de arino sustituidos con fenilo [30] como se muestra a continuación. Se requieren temperaturas extremadamente altas para la interconversión de benceno.

En experimentos clásicos con 1,4-dideshidrobenceno, calentando a 300 °C, [1,6-D2]-A se equilibra fácilmente con [3,2-D2]-B , pero no se equilibra con C o D. La migración simultánea de átomos de deuterio para formar B y el hecho de que no se forme ninguno de C o D sólo puede explicarse por la presencia de un intermedio cíclico y simétrico: el 1,4-dideshidrobenceno. [32]

Se propusieron dos estados para el 1,4-dideshidrobenceno: singlete y triplete, siendo el estado singlete de menor energía. [33] [34] El estado triplete representa dos centros radicales que no interactúan y, por lo tanto, debería extraer hidrógenos al mismo ritmo que el radical fenilo. Sin embargo, el estado singlete está más estabilizado que el triplete y, por lo tanto, parte de la energía estabilizadora se perderá para formar el estado de transición para la escisión del hidrógeno, lo que lleva a una extracción de hidrógeno más lenta. Chen propuso el uso de análogos de 1,4-dideshidrobenceno que tienen grandes brechas de energía singlete-triplete para mejorar la selectividad de los candidatos a fármacos enediinos. [35]
La primera evidencia de arines provino del trabajo de Stoermer y Kahlert. En 1902 observaron que tras el tratamiento del 3-bromobenzofurano con una base en etanol se formaba 2-etoxibenzofurano. Basándose en esta observación, postularon un intermedio arino. [36]

Wittig y cols. invocó el intermediario zwitteriónico en la reacción de fluorobenceno y fenillitio para dar bifenilo. [37] [38] [39] Esta hipótesis fue confirmada más tarde. [40] [41] [42] [43] [44]

En 1953, los experimentos de etiquetado con 14 C proporcionaron un fuerte apoyo a la intermediación del benceno. [40] John D. Roberts y otros. demostró que la reacción de clorobenceno-1-14 C y amida de potasio daba cantidades iguales de anilina con incorporación de 14 C en C-1 y C-2.

Wittig y Pohmer descubrieron que el benceno participa en reacciones de cicloadición [4+2]. [45]
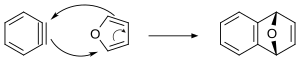
La evidencia adicional de la existencia de benceno provino de estudios espectroscópicos. [3] Se ha observado benceno en un "contenedor molecular". [46]
En 2015, STM tomó imágenes de una sola molécula de arino . [47]
Los 1,3-didehidroarenos se demostraron por primera vez en la década de 1990 cuando se generaron a partir de derivados de benceno 1,3- disustituidos , como el peroxiéster 1,3-C6H4 ( O2C ( O) CH3 ) 2 . [3]
Los avances en el 1,4-dideshidrobenceno se produjeron en la década de 1960, a raíz de estudios sobre la ciclación de Bergman . [32] Este tema se volvió actual con el descubrimiento de los "citostáticos" enediinos, como la caliqueamicina , que genera un 1,4-dideshidrobenceno. [48]
Se han preparado diversos productos naturales utilizando arinos como intermediarios. [14] Las adiciones nucleofílicas a arinos se han utilizado ampliamente en la síntesis total de productos naturales. De hecho, las adiciones nucleofílicas de arinos son algunas de las aplicaciones más antiguas conocidas de la química de los arinos. [14] La adición nucleofílica a arino se utilizó en el intento de síntesis de criptoaustolina (1) y criptowolina (2). [49]

La síntesis del meroterpenoide tetracíclico (+)-lifagal implicó un intermedio arino. [50] Su enfoque empleó una ciclación de arino para cerrar el anillo final del producto natural. [14]

Las reacciones multicomponente de arinos son transformaciones poderosas que permiten la rápida formación de arenos 1,2-disustituidos. A pesar de su utilidad potencial, los ejemplos de reacciones arinas multicomponentes en la síntesis de productos naturales son escasos. [14] Se empleó una reacción de acoplamiento de arino de cuatro componentes en la síntesis de deshidroaltenueno B. [51]

{{cite book}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace )