En química orgánica , la reacción hexadehidro-Diels-Alder ( HDDA ) es una reacción química orgánica entre un diino (2 grupos funcionales alquino dispuestos en un sistema conjugado ) y un alquino para formar una especie reactiva de benceno , a través de un [4+2] reacción de cicloadición . [1] [2] [3] Este intermediario bencino luego reacciona con un agente atrapador adecuado para formar un producto aromático sustituido . Esta reacción es un derivado de la reacción de Diels-Alder establecida y se desarrolla mediante un mecanismo de cicloadición [4+2] similar. La reacción HDDA es particularmente eficaz para formar sistemas aromáticos fuertemente funcionalizados y sistemas de anillos múltiples en un solo paso sintético.

Dependiendo del sustrato elegido, la reacción HDDA puede iniciarse térmicamente o mediante la adición de un catalizador adecuado , a menudo un metal de transición . [1] [2] [4] [5] El mecanismo predominante para la reacción HDDA iniciada térmicamente es una cicloadición [4+2] entre un diino conjugado (1,3-dialquino) y un alquino (a menudo denominado diinófilo en analogía con el dienófilo de Diels-Alder ) para formar una especie ortobencina . [1] [2] Se cree que el HDDA catalizado por metal procede a través de una vía similar, formando un bencino estabilizado por metal, que luego queda atrapado.
El modelo más simple de una reacción HDDA es la cicloadición de butadiino y acetileno para formar ortobencino (o-bencino, como se muestra a continuación). [6] Este intermedio reactivo (indicado entre paréntesis) reacciona posteriormente con un reactivo de captura generalizado que consta de un sitio nucleofílico (Nu-) y electrofílico (El-), dando el producto bencenoide que se muestra.
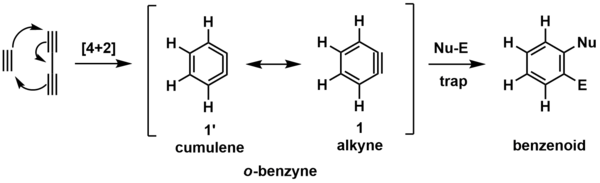
El intermedio o-bencino se puede visualizar en las dos formas de resonancia (química) ilustradas arriba. La forma más comúnmente representada es el alquino ( 1 ), pero la forma cumuleno ( 1' ) puede ser útil para visualizar la formación del anillo mediante cicloadición [4+2].
La reacción HDDA suele ser termodinámicamente favorable ( exotérmica ), pero puede tener una barrera cinética significativa para la reacción (alta energía de activación ). Los cálculos han sugerido que la formación de o-bencino no sustituido (a partir de butadiino y acetileno, arriba) tiene una energía de activación de 36 kcal mol −1 , pero es termodinámicamente favorable y se estima que es exotérmica en -51 kcal mol −1 . [6] Como resultado de una mayor energía de activación, algunas reacciones HDDA requieren calentamiento a temperaturas elevadas (>100 °C) para iniciarse. [1] [2]
Además, el paso de captura de benceno también es termodinámicamente favorable, calculado en -73 kcal mol −1 adicionales para atrapar un o-bencino sustituido con éster con terc-butanol . [1]

La cicloadición HDDA [4+2] puede ocurrir mediante una vía concertada o una reacción escalonada , vía diradical. Estas dos vías pueden diferir en la energía de activación según el sustrato y el sistema de reacción. Los estudios computacionales han sugerido que, si bien ambas vías son comparables en energía de activación para diinófilos no activados (no sustituidos), la vía escalonada tiene una barrera de energía de activación más baja, al igual que la vía dominante, para los diinófilos activados. [6] [7]
La regioquímica de la captura de benceno no simétrica derivada de HDDA puede explicarse mediante una combinación de efectos de distorsión electrónica y de anillo. [1] Computacionalmente, el ángulo más obtuso ( a ) corresponde al carbono bencino más deficiente en electrones (δ+), lo que lleva al ataque del componente nucleofílico en este sitio. En consecuencia, el componente electrófilo se agrega en el sitio (δ-) más rico en electrones ( b ).

La reacción HDDA es un derivado de la reacción clásica de Diels-Alder y está relacionada mecánicamente con ella. Como lo describen Hoye y sus colaboradores, la reacción HDDA puede verse conceptualmente como un miembro de una serie de reacciones pericíclicas con insaturación creciente (mediante la eliminación incremental de pares de hidrógeno ). [1] El descriptor “hexadehidro” se deriva de esta interpretación, ya que el producto de reacción HDDA más simple (o-bencino, 4 hidrógenos) tiene 6 átomos de hidrógeno menos que el producto de reacción de Diels-Alder más simple ( ciclohexeno , 10 hidrógenos).

Formalmente, la reacción hexadehidro Diels-Alder describe solo la formación del benceno, pero esta especie es un intermedio inestable que reacciona fácilmente con una variedad de compañeros de captura, incluidos los solventes de reacción . Por lo tanto, en la práctica, la reacción HDDA describe una reacción en cascada de dos pasos de formación de benceno y captura para producir el producto final.
Los primeros ejemplos de la reacción HDDA fueron reportados de forma independiente en 1997 por los grupos de Ueda y Johnson. [2] [8] [9] [10] Johnson y sus colaboradores observaron la ciclación de 1,3,8-nonatriino bajo termólisis instantánea al vacío (600 °C, 10 −2 torr) para formar dos productos, indano y el Producto de deshidrogenación indeno , con un rendimiento combinado del 95%. Los estudios de etiquetado de deuterio sugirieron que el producto se formó mediante una cicloadición [4+2] a un intermediario bencino, seguida de una reducción in situ para formar los productos observados. [8] Ueda y sus colaboradores observaron que los tetrainos acíclicos se ciclaban a temperatura ambiente para formar derivados de 5H-fluorenol. La formación de un intermedio de benceno se determinó mediante estudios de captura, utilizando benceno o antraceno para atrapar el benceno como un aducto de Diels-Alder. [10] Ueda y sus colaboradores desarrollaron más a fondo este método en informes posteriores, atrapando el bencino utilizando una variedad de nucleófilos (a base de oxígeno, nitrógeno y azufre), así como sintetizando sistemas aromáticos de anillos fusionados más grandes. [11] [12] [13] [14] [15]
Si bien se conoce desde hace más de una década, la reacción HDDA no tuvo un uso sintético más amplio hasta 2012, cuando Hoye y sus colaboradores llevaron a cabo una investigación exhaustiva sobre el alcance y la utilidad de esta cicloadición. [1] Ese artículo se refirió a esta reacción diino-diinofílica como la “reacción hexadehidro Diels-Alder (HDDA) , y desde entonces esta terminología se ha vuelto de uso más generalizado. Desde 2012, la reacción HDDA ha sido un área de renovado interés y ha atraído más estudios por parte de varios grupos de investigación. [4] [5] [7] [16]
Una de las principales ventajas de la reacción HDDA sobre otros métodos de acceso a bencinos es la simplicidad del sistema de reacción. La reacción HDDA de triinos o tetrainos forma bencinos sin la formación directa de subproductos. En comparación, la formación de bencino mediante la eliminación de sustituyentes orto en arenos da como resultado cantidades estequiométricas de subproductos de esos sustituyentes. Por ejemplo, la formación de benceno a partir de 1 mol de trifluorometanosulfonato ( triflato ) de 2-trimetilsililfenilo produce 1 mol de fluoruro de trimetilsililo y 1 mol de ion triflato. Los subproductos pueden competir con otros reactivos para atrapar benceno, provocar reacciones secundarias y pueden requerir una purificación adicional.
Además, la reacción HDDA puede ser útil para sustratos con funcionalidad sensible que podrían no ser toleradas por otras condiciones de formación de benceno (por ejemplo, base fuerte). Se ha demostrado que la reacción HDDA iniciada térmicamente tolera ésteres , cetonas , amidas protegidas , éteres , aminas protegidas , haluros de arilo , haluros de alquilo , alquenos y ciclopropanos . [1] [4] [17]
La reacción HDDA puede cumplir varios principios de la química verde .
La reacción HDDA se puede utilizar para sintetizar sistemas de anillos multicíclicos a partir de precursores lineales que contienen el grupo diino, diinófilo y atrapador. Por ejemplo, Hoye y sus colaboradores pudieron sintetizar sistemas de anillos tricíclicos fusionados a partir de precursores de triinos lineales en un solo paso y con altos rendimientos mediante una reacción HDDA intramolecular iniciada térmicamente. [1] Además, se podrían incorporar heterociclos que contienen nitrógeno y oxígeno mediante el uso de un precursor apropiado. En este caso, el éter ililico colgante proporcionó el grupo de captura, a través de un reordenamiento retro-Brook .
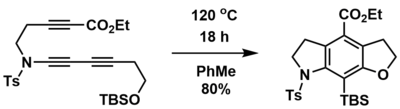
Los bencinos generados por HDDA también pueden quedar atrapados intermolecularmente mediante una variedad de reactivos de captura. La elección cuidadosa del reactivo de captura puede agregar funcionalidad adicional, incluidos haluros de arilo, heteroátomos de arilo ( fenoles y derivados de anilina ) y sistemas de anillos múltiples. [1] [18]

La reacción HDDA se puede utilizar en una secuencia de reacción en cascada con reacciones eno , como la reacción eno de Alder y la reacción eno aromático. [16] [19] El benceno generado por HDDA puede quedar atrapado con un donante de eno adecuado que esté unido covalentemente al benceno. El bencino actúa como enófilo, mientras que el eno puede ser un alqueno (eno de aliso) o un anillo aromático (eno aromático). Lee y sus compañeros de trabajo han demostrado una reacción en cascada de eno HDDA-Alder que puede producir una variedad de productos, incluidos anillos fusionados de tamaño mediano, espirociclos y alenos . [dieciséis]

Hoye y sus compañeros de trabajo demostraron una cascada triple HDDA-ene aromático-Alder ene iniciada térmicamente que conduce a productos altamente funcionalizados en un solo paso sin reactivos ni subproductos adicionales. [19]

También se ha demostrado que los bencinos derivados de HDDA deshidrogenan alcanos saturados para formar alquenos . [20] En ausencia de reactivos de captura externos, el intermediario bencino puede extraer átomos de hidrógeno vecinales (química) de un donante adecuado, a menudo el disolvente de la reacción (como el tetrahidrofurano o el ciclooctano ). Esto desatura el alcano donante, formando un alqueno y atrapa el bencino en un producto dihidrobencenoide. El etiquetado isotópico y los estudios computacionales sugieren que el mecanismo de doble transferencia de hidrógeno ocurre por una vía concertada y que la velocidad de reacción depende en gran medida de la conformación del alcano donante. [20] Esta reacción se puede utilizar para acceder a anillos aromáticos 1,2,3,4-tetrasustituidos, un patrón de sustitución al que puede ser difícil acceder mediante otra metodología sintética.

La reacción HDDA también se puede utilizar como método de activación de CH , donde un enlace C-H de alcano colgante atrapa un intermedio arino formando un complejo metálico . Lee y sus colaboradores observaron que los catalizadores de metales de transición inducían una reacción HDDA de tetrainos que quedaba atrapada intramolecularmente por un enlace colgante sp 3 CH. [4] Los enlaces CH primarios, secundarios y terciarios fueron todos compañeros de captura reactivos, siendo las sales de plata los catalizadores más eficaces. Los experimentos de marcaje con deuterio sugieren que las reacciones de ruptura del enlace (sp 3 ) CH y de formación del enlace (sp 2 ) CH ocurren de manera concertada.

La reacción HDDA catalizada por plata también se ha utilizado para sintetizar compuestos organofluorados mediante el uso de un contraión que contiene flúor . [17] El intermediario arino complejado con metal puede quedar atrapado por el contraión para producir anillos de arilo con sustituyentes fluoro, trifluorometilo o trifluorometiltiol. Se pueden producir in situ contraiones inestables, como CF 3 − .

Se ha demostrado que un sustrato poliino correctamente diseñado sufre cicloadiciones netas en cascada [4+2] simplemente al calentarse. [21] Esta reacción dominó hexadehidro Diels-Alder se inicia mediante una formación de benceno limitante de la velocidad. Al proceder a través de intermedios de naftina, antracina y/o tetracina, se produce una rápida síntesis ascendente de compuestos aromáticos policíclicos altamente fusionados.

Los nitrilos también pueden participar en las reacciones HDDA para generar intermediarios de piridino. [22] La captura in situ de piridinas da lugar a derivados de piridina altamente sustituidos y funcionalizados, lo que es complementario a otros enfoques clásicos para la construcción de esta importante clase de heterociclos.

Los multi-inos de diseño dispuestos sobre una plantilla central común se someten a múltiples reacciones de cicloisomerización secuenciales para producir compuestos policíclicos arquitectónicamente novedosos en una sola operación. [23] Se puede acceder a diversas topologías de productos, que van desde compuestos aromáticos policíclicos (PAC) altamente fusionados hasta arquitecturas que tienen brazos estructuralmente complejos que adornan fenileno central o núcleos de fenileno expandido.
