En química orgánica , un haluro de arilo (también conocido como haloareno ) es un compuesto aromático en el que uno o más átomos de hidrógeno, unidos directamente a un anillo aromático , son reemplazados por un haluro . Los haloarenos se diferencian de los haloalcanos porque presentan muchas diferencias en los métodos de preparación y propiedades. Los miembros más importantes son los cloruros de arilo, pero la clase de compuestos es tan amplia que existen muchos derivados y aplicaciones.
Los fluoruros de arilo se utilizan como intermediarios sintéticos, por ejemplo, para la preparación de productos farmacéuticos, pesticidas y cristales líquidos. [1] La conversión de sales de diazonio es una ruta bien establecida para obtener fluoruros de arilo. Por tanto, las anilinas son precursoras de los fluoruros de arilo. En la reacción clásica de Schiemann , el tetrafluoroborato es el donante de fluoruro:
En algunos casos se utiliza sal de fluoruro:
Muchos fluoruros de arilo comerciales se producen a partir de cloruros de arilo mediante el proceso Halex . El método se utiliza a menudo para cloruros de arilo que también contienen grupos aceptores de electrones . Es ilustrativa la síntesis de 2-fluoronitrobenceno a partir de 2-nitroclorobenceno : [2]
Los cloruros de arilo son los haluros de arilo producidos comercialmente a mayor escala: 150.000 toneladas/año sólo en Estados Unidos (1994). Los niveles de producción están disminuyendo debido a preocupaciones medioambientales. Los clorobencenos se utilizan principalmente como disolventes. [3]
La halogenación de Friedel-Crafts o "cloración directa" es la principal ruta de síntesis. Los ácidos de Lewis , por ejemplo el cloruro de hierro (III) , catalizan las reacciones. El haluro de arilo producido más abundantemente, el clorobenceno , se produce mediante esta ruta: [4]
La monocloración del benceno va acompañada de la formación de derivados del diclorobenceno . [3] Los arenos con grupos donadores de electrones reaccionan con halógenos incluso en ausencia de ácidos de Lewis. Por ejemplo, los fenoles y las anilinas reaccionan rápidamente con el cloro y el agua con bromo para dar productos multihalogenados. Se encuentran disponibles muchos procedimientos de laboratorio detallados. [5] Para los derivados de alquilbenceno, por ejemplo, tolueno , las posiciones alquilo tienden a halogenarse mediante condiciones de radicales libres , mientras que la halogenación del anillo se favorece en presencia de ácidos de Lewis. [6] En la prueba del bromo se utiliza la decoloración del agua con bromo mediante arenos ricos en electrones .
La oxicloración del benceno ha sido bien investigada, motivada por evitar el HCl como coproducto en la halogenación directa: [3]
Sin embargo, esta tecnología no se utiliza mucho.
La reacción de Gatterman también se puede utilizar para convertir sales de diazonio en clorobencenos utilizando reactivos a base de cobre. Debido al alto coste de las sales de diazonio , este método se reserva para cloruros especiales.
Los principales bromuros de arilo producidos comercialmente son el anhídrido tetrabromoftálico, el éter decabromodifenilo y el tetrabromobisfenol-A . Estos materiales se utilizan como retardantes de llama . Se producen por bromación directa de fenoles y éteres arílicos. El anhídrido ftálico reacciona poco con el bromo, por lo que es necesario el uso de medios ácidos.
La reacción de Gatterman también se puede utilizar para convertir sales de diazonio en bromobencenos utilizando reactivos a base de cobre. Debido al alto costo de las sales de diazonio , este método se reserva para bromuros especiales.
Los yoduros de arilo sintéticos se utilizan como agentes de contraste de rayos X , pero por lo demás estos compuestos no se producen a gran escala. Los yoduros de arilo son sustratos "fáciles" para muchas reacciones, como las de acoplamiento cruzado y la conversión a reactivos de Grignard , pero son mucho más caros que los cloruros y bromuros de arilo, más ligeros y menos reactivos.
Los yoduros de arilo se pueden preparar tratando sales de diazonio con sales de yoduro. [7] Los arenos ricos en electrones, como las anilinas y los derivados dimetoxi, reaccionan directamente con el yodo. [8]
Los reactivos de aril litio y aril Grignard reaccionan con el yodo para dar el haluro de arilo:
Este método es aplicable a la preparación de todos los haluros de arilo. Una limitación es que la mayoría, pero no todos, [9] los reactivos de aril litio y Grignard se producen a partir de haluros de arilo.
Aunque el término haluro de arilo incluye derivados halogenados de cualquier compuesto aromático, comúnmente se refiere a halobencenos, que son específicamente derivados halogenados del benceno . Los grupos de halobencenos incluyen fluorobencenos , clorobencenos , bromobencenos y yodobencenos , así como halobencenos mixtos que contienen al menos dos tipos diferentes de halógenos unidos al mismo anillo de benceno. También existen muchos derivados del halobenceno .
Las halopiridinas se basan en el compuesto aromático piridina . [10] Esto incluye cloropiridinas y bromopiridinas . Las cloropiridinas son intermediarios importantes para los productos farmacéuticos y agroquímicos .
Los naftalenos halogenados se basan en naftaleno . Los naftalenos policlorados se utilizaron ampliamente entre los años 1930 y 1950 en la producción de cables y condensadores, debido a sus propiedades aislantes, hidrofóbicas y retardantes de llama, pero desde entonces se han ido eliminando de este uso debido a la toxicidad, la persistencia ambiental y la introducción de nuevos materiales. . [3]
Las hormonas tiroideas triyodotironina (T 3 ) y tiroxina (T 4 ) son yoduros de arilo. Un tetrayoduro, el T 4 , se biosintetiza mediante yodación electrófila de un derivado de tirosina. [11] La T 4 sintética es uno de los medicamentos más recetados en los EE. UU. [12]
Muchos compuestos aromáticos clorados y bromados son producidos por organismos marinos. Los cloruros y bromuros de las aguas oceánicas son la fuente de los halógenos. Varias enzimas peroxidasas (p. ej., bromoperoxidasa ) catalizan las reacciones. Numerosos son derivados de anillos ricos en electrones que se encuentran en la tirosina, el triptófano y varios pirroles. Algunos de estos haluros de arilo naturales exhiben propiedades medicinales útiles. [13] [14]


Las distancias CX para haluros de arilo siguen la tendencia esperada. Estas distancias para fluorobenceno, clorobenceno, bromobenceno y 4-yodobenzoato de metilo son 135,6(4), 173,90(23), 189,8(1) y 209,9 pm , respectivamente. [15]
A diferencia de los haluros de alquilo típicos, los haluros de arilo normalmente no participan en reacciones de sustitución convencionales. Los haluros de arilo con grupos aceptores de electrones en las posiciones orto y para pueden sufrir reacciones S N Ar . Por ejemplo, el 2,4-dinitroclorobenceno reacciona en una solución básica para dar un fenol.
A diferencia de la mayoría de las otras reacciones de sustitución, el fluoruro es el mejor grupo saliente y el yoduro el peor. [16] Un artículo de 2018 indica que esta situación en realidad puede ser bastante común y ocurrir en sistemas que anteriormente se suponía que procedían a través de mecanismos S N Ar. [17]
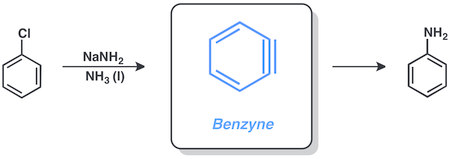
Los haluros de arilo a menudo reaccionan mediante la intermediación de bencinos . El clorobenceno y la amida de sodio reaccionan en amoníaco líquido para dar anilina por esta vía.
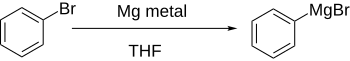
Los haluros de arilo reaccionan con metales, generalmente litio o magnesio , para dar derivados organometálicos que funcionan como fuentes de aniones de arilo. Mediante la reacción de intercambio metal-halógeno , los haluros de arilo se convierten en compuestos de aril litio. Es ilustrativa la preparación de fenillitio a partir de bromobenceno utilizando n -butillitio ( n -BuLi):
La formación directa de reactivos de Grignard , añadiendo magnesio al haluro de arilo en una solución etérea, funciona bien si el anillo aromático no se desactiva significativamente mediante grupos aceptores de electrones.
Los haluros pueden ser desplazados por nucleófilos fuertes mediante reacciones que involucran aniones radicales. Alternativamente, los haluros de arilo, especialmente los bromuros y yoduros, sufren adición oxidativa y, por lo tanto, están sujetos a reacciones de tipo aminación de Buchwald-Hartwig .
El clorobenceno fue alguna vez el precursor del fenol , que ahora se produce por oxidación del cumeno . A altas temperaturas, los grupos arilo reaccionan con el amoníaco para dar anilinas. [3]
Rhodococcus phenolicus es una bacteria que degrada el diclorobenceno como única fuente de carbono. [18]
Los haluros de arilo producidos a mayor escala son el clorobenceno y los isómeros del diclorobenceno. Una aplicación importante, pero descontinuada, fue el uso de clorobenceno como solvente para dispersar el herbicida Lasso. En general, la producción de cloruros de arilo (también derivados de naftilo) ha ido disminuyendo desde la década de 1980, en parte debido a preocupaciones ambientales. [3] La trifenilfosfina se produce a partir de clorobenceno:
Los bromuros de arilo se utilizan ampliamente como retardantes de fuego. El miembro más destacado es el tetrabromobisfenol-A , que se prepara mediante bromación directa del difenol. [19]