
En química orgánica , un aldehído ( / ˈældɪhaɪd / ) es un compuesto orgánico que contiene un grupo funcional con la estructura R−CH=O . [ 1 ] El grupo funcional en sí (sin la cadena lateral "R" ) puede denominarse aldehído , pero también puede clasificarse como un grupo formilo . Los aldehídos son un motivo común en muchos productos químicos importantes en tecnología y biología. [2] [3]
Las moléculas de aldehído tienen un átomo de carbono central que está conectado por un doble enlace al oxígeno, un enlace simple al hidrógeno y otro enlace simple a un tercer sustituyente, que es el carbono o, en el caso del formaldehído, el hidrógeno. El carbono central se describe a menudo como hibridado sp 2 . El grupo aldehído es algo polar . La longitud del enlace C=O es de unos 120–122 picómetros . [4]
Los aldehídos tienen propiedades diversas que dependen del resto de la molécula. Los aldehídos más pequeños son más solubles en agua, el formaldehído y el acetaldehído lo son por completo. Los aldehídos volátiles tienen olores penetrantes.
Los aldehídos se pueden identificar mediante métodos espectroscópicos. Mediante espectroscopia IR , muestran una fuerte banda ν CO cerca de 1700 cm −1 . En sus espectros de RMN 1 H , el centro de hidrógeno formilo absorbe cerca de δ H 9,5 a 10, que es una parte distintiva del espectro. Esta señal muestra el acoplamiento característico a cualquier protón en el carbono α con una constante de acoplamiento pequeña, típicamente menor a 3,0 Hz. Los espectros de RMN 13 C de aldehídos y cetonas dan una señal suprimida (débil) pero distintiva en δ C 190 a 205.
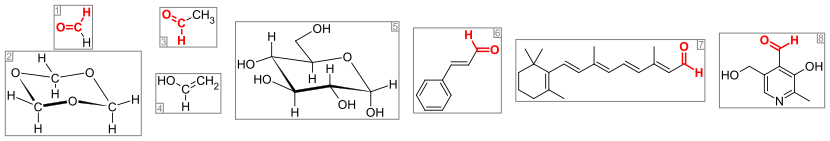
Aldehídos importantes y compuestos relacionados. El grupo aldehído (o grupo formilo ) está coloreado en rojo. De izquierda a derecha: (1) formaldehído y (2) su trímero 1,3,5-trioxano , (3) acetaldehído y (4) su enol alcohol vinílico , (5) glucosa (forma de piranosa como α- D -glucopiranosa), (6) el aromatizante cinamaldehído , (7) retinal , que se forma con los fotorreceptores de las opsinas , y (8) la vitamina piridoxal .
En los aceites esenciales se encuentran trazas de muchos aldehídos que a menudo contribuyen a sus olores favorables, por ejemplo, el cinamaldehído , el cilantro y la vainillina . Posiblemente debido a la alta reactividad del grupo formilo, los aldehídos no son comunes en varios de los componentes básicos naturales: aminoácidos, ácidos nucleicos, lípidos. Sin embargo, la mayoría de los azúcares son derivados de los aldehídos. Estas aldosas existen como hemiacetales , una especie de forma enmascarada del aldehído original. Por ejemplo, en solución acuosa solo existe una pequeña fracción de glucosa como aldehído.
Existen varios métodos para preparar aldehídos, [2] pero la tecnología dominante es la hidroformilación . [5] Un ejemplo ilustrativo es la generación de butiraldehído por hidroformilación de propeno :
Los aldehídos se generan comúnmente por oxidación de alcoholes . La industria oxida el metanol a formaldehído a gran escala, [6] y, en el proceso Wacker , el etileno a acetaldehído en presencia de catalizadores de cobre y paladio (el acetaldehído también se produce a gran escala por hidratación del acetileno). El oxígeno " verde " y barato es el oxidante de elección. Para sustratos sensibles, la oxidación por transferencia de Oppenauer evita la sobreoxidación a un ácido carboxílico . Cuando una mezcla de productos puede ser aceptable, la hidroformilación agrega directamente un carbonilo a una olefina . [ cita requerida ]
En cambio, los laboratorios pueden aplicar una amplia variedad de agentes oxidantes especializados ; los reactivos de cromo (VI) son populares . La oxidación se puede lograr calentando el alcohol con una solución acidificada de dicromato de potasio . En este caso, el exceso de dicromato oxidará aún más el aldehído a un ácido carboxílico , por lo que el aldehído se destila a medida que se forma (si es volátil ) o se utilizan reactivos más suaves como el PCC . [7]
Una variedad de sistemas de reactivos logran aldehídos en condiciones libres de cromo. Uno de ellos son los compuestos organoyodados hipervalentes (es decir, ácido IBX , peryodinano de Dess-Martin ), aunque estos a menudo también oxidan la posición α . Un ácido Lux-Flood activará otros sustratos preoxidados: varios sulfóxidos (por ejemplo, la oxidación de Swern ) u óxidos de amina (por ejemplo, la oxidación de Ganem ). Los nitroxilos estéricamente impedidos (es decir, TEMPO ) pueden catalizar la formación de aldehído con un oxidante más económico .
Alternativamente, los dioles vecinales o sus secuelas oxidadas ( aciloínas o α-hidroxiácidos ) se pueden oxidar con escisión a dos aldehídos o un aldehído y dióxido de carbono . [8] [9]
Los aldehídos participan en muchas reacciones. [2] Desde la perspectiva industrial, las reacciones importantes son:
Debido a la estabilización por resonancia de la base conjugada, un α-hidrógeno en un aldehído es débilmente ácido con un p K a cercano a 17. Sin embargo, tenga en cuenta que esto es mucho más ácido que un alcano o un éter hidrógeno, que tiene un p K a cercano a 50 aproximadamente, y es incluso más ácido que un α-hidrógeno de cetona que tiene un p K a cercano a 20. Esta acidificación del α-hidrógeno en el aldehído se atribuye a:
El propio protón formilo no sufre fácilmente desprotonación.
Los aldehídos (excepto aquellos sin un carbono alfa, o sin protones en el carbono alfa, como el formaldehído y el benzaldehído) pueden existir tanto en el tautómero ceto como en el enol . El tautomerismo ceto-enólico es catalizado por un ácido o una base. En solución neutra, el enol es el tautómero minoritario, invirtiéndose varias veces por segundo. [14] Pero se convierte en el tautómero dominante en soluciones de ácidos o bases fuertes, y los aldehídos enolizados sufren un ataque nucleofílico en la posición α . [15] [16]
El grupo formilo se puede reducir fácilmente a un alcohol primario ( −CH2OH ). Normalmente, esta conversión se logra mediante hidrogenación catalítica, ya sea directamente o mediante hidrogenación por transferencia . Las reducciones estequiométricas también son populares, como se puede lograr con borohidruro de sodio .
El grupo formilo se oxida fácilmente al grupo carboxilo correspondiente ( −COOH ). El oxidante preferido en la industria es el oxígeno o el aire. En el laboratorio, los agentes oxidantes populares incluyen permanganato de potasio , ácido nítrico , óxido de cromo (VI) y ácido crómico . La combinación de dióxido de manganeso , cianuro , ácido acético y metanol convertirá el aldehído en un éster metílico . [2]
Otra reacción de oxidación es la base de la prueba del espejo de plata . En esta prueba, un aldehído se trata con el reactivo de Tollens , que se prepara añadiendo una gota de solución de hidróxido de sodio a una solución de nitrato de plata para dar un precipitado de óxido de plata (I), y luego añadiendo suficiente solución de amoníaco diluido para redisolver el precipitado en amoníaco acuoso para producir el complejo [Ag(NH 3 ) 2 ] + . Este reactivo convierte los aldehídos en ácidos carboxílicos sin atacar los dobles enlaces carbono-carbono. El nombre de prueba del espejo de plata surge porque esta reacción produce un precipitado de plata, cuya presencia se puede utilizar para comprobar la presencia de un aldehído.
Otra reacción de oxidación utiliza el reactivo de Fehling como prueba. Los iones complejos Cu 2+ se reducen a un precipitado de Cu 2 O de color rojo ladrillo .
Si el aldehído no puede formar un enolato (por ejemplo, benzaldehído ), la adición de una base fuerte induce la reacción de Cannizzaro . Esta reacción da como resultado una desproporción , lo que produce una mezcla de alcohol y ácido carboxílico.
Los nucleófilos se agregan fácilmente al grupo carbonilo. En el producto, el carbono carbonílico se hibrida sp3 , quedando unido al nucleófilo, y el centro de oxígeno se protona:
En muchos casos, se elimina una molécula de agua después de que se produce la adición; en este caso, la reacción se clasifica como una reacción de adición - eliminación o de adición - condensación . Existen muchas variaciones de reacciones de adición nucleofílica.
En la reacción de acetalización , en condiciones ácidas o básicas , un alcohol se añade al grupo carbonilo y se transfiere un protón para formar un hemiacetal . En condiciones ácidas , el hemiacetal y el alcohol pueden reaccionar aún más para formar un acetal y agua. Los hemiacetales simples suelen ser inestables, aunque los cíclicos, como la glucosa, pueden ser estables. Los acetales son estables, pero se transforman en aldehído en presencia de ácido. Los aldehídos pueden reaccionar con agua para formar hidratos , R−CH(OH) 2 . Estos dioles son estables cuando están presentes grupos fuertes que atraen electrones , como en el hidrato de cloral . El mecanismo de formación es idéntico a la formación de hemiacetales.
En la bisustitución de alquilimino-de-oxo , una amina primaria o secundaria se añade al grupo carbonilo y se transfiere un protón del átomo de nitrógeno al átomo de oxígeno para crear una carbinolamina . En el caso de una amina primaria, se puede eliminar una molécula de agua del intermedio de carbinolamina para producir una imina o su trímero, una hexahidrotriazina. Esta reacción es catalizada por ácido. La hidroxilamina ( NH2OH ) también se puede añadir al grupo carbonilo. Después de la eliminación del agua, esto da como resultado una oxima. Un derivado de amoníaco de la forma H2NNR2 como la hidrazina (H2NNH2 ) o la 2,4 - dinitrofenilhidrazina también puede ser el nucleófilo y después de la eliminación del agua, dar como resultado la formación de una hidrazona , que suelen ser sólidos cristalinos de color naranja. Esta reacción forma la base de una prueba para aldehídos y cetonas . [17]
El grupo ciano en HCN puede agregarse al grupo carbonilo para formar cianhidrinas , R−CH(OH)CN . En esta reacción, el ion CN − es el nucleófilo que ataca al átomo de carbono parcialmente positivo del grupo carbonilo . El mecanismo implica que un par de electrones del doble enlace del grupo carbonilo se transfieren al átomo de oxígeno, dejándolo unido por un enlace simple al carbono y dándole al átomo de oxígeno una carga negativa. Este ion intermedio reacciona rápidamente con H + , como el de la molécula de HCN, para formar el grupo alcohol de la cianhidrina.
Los compuestos organometálicos , como los reactivos de organolitio , los reactivos de Grignard o los acetiluros , experimentan reacciones de adición nucleofílica , que dan lugar a un grupo alcohol sustituido. Entre las reacciones relacionadas se encuentran las adiciones de organoestannano , las reacciones de Barbier y la reacción de Nozaki-Hiyama-Kishi .
En la reacción aldólica , los enolatos metálicos de cetonas , ésteres , amidas y ácidos carboxílicos se suman a los aldehídos para formar compuestos β-hidroxicarbonílicos ( aldoles ). La deshidratación catalizada por ácidos o bases conduce a la formación de compuestos carbonílicos α,β-insaturados. La combinación de estos dos pasos se conoce como condensación aldólica .
La reacción de Prins ocurre cuando un alqueno o alquino nucleófilo reacciona con un aldehído como electrófilo. El producto de la reacción de Prins varía según las condiciones de reacción y los sustratos empleados.
Los aldehídos forman característicamente "compuestos de adición" con bisulfitos :
Esta reacción se utiliza como prueba de aldehídos y es útil para la separación o purificación de aldehídos. [17] [18]
Un dialdehído es un compuesto químico orgánico con dos grupos aldehído. La nomenclatura de los dialdehídos tiene la terminación -dial o, a veces, -dialdehído . Los dialdehídos alifáticos cortos a veces reciben el nombre del diácido del que pueden derivar. Un ejemplo es el butanodial , que también se llama succinaldehído (del ácido succínico ).
Algunos aldehídos son sustratos de las enzimas aldehído deshidrogenasas , que metabolizan los aldehídos en el organismo. Existen toxicidades asociadas con algunos aldehídos que están relacionadas con enfermedades neurodegenerativas , enfermedades cardíacas y algunos tipos de cáncer . [19]
De todos los aldehídos, el formaldehído se produce en mayor escala, aproximadamente6 000 000 de toneladas por año . Se utiliza principalmente en la producción de resinas cuando se combina con urea , melamina y fenol (por ejemplo, baquelita ). Es un precursor del diisocianato de metileno difenilo ("MDI"), un precursor de los poliuretanos . [6] El segundo aldehído principal es el butiraldehído , del cual aproximadamenteSe preparan 2 500 000 toneladas por año mediante hidroformilación . Es el principal precursor del 2-etilhexanol , que se utiliza como plastificante . [20] El acetaldehído alguna vez fue un producto dominante, pero los niveles de producción han disminuido a menos de1 000 000 de toneladas por año porque sirvió principalmente como precursor del ácido acético , que ahora se prepara por carbonilación del metanol . Muchos otros aldehídos encuentran aplicaciones comerciales, a menudo como precursores de alcoholes, los llamados oxoalcoholes , que se utilizan en detergentes. Algunos aldehídos se producen solo en pequeña escala (menos de 1000 toneladas por año) y se utilizan como ingredientes en sabores y perfumes como Chanel No. 5. Estos incluyen el cinamaldehído y sus derivados, citral y lilial .
Los nombres comunes de los aldehídos no siguen estrictamente las pautas oficiales, como las recomendadas por la IUPAC , pero estas reglas son útiles. La IUPAC prescribe la siguiente nomenclatura para los aldehídos: [21] [22] [23]
La palabra aldehído fue acuñada por Justus von Liebig como una contracción del latín al cohol dehyd rogenatus (alcohol deshidrogenado). [24] [25] En el pasado, los aldehídos a veces recibían el nombre de los alcoholes correspondientes , por ejemplo, aldehído vinoso para acetaldehído . ( Vinoso viene del latín vinum "vino", la fuente tradicional de etanol , cognado con vinilo ).
El término grupo formilo se deriva de la palabra latina formica "hormiga". Esta palabra se puede reconocer en el aldehído más simple, formaldehído , y en el ácido carboxílico más simple, ácido fórmico .