
La contracción muscular es la activación de los sitios generadores de tensión dentro de las células musculares . [1] [2] En fisiología , la contracción muscular no significa necesariamente acortamiento muscular porque la tensión muscular se puede producir sin cambios en la longitud muscular, como cuando se sostiene algo pesado en la misma posición. [1] La terminación de la contracción muscular es seguida por la relajación muscular , que es un retorno de las fibras musculares a su estado de baja generación de tensión. [1]
Para que se produzcan las contracciones, las células musculares deben depender del cambio de acción de dos tipos de filamentos : filamentos finos y filamentos gruesos.
El componente principal de los filamentos delgados es una cadena formada por el enrollamiento helicoidal de dos hebras de actina , y los filamentos gruesos consisten predominantemente en cadenas de la proteína motora miosina . Juntos, estos dos filamentos forman miofibrillas, los orgánulos funcionales básicos del sistema muscular esquelético.
En los vertebrados , las contracciones del músculo esquelético son neurogénicas , ya que requieren la entrada sináptica de las neuronas motoras . Una sola neurona motora puede inervar múltiples fibras musculares, lo que hace que las fibras se contraigan al mismo tiempo. Una vez inervados, los filamentos de proteína dentro de cada fibra muscular esquelética se deslizan uno sobre el otro para producir una contracción, lo que se explica por la teoría del filamento deslizante . La contracción producida puede describirse como un espasmo, una suma o un tétanos, según la frecuencia de los potenciales de acción . En los músculos esqueléticos, la tensión muscular es máxima cuando el músculo se estira a una longitud intermedia, como se describe por la relación longitud-tensión.
A diferencia del músculo esquelético, las contracciones de los músculos liso y cardíaco son miogénicas (es decir, son iniciadas por las propias células del músculo liso o cardíaco en lugar de ser estimuladas por un evento externo como la estimulación nerviosa), aunque pueden ser moduladas por estímulos del sistema nervioso autónomo . Los mecanismos de contracción en estos tejidos musculares son similares a los de los tejidos del músculo esquelético.
La contracción muscular también se puede describir en términos de dos variables: longitud y tensión. [1] En los movimientos naturales que subyacen a la actividad locomotora , las contracciones musculares son multifacéticas, ya que pueden producir cambios en la longitud y la tensión de manera variable en el tiempo. [3] Por lo tanto, es probable que ni la longitud ni la tensión permanezcan iguales en los músculos esqueléticos que se contraen durante la locomoción. Las contracciones se pueden describir como isométricas si la tensión muscular cambia pero la longitud muscular permanece igual. [1] [4] [5] [6] Por el contrario, una contracción muscular se describe como isotónica si la tensión muscular permanece igual durante toda la contracción. [1] [4] [5] [6] Si la longitud del músculo se acorta, la contracción es concéntrica; [1] [7] si la longitud del músculo se alarga, la contracción es excéntrica.

Las contracciones musculares se pueden describir en función de dos variables: fuerza y longitud. La fuerza en sí puede diferenciarse como tensión o carga. La tensión muscular es la fuerza ejercida por el músculo sobre un objeto, mientras que una carga es la fuerza ejercida por un objeto sobre el músculo. [1] Cuando la tensión muscular cambia sin cambios correspondientes en la longitud del músculo, la contracción muscular se describe como isométrica. [1] [4] [5] [6] Si la longitud del músculo cambia mientras la tensión muscular permanece igual, entonces la contracción muscular es isotónica. [1] [4] [5] [6] En una contracción isotónica, la longitud del músculo puede acortarse para producir una contracción concéntrica o alargarse para producir una contracción excéntrica. [1] [7] En los movimientos naturales que subyacen a la actividad locomotora, las contracciones musculares son multifacéticas, ya que pueden producir cambios en la longitud y la tensión de manera variable en el tiempo. [3] Por lo tanto, es poco probable que ni la longitud ni la tensión permanezcan constantes cuando el músculo está activo durante la actividad locomotora.
Una contracción isométrica de un músculo genera tensión sin cambiar la longitud. [1] [4] [5] [6] Un ejemplo se puede encontrar cuando los músculos de la mano y el antebrazo agarran un objeto; las articulaciones de la mano no se mueven, pero los músculos generan suficiente fuerza para evitar que el objeto se caiga.
En la contracción isotónica , la tensión en el músculo permanece constante a pesar de un cambio en la longitud del músculo. [1] [4] [5] [6] Esto ocurre cuando la fuerza de contracción de un músculo coincide con la carga total sobre el músculo.
En la contracción concéntrica, la tensión muscular es suficiente para superar la carga y el músculo se acorta a medida que se contrae. [8] Esto ocurre cuando la fuerza generada por el músculo excede la carga que se opone a su contracción.
Durante una contracción concéntrica, un músculo es estimulado a contraerse según la teoría del filamento deslizante . Esto ocurre en toda la longitud del músculo, generando una fuerza en el origen y la inserción, haciendo que el músculo se acorte y cambie el ángulo de la articulación. En relación con el codo , una contracción concéntrica del bíceps haría que el brazo se doblara en el codo a medida que la mano se movía desde la pierna hasta el hombro (un curl de bíceps ). Una contracción concéntrica del tríceps cambiaría el ángulo de la articulación en la dirección opuesta, enderezando el brazo y moviendo la mano hacia la pierna.
En la contracción excéntrica, la tensión generada durante la isometría es insuficiente para superar la carga externa sobre el músculo y las fibras musculares se alargan a medida que se contraen. [9] En lugar de trabajar para tirar de una articulación en la dirección de la contracción muscular, el músculo actúa para desacelerar la articulación al final de un movimiento o controlar de otro modo el reposicionamiento de una carga. Esto puede ocurrir de forma involuntaria (p. ej., al intentar mover un peso demasiado pesado para que el músculo lo levante) o de forma voluntaria (p. ej., cuando el músculo está "suavizando" un movimiento o resistiendo la gravedad, como al caminar cuesta abajo). A corto plazo, el entrenamiento de fuerza que implica contracciones tanto excéntricas como concéntricas parece aumentar la fuerza muscular más que el entrenamiento con contracciones concéntricas únicamente. [10] Sin embargo, el daño muscular inducido por el ejercicio también es mayor durante las contracciones de alargamiento. [11]
Durante una contracción excéntrica del músculo bíceps , el codo inicia el movimiento mientras está doblado y luego se endereza a medida que la mano se aleja del hombro . Durante una contracción excéntrica del músculo tríceps , el codo inicia el movimiento recto y luego se dobla a medida que la mano se mueve hacia el hombro. La desmina , la titina y otras proteínas de la línea z están involucradas en las contracciones excéntricas, pero su mecanismo es poco conocido en comparación con el ciclo de puente cruzado en las contracciones concéntricas. [9]
Aunque el músculo realiza una cantidad negativa de trabajo mecánico (se realiza trabajo sobre el músculo), se consume energía química (de grasa o glucosa , o almacenada temporalmente en ATP ), aunque menos de la que se consumiría durante una contracción concéntrica de la misma fuerza. Por ejemplo, se gasta más energía subiendo un tramo de escaleras que bajando el mismo tramo.
Los músculos sometidos a una carga excéntrica pesada sufren un mayor daño cuando se sobrecargan (como durante el desarrollo muscular o el ejercicio de entrenamiento de fuerza ) en comparación con la carga concéntrica. Cuando se utilizan contracciones excéntricas en el entrenamiento con pesas, normalmente se las llama negativas . Durante una contracción concéntrica, los miofilamentos musculares contráctiles de miosina y actina se deslizan uno sobre el otro, juntando las líneas Z. Durante una contracción excéntrica, los miofilamentos se deslizan uno sobre el otro en sentido opuesto, aunque no se conoce el movimiento real de las cabezas de miosina durante una contracción excéntrica. El ejercicio que presenta una carga excéntrica pesada en realidad puede soportar un mayor peso (los músculos son aproximadamente un 40% más fuertes durante las contracciones excéntricas que durante las contracciones concéntricas) y también da como resultado un mayor daño muscular y un dolor muscular de aparición tardía uno o dos días después del entrenamiento. El ejercicio que incorpora contracciones musculares excéntricas y concéntricas (es decir, que implica una contracción fuerte y una reducción controlada del peso) puede producir mayores ganancias en fuerza que las contracciones concéntricas solas. [10] [12] Si bien las contracciones excéntricas intensas no habituales pueden conducir fácilmente al sobreentrenamiento , el entrenamiento moderado puede brindar protección contra lesiones. [10]
Las contracciones excéntricas se producen normalmente como una fuerza de frenado en oposición a una contracción concéntrica para proteger las articulaciones de daños. Durante prácticamente cualquier movimiento de rutina, las contracciones excéntricas ayudan a mantener los movimientos suaves, pero también pueden ralentizar los movimientos rápidos, como un puñetazo o un lanzamiento. Parte del entrenamiento para movimientos rápidos, como lanzar durante el béisbol, implica reducir el frenado excéntrico, lo que permite desarrollar una mayor potencia a lo largo del movimiento.
Se están investigando las contracciones excéntricas por su capacidad para acelerar la rehabilitación de tendones débiles o lesionados. Se ha demostrado que la tendinitis aquílea [13] [14] y la tendinitis rotuliana [15] (también conocida como rodilla de saltador o tendinosis rotuliana) se benefician de las contracciones excéntricas de alta carga.

En los animales vertebrados , existen tres tipos de tejido muscular : esquelético, liso y cardíaco. El músculo esquelético constituye la mayor parte de la masa muscular del cuerpo y es responsable de la actividad locomotora. El músculo liso forma los vasos sanguíneos , el tracto gastrointestinal y otras áreas del cuerpo que producen contracciones sostenidas. El músculo cardíaco forma el corazón, que bombea sangre. Los músculos esquelético y cardíaco se denominan músculo estriado debido a su apariencia rayada bajo el microscopio, que se debe al patrón alternado altamente organizado de bandas A y bandas I.
.jpg/440px-1022_Muscle_Fibers_(small).jpg)
Excluyendo los reflejos, todas las contracciones del músculo esquelético ocurren como resultado de señales que se originan en el cerebro. El cerebro envía señales electroquímicas a través del sistema nervioso a la neurona motora que inerva varias fibras musculares. [16] En el caso de algunos reflejos , la señal para contraerse puede originarse en la médula espinal a través de un circuito de retroalimentación con la materia gris. Otras acciones como la locomoción, la respiración y la masticación tienen un aspecto reflejo: las contracciones pueden iniciarse de forma consciente o inconsciente.

Una unión neuromuscular es una sinapsis química formada por el contacto entre una neurona motora y una fibra muscular . [17] Es el sitio en el que una neurona motora transmite una señal a una fibra muscular para iniciar la contracción muscular. La secuencia de eventos que resulta en la despolarización de la fibra muscular en la unión neuromuscular comienza cuando se inicia un potencial de acción en el cuerpo celular de una neurona motora, que luego se propaga por conducción saltatoria a lo largo de su axón hacia la unión neuromuscular. Una vez que alcanza el botón terminal , el potencial de acción provoca una Ca2+
entrada de iones a la terminal a través de los canales de calcio dependientes del voltaje . El Ca2+
La afluencia de sodio hace que las vesículas sinápticas que contienen el neurotransmisor acetilcolina se fusionen con la membrana plasmática, liberando acetilcolina en la hendidura sináptica entre la terminal de la neurona motora y la unión neuromuscular de la fibra muscular esquelética. La acetilcolina se difunde a través de la sinapsis y se une a los receptores nicotínicos de acetilcolina en la unión neuromuscular y los activa . La activación del receptor nicotínico abre su canal intrínseco de sodio / potasio , lo que hace que el sodio entre rápidamente y el potasio salga lentamente. Como resultado, el sarcolema invierte la polaridad y su voltaje salta rápidamente del potencial de membrana en reposo de -90 mV a un máximo de +75 mV cuando entra sodio. Luego, el potencial de membrana se hiperpolariza cuando sale potasio y luego se ajusta nuevamente al potencial de membrana en reposo. Esta fluctuación rápida se denomina potencial de placa terminal. [18] Los canales iónicos dependientes del voltaje del sarcolema, junto a la placa terminal, se abren en respuesta al potencial de la placa terminal. Son específicos del sodio y el potasio y solo permiten el paso de uno. Esta onda de movimientos iónicos crea el potencial de acción que se propaga desde la placa terminal motora en todas las direcciones. [18] Si los potenciales de acción dejan de llegar, la acetilcolina deja de liberarse desde el botón terminal. La acetilcolina restante en la hendidura sináptica es degradada por la acetilcolinesterasa activa o reabsorbida por el botón sináptico y no queda nada para reemplazar la acetilcolina degradada.
El acoplamiento excitación-contracción (ECC) es el proceso por el cual un potencial de acción muscular en la fibra muscular hace que las miofibrillas se contraigan. En los músculos esqueléticos, el acoplamiento excitación-contracción depende de un acoplamiento directo entre dos proteínas clave, el canal de liberación de calcio del retículo sarcoplásmico (SR), identificado como receptor de rianodina 1 (RYR1), y el canal de calcio tipo L dependiente de voltaje, identificado como receptores de dihidropiridina (DHPR). Los DHPR se encuentran en el sarcolema (que incluye el sarcolema superficial y los túbulos transversales ), mientras que los RyR se encuentran a lo largo de la membrana del SR. La aposición cercana de un túbulo transversal y dos regiones del SR que contienen RyR se describe como una tríada y es predominantemente donde tiene lugar el acoplamiento excitación-contracción.

El acoplamiento excitación-contracción (ECC) ocurre cuando la despolarización de los músculos esqueléticos (generalmente a través de la inervación neural) da como resultado un potencial de acción muscular. Este potencial de acción se propaga a través de la superficie del músculo y hacia la red de túbulos T de la fibra muscular , despolarizando la porción interna de la fibra muscular. Esto activa los receptores de dihidropiridina en las cisternas terminales , que están muy cerca de los receptores de rianodina en el retículo sarcoplásmico adyacente . Los receptores de dihidropiridina activados interactúan físicamente con los receptores de rianodina para activarlos a través de procesos de pie (que implican cambios conformacionales que activan alostéricamente los receptores de rianodina). A medida que los receptores de rianodina se abren, el Ca 2+ se libera desde el retículo sarcoplásmico hacia el espacio de unión local y se difunde hacia el citoplasma en masa para causar una chispa de calcio . [19] El potencial de acción crea una activación casi sincrónica de miles de chispas de calcio y provoca un aumento de calcio en toda la célula que da lugar a la subida del transitorio de calcio. El Ca 2+ liberado en el citosol se une a la troponina C por los filamentos de actina . Este enlace permite que los filamentos de actina realicen ciclos de puentes cruzados , produciendo fuerza y, en algunas situaciones, movimiento.
Cuando se logra el movimiento deseado, la relajación se puede lograr rápidamente a través de numerosas vías. La relajación se logra rápidamente a través de un tampón de Ca2 + con varias proteínas citoplasmáticas que se unen al Ca2 + con una afinidad muy alta. [20] Estas proteínas citoplasmáticas permiten una relajación rápida en los músculos de contracción rápida. Aunque más lenta, la ATPasa de calcio del retículo sarcoplásmico (SERCA) bombea activamente Ca2 + de regreso al retículo sarcoplásmico, lo que da como resultado una relajación permanente hasta que llega el siguiente potencial de acción. [19]
Las mitocondrias también participan en la recaptación de Ca2 + , y finalmente entregan el Ca2 + que acumulan a SERCA para almacenarlo en el retículo sarcoplásmico. Algunos de los mecanismos de relajación (NCX, bombas de Ca2+ y canales de fuga de Ca2+) también sacan completamente el Ca2+ de las células. [21] A medida que la concentración de Ca2 + disminuye a niveles de reposo, el Ca2+ se libera de la troponina C, lo que impide el ciclo de puentes cruzados, lo que hace que la fuerza disminuya y se produzca la relajación. Una vez que se ha producido la relajación por completo, el músculo puede contraerse nuevamente, reiniciando así por completo el ciclo.

La teoría de los filamentos deslizantes describe un proceso que utilizan los músculos para contraerse. Es un ciclo de eventos repetitivos que hacen que un filamento delgado se deslice sobre un filamento grueso y genere tensión en el músculo. [22] Fue desarrollada independientemente por Andrew Huxley y Rolf Niedergerke y por Hugh Huxley y Jean Hanson en 1954. [23] [24] Fisiológicamente, esta contracción no es uniforme en todo el sarcómero; la posición central de los filamentos gruesos se vuelve inestable y puede cambiar durante la contracción, pero esto se contrarresta con las acciones del miofilamento elástico de titina . Este miofilamento fino mantiene una tensión uniforme en todo el sarcómero tirando del filamento grueso hacia una posición central. [25]

El ciclo de puentes cruzados es una secuencia de eventos moleculares que sustenta la teoría de filamentos deslizantes. Un puente cruzado es una proyección de miosina, que consta de dos cabezas de miosina, que se extienden desde los filamentos gruesos. [1] Cada cabeza de miosina tiene dos sitios de unión: uno para el trifosfato de adenosina (ATP) y otro para la actina. La unión del ATP a una cabeza de miosina separa la miosina de la actina , lo que permite que la miosina se una a otra molécula de actina. Una vez unido, el ATP es hidrolizado por la miosina, que utiliza la energía liberada para moverse a la "posición de amartillado" por la que se une débilmente a una parte del sitio de unión de la actina. El resto del sitio de unión de la actina está bloqueado por la tropomiosina . [26] Con el ATP hidrolizado, la cabeza de miosina amartillada ahora contiene difosfato de adenosina (ADP) + P i . Dos Ca2+
Los iones se unen a la troponina C en los filamentos de actina. La troponina- Ca2+
El complejo hace que la tropomiosina se deslice y desbloquee el resto del sitio de unión de la actina. Desbloquear el resto de los sitios de unión de la actina permite que las dos cabezas de miosina se cierren y la miosina se una fuertemente a la actina. [26] La cabeza de miosina luego libera el fosfato inorgánico e inicia un golpe de potencia, que genera una fuerza de 2 pN. El golpe de potencia mueve el filamento de actina hacia adentro, acortando así el sarcómero . Luego, la miosina libera ADP, pero aún permanece fuertemente unida a la actina. Al final del golpe de potencia, el ADP se libera de la cabeza de miosina, dejando a la miosina unida a la actina en un estado de rigor hasta que otro ATP se una a la miosina. Una falta de ATP daría como resultado el estado de rigor característico del rigor mortis . Una vez que otro ATP se une a la miosina, la cabeza de miosina se separará nuevamente de la actina y se producirá otro ciclo de puente cruzado.
El ciclo de puente cruzado puede continuar siempre que haya cantidades suficientes de ATP y Ca2+
en el citoplasma. [26] La terminación del ciclo del puente cruzado puede ocurrir cuando Ca2+
se bombea activamente de nuevo al retículo sarcoplásmico. Cuando Ca2+
ya no está presente en el filamento delgado, la tropomiosina cambia su conformación a su estado anterior para bloquear nuevamente los sitios de unión. La miosina deja de unirse al filamento delgado y el músculo se relaja. El Ca2+
Los iones abandonan la molécula de troponina para mantener el Ca2+
Concentración de iones en el sarcoplasma. El bombeo activo de Ca2+
La entrada de iones en el retículo sarcoplásmico crea una deficiencia en el líquido que rodea las miofibrillas, lo que provoca la eliminación de Ca2+
iones de la troponina. De esta manera, el complejo tropomiosina-troponina vuelve a cubrir los sitios de unión de los filamentos de actina y cesa la contracción.
La fuerza de las contracciones del músculo esquelético se puede dividir en general en espasmo , suma y tétanos . Un espasmo es un ciclo único de contracción y relajación producido por un potencial de acción dentro de la propia fibra muscular. [27] El tiempo entre un estímulo al nervio motor y la contracción posterior del músculo inervado se denomina período de latencia , que suele tardar unos 10 ms y es causado por el tiempo que tarda el potencial de acción del nervio en propagarse, el tiempo de transmisión química en la unión neuromuscular y luego los pasos posteriores en el acoplamiento excitación-contracción. [28]
Si se produjera otro potencial de acción muscular antes de la relajación completa de una contracción muscular, entonces la siguiente contracción simplemente se sumaría a la contracción anterior, produciendo así una suma . [29] La suma se puede lograr de dos maneras: [30] suma de frecuencia y suma de múltiples fibras . En la suma de frecuencia , la fuerza ejercida por el músculo esquelético se controla variando la frecuencia a la que se envían los potenciales de acción a las fibras musculares. Los potenciales de acción no llegan a los músculos de forma sincrónica y, durante una contracción, una fracción de las fibras del músculo se activarán en un momento dado. En una circunstancia típica, cuando los humanos están ejercitando sus músculos tan duro como son conscientemente capaces, aproximadamente un tercio de las fibras de cada uno de esos músculos se activarán a la vez [ cita requerida ] , aunque esta proporción puede verse afectada por varios factores fisiológicos y psicológicos (incluidos los órganos tendinosos de Golgi y las células de Renshaw ). Este nivel "bajo" de contracción es un mecanismo de protección para evitar la avulsión del tendón: la fuerza generada por una contracción del 95% de todas las fibras es suficiente para dañar el cuerpo. En la suma de múltiples fibras , si el sistema nervioso central envía una señal débil para contraer un músculo, las unidades motoras más pequeñas , al ser más excitables que las más grandes, son estimuladas primero. A medida que aumenta la fuerza de la señal , se excitan más unidades motoras además de las más grandes, y las unidades motoras más grandes tienen hasta 50 veces la fuerza contráctil que las más pequeñas. A medida que se activan más unidades motoras y más grandes, la fuerza de la contracción muscular se vuelve progresivamente más fuerte. Un concepto conocido como el principio del tamaño, permite que se produzca una gradación de la fuerza muscular durante la contracción débil en pequeños pasos, que luego se vuelven progresivamente más grandes cuando se requieren mayores cantidades de fuerza.
Finalmente, si la frecuencia de los potenciales de acción muscular aumenta de tal manera que la contracción muscular alcanza su fuerza máxima y se estabiliza en este nivel, entonces la contracción es un tétano .

La relación longitud-tensión relaciona la fuerza de una contracción isométrica con la longitud del músculo en el que se produce la contracción. Los músculos funcionan con la mayor tensión activa cuando están cerca de una longitud ideal (a menudo su longitud de reposo). Cuando se estiran o se acortan más allá de esto (ya sea debido a la acción del propio músculo o por una fuerza externa), la tensión activa máxima generada disminuye. [31] Esta disminución es mínima para pequeñas desviaciones, pero la tensión cae rápidamente a medida que la longitud se desvía más del ideal. Debido a la presencia de proteínas elásticas dentro de una célula muscular (como la titina ) y la matriz extracelular, a medida que el músculo se estira más allá de una longitud dada, hay una tensión completamente pasiva, que se opone al alargamiento. Combinados, hay una fuerte resistencia a alargar un músculo activo mucho más allá del pico de tensión activa.
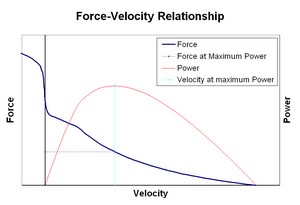
La relación fuerza-velocidad relaciona la velocidad a la que un músculo cambia su longitud (normalmente regulada por fuerzas externas, como la carga u otros músculos) con la cantidad de fuerza que genera. La fuerza disminuye de forma hiperbólica en relación con la fuerza isométrica a medida que aumenta la velocidad de acortamiento, llegando finalmente a cero en una determinada velocidad máxima. Lo contrario es válido cuando el músculo se estira: la fuerza aumenta por encima del máximo isométrico, hasta que finalmente alcanza un máximo absoluto. Esta propiedad intrínseca del tejido muscular activo desempeña un papel en la amortiguación activa de las articulaciones que son accionadas por músculos opuestos activos simultáneamente. En tales casos, el perfil fuerza-velocidad mejora la fuerza producida por el músculo que se alarga a expensas del músculo que se acorta. Este favorecimiento del músculo que devuelve la articulación al equilibrio aumenta efectivamente la amortiguación de la articulación. Además, la fuerza de la amortiguación aumenta con la fuerza muscular. El sistema motor puede así controlar activamente la amortiguación de la articulación a través de la contracción simultánea (co-contracción) de los grupos musculares opuestos. [32]

Los músculos lisos se pueden dividir en dos subgrupos: de una sola unidad y de varias unidades . Las células musculares lisas de una sola unidad se pueden encontrar en el intestino y los vasos sanguíneos. Debido a que estas células están unidas entre sí por uniones en hendidura, pueden contraerse como un sincitio funcional . Las células musculares lisas de una sola unidad se contraen de forma miogénica, lo que puede ser modulado por el sistema nervioso autónomo.
A diferencia de las células musculares lisas unitarias, las células musculares lisas multiunitarias se encuentran en el músculo del ojo y en la base de los folículos pilosos. Las células musculares lisas multiunitarias se contraen al ser estimuladas por separado por los nervios del sistema nervioso autónomo. Como tal, permiten un control fino y respuestas graduales, de manera muy similar al reclutamiento de unidades motoras en el músculo esquelético.
La actividad contráctil de las células musculares lisas puede ser tónica (sostenida) o fásica (transitoria) [33] y está influenciada por múltiples entradas como la actividad eléctrica espontánea, las entradas neuronales y hormonales, los cambios locales en la composición química y el estiramiento. [1] Esto contrasta con la actividad contráctil de las células musculares esqueléticas, que depende de una única entrada neuronal. Algunos tipos de células musculares lisas pueden generar sus propios potenciales de acción de forma espontánea, que suelen producirse tras un potencial de marcapasos o un potencial de onda lenta . Estos potenciales de acción se generan por la afluencia de Ca extracelular.2+
, y no Na+
Al igual que los músculos esqueléticos, el calcio citosólico2+
Los iones también son necesarios para el ciclo de puentes cruzados en las células del músculo liso.
Las dos fuentes de Ca citosólico2+
En las células del músculo liso se encuentran los depósitos de Ca extracelulares.2+
entrando a través de los canales de calcio y el Ca2+
iones que se liberan del retículo sarcoplásmico. La elevación del Ca citosólico2+
resulta en más Ca2+
unión a la calmodulina , que luego se une y activa la quinasa de la cadena ligera de miosina . El complejo calcio-calmodulina-quinasa de la cadena ligera de miosina fosforila la miosina en las cadenas ligeras de miosina de 20 kilodalton (kDa) en el residuo de aminoácido serina 19, lo que permite la interacción molecular de la miosina y la actina, e inicia la contracción y activa la ATPasa de miosina . A diferencia de las células del músculo esquelético, las células del músculo liso carecen de troponina, aunque contienen la proteína de filamento delgado tropomiosina y otras proteínas notables: caldesmona y calponina. Por lo tanto, las contracciones del músculo liso son iniciadas por el Ca2+
-fosforilación activada de miosina en lugar de Ca2+
unión al complejo de troponina que regula los sitios de unión de la miosina en la actina, como en los músculos esqueléticos y cardíacos.
La terminación del ciclo de puente cruzado (y el dejar el músculo en estado de bloqueo) ocurre cuando la fosfatasa de la cadena ligera de miosina elimina los grupos fosfato de las cabezas de miosina. La fosforilación de las cadenas ligeras de miosina de 20 kDa se correlaciona bien con la velocidad de acortamiento del músculo liso. Durante este período, hay un rápido aumento en el uso de energía medido por el consumo de oxígeno. A los pocos minutos del inicio, el nivel de calcio disminuye notablemente, la fosforilación de las cadenas ligeras de miosina de 20 kDa disminuye y el uso de energía disminuye; sin embargo, la fuerza en el músculo liso tónico se mantiene. Durante la contracción del músculo, se forman puentes cruzados de ciclo rápido entre la actina activada y la miosina fosforilada, generando fuerza. Se plantea la hipótesis de que el mantenimiento de la fuerza es resultado de "puentes de bloqueo" desfosforilados que se ciclan lentamente y mantienen la fuerza. Se cree que varias quinasas como la quinasa rho , DAPK3 y la proteína quinasa C participan en la fase sostenida de contracción, y el Ca2+
El flujo puede ser significativo.
Aunque las contracciones del músculo liso son miogénicas, la velocidad y la fuerza de sus contracciones pueden ser moduladas por el sistema nervioso autónomo . Las fibras nerviosas posganglionares del sistema nervioso parasimpático liberan el neurotransmisor acetilcolina, que se une a los receptores muscarínicos de acetilcolina (mAChR) en las células del músculo liso. Estos receptores son metabotrópicos , o receptores acoplados a proteína G que inician una cascada de segundos mensajeros. Por el contrario, las fibras nerviosas posganglionares del sistema nervioso simpático liberan los neurotransmisores epinefrina y norepinefrina, que se unen a los receptores adrenérgicos que también son metabotrópicos. Los efectos exactos sobre el músculo liso dependen de las características específicas del receptor activado: tanto la entrada parasimpática como la entrada simpática pueden ser excitatorias (contráctiles) o inhibidoras (relajantes).

Existen dos tipos de células musculares cardíacas : las autorrítmicas y las contráctiles. Las células autorrítmicas no se contraen, sino que marcan el ritmo de contracción de otras células musculares cardíacas, que puede ser modulado por el sistema nervioso autónomo. Por el contrario, las células musculares contráctiles (cardiomiocitos) constituyen la mayoría del músculo cardíaco y son capaces de contraerse.
En el acoplamiento de excitación-contracción (EC) tanto del músculo esquelético como del cardíaco se producen procesos de conducción de la despolarización y liberación de Ca 2+ . Sin embargo, aunque las proteínas implicadas son similares, son distintas en estructura y regulación. Los receptores de dihidropiridina (DHPR) están codificados por genes diferentes, y los receptores de rianodina (RyR) son isoformas distintas. Además, el DHPR contacta con RyR1 (principal isoforma de RyR en el músculo esquelético) para regular la liberación de Ca 2+ en el músculo esquelético, mientras que el canal de calcio de tipo L (DHPR en los miocitos cardíacos) y RyR2 (principal isoforma de RyR en el músculo cardíaco) no están acoplados físicamente en el músculo cardíaco, sino que se enfrentan entre sí mediante un acoplamiento de unión. [34]
A diferencia del músculo esquelético, se cree que el acoplamiento de EC en el músculo cardíaco depende principalmente de un mecanismo llamado liberación de calcio inducida por calcio , [35] que se basa en la estructura de unión entre el túbulo T y el retículo sarcoplásmico. La junctofilina-2 (JPH2) es esencial para mantener esta estructura, así como la integridad del túbulo T. [36] [37] [38] Otra proteína, la proteína accesoria del receptor 5 (REEP5), funciona para mantener la morfología normal del SR de unión. [39] Los defectos del acoplamiento de unión pueden resultar de deficiencias de cualquiera de las dos proteínas. Durante el proceso de liberación de calcio inducida por calcio, los RyR2 son activados por un desencadenante de calcio, que es provocado por el flujo de Ca 2+ a través de los canales de calcio de tipo L. Después de esto, el músculo cardíaco tiende a exhibir estructuras diádicas , en lugar de tríadas .
El acoplamiento excitación-contracción en las células musculares cardíacas se produce cuando las células marcapasos del nódulo sinoauricular o del nódulo auriculoventricular inician un potencial de acción y lo conducen a todas las células del corazón a través de uniones en hendidura . El potencial de acción viaja a lo largo de la membrana superficial hacia los túbulos T (estos últimos no se observan en todos los tipos de células cardíacas) y la despolarización provoca la liberación de Ca extracelular.2+
para entrar en la célula a través de los canales de calcio de tipo L y posiblemente el intercambiador de sodio-calcio (NCX) durante la primera parte de la fase de meseta . Aunque esta entrada de Ca 2+ solo representa alrededor del 10% del Ca 2+ necesario para la activación, es relativamente mayor que la del músculo esquelético.2+
La afluencia provoca un pequeño aumento local del calcio intracelular.2+
. El aumento del Ca intracelular2+
Es detectado por RyR2 en la membrana del retículo sarcoplásmico, que libera Ca2+
en una respuesta fisiológica de retroalimentación positiva . Esta retroalimentación positiva se conoce como liberación de calcio inducida por calcio [35] y da lugar a chispas de calcio ( Ca2+
chispas [40] ). La suma espacial y temporal de ~30.000 Ca2+
Las chispas dan lugar a un aumento de la concentración de calcio citoplasmático en toda la célula. [41] El aumento del calcio citosólico tras el flujo de calcio a través de la membrana celular y el retículo sarcoplásmico está moderado por los tampones de calcio , que se unen a una gran proporción del calcio intracelular. Como resultado, un gran aumento del calcio total conduce a un aumento relativamente pequeño del calcio libre .2+
. [42]
El calcio citoplasmático se une a la troponina C, lo que hace que el complejo de tropomiosina se aleje del sitio de unión de la actina, lo que permite que la cabeza de miosina se una al filamento de actina. A partir de este punto, el mecanismo contráctil es básicamente el mismo que en el músculo esquelético (arriba). En pocas palabras, mediante la hidrólisis del ATP, la cabeza de miosina tira del filamento de actina hacia el centro del sarcómero.

Después de la sístole, el calcio intracelular es absorbido por la bomba de ATPasa del retículo sarcoplásmico (SERCA) y devuelto al retículo sarcoplásmico, listo para que comience el siguiente ciclo. El calcio también es expulsado de la célula principalmente por el intercambiador de sodio-calcio (NCX) y, en menor medida, por una ATPasa de calcio de la membrana plasmática . Las mitocondrias también absorben algo de calcio. [43] Una enzima, el fosfolamban , actúa como freno para la SERCA. A frecuencias cardíacas bajas, el fosfolamban está activo y ralentiza la actividad de la ATPasa de modo que el Ca2+
No es necesario que abandone la célula por completo. A frecuencias cardíacas elevadas, el fosfolambano se fosforila y se desactiva, por lo que absorbe la mayor parte del calcio.2+
desde el citoplasma de nuevo al retículo sarcoplásmico. Una vez más, los tampones de calcio moderan esta caída de Ca2+
concentración, lo que permite una disminución relativamente pequeña del Ca libre2+
concentración en respuesta a un gran cambio en el calcio total. La caída de Ca2+
La concentración de troponina permite que el complejo de troponina se disocie del filamento de actina, poniendo fin así a la contracción. El corazón se relaja, lo que permite que los ventrículos se llenen de sangre y comience de nuevo el ciclo cardíaco.
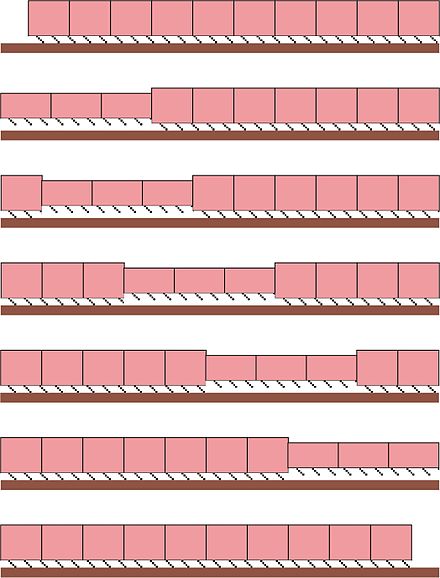
En anélidos como las lombrices de tierra y las sanguijuelas , las células de los músculos circulares y longitudinales forman la pared corporal de estos animales y son responsables de su movimiento. [44] En una lombriz de tierra que se mueve a través del suelo, por ejemplo, las contracciones de los músculos circulares y longitudinales ocurren recíprocamente mientras que el líquido celómico sirve como hidroesqueleto al mantener la turgencia de la lombriz de tierra. [45] Cuando los músculos circulares en los segmentos anteriores se contraen, la porción anterior del cuerpo del animal comienza a contraerse radialmente, lo que empuja el líquido celómico incompresible hacia adelante y aumenta la longitud del animal. Como resultado, el extremo delantero del animal se mueve hacia adelante. A medida que el extremo delantero de la lombriz de tierra se ancla y los músculos circulares en los segmentos anteriores se relajan, una ola de contracciones musculares longitudinales pasa hacia atrás, lo que empuja el resto del cuerpo del animal hacia adelante. [44] [45] Estas ondas alternas de contracciones circulares y longitudinales se denominan peristalsis , que subyace al movimiento de arrastre de las lombrices de tierra.
Los invertebrados, como los anélidos, los moluscos y los nematodos , poseen músculos estriados oblicuamente, que contienen bandas de filamentos gruesos y delgados que están dispuestos helicoidalmente en lugar de transversalmente, como en los músculos esqueléticos o cardíacos de los vertebrados. [46] En los bivalvos , los músculos estriados oblicuamente pueden mantener la tensión durante largos períodos sin utilizar demasiada energía. Los bivalvos utilizan estos músculos para mantener sus conchas cerradas.

Los insectos avanzados como las avispas , las moscas , las abejas y los escarabajos poseen músculos asincrónicos que constituyen los músculos de vuelo en estos animales. [46] Estos músculos de vuelo a menudo se denominan músculos fibrilares porque contienen miofibrillas que son gruesas y visibles. [47] Una característica notable de estos músculos es que no requieren estimulación para cada contracción muscular. Por lo tanto, se denominan músculos asincrónicos porque el número de contracciones en estos músculos no se corresponde (o sincroniza) con el número de potenciales de acción. Por ejemplo, un músculo del ala de una mosca atada puede recibir potenciales de acción a una frecuencia de 3 Hz, pero es capaz de latir a una frecuencia de 120 Hz. [46] El latido de alta frecuencia es posible porque los músculos están conectados a un sistema resonante , que se impulsa a una frecuencia natural de vibración.

En 1780, Luigi Galvani descubrió que los músculos de las patas de las ranas muertas se contraían cuando eran golpeados por una chispa eléctrica. [49] Esta fue una de las primeras incursiones en el estudio de la bioelectricidad , un campo que todavía estudia los patrones y señales eléctricas en tejidos como los nervios y los músculos.
En 1952 se acuñó el término acoplamiento excitación-contracción para describir el proceso fisiológico de convertir un estímulo eléctrico en una respuesta mecánica. [50] Este proceso es fundamental para la fisiología muscular, en la que el estímulo eléctrico suele ser un potencial de acción y la respuesta mecánica es la contracción. El acoplamiento excitación-contracción puede desregularse en muchas enfermedades. Aunque el acoplamiento excitación-contracción se conoce desde hace más de medio siglo, sigue siendo un área activa de investigación biomédica. El esquema general es que llega un potencial de acción para despolarizar la membrana celular. Por mecanismos específicos del tipo de músculo, esta despolarización da como resultado un aumento del calcio citosólico que se denomina transitorio de calcio. Este aumento de calcio activa las proteínas contráctiles sensibles al calcio que luego utilizan ATP para provocar el acortamiento celular.
El mecanismo de la contracción muscular eludió a los científicos durante años y requiere una investigación y actualización continuas. [51] La teoría del filamento deslizante fue desarrollada independientemente por Andrew F. Huxley y Rolf Niedergerke y por Hugh Huxley y Jean Hanson . Sus hallazgos se publicaron como dos artículos consecutivos publicados en la edición del 22 de mayo de 1954 de Nature bajo el tema común "Cambios estructurales en el músculo durante la contracción". [23] [24]