
La resistencia a las enfermedades de las plantas protege a las plantas de los patógenos de dos maneras: mediante estructuras y sustancias químicas preformadas y mediante respuestas del sistema inmunitario inducidas por infecciones. En relación con una planta susceptible, la resistencia a las enfermedades es la reducción del crecimiento de patógenos sobre o dentro de la planta (y, por lo tanto, una reducción de la enfermedad), mientras que el término tolerancia a las enfermedades describe a las plantas que presentan poco daño por enfermedades a pesar de los niveles sustanciales de patógenos. El resultado de la enfermedad está determinado por la interacción triple del patógeno, la planta y las condiciones ambientales (una interacción conocida como el triángulo de la enfermedad ).
Los compuestos activadores de defensa pueden moverse de célula a célula y sistemáticamente a través del sistema vascular de la planta. Sin embargo, las plantas no tienen células inmunes circulantes , por lo que la mayoría de los tipos de células exhiben un amplio conjunto de defensas antimicrobianas . Aunque se pueden observar diferencias cualitativas obvias en la resistencia a las enfermedades cuando se comparan múltiples especímenes (lo que permite la clasificación como "resistentes" o "susceptibles" después de la infección por la misma cepa de patógeno en niveles de inóculo similares en entornos similares), una gradación de diferencias cuantitativas en la resistencia a las enfermedades se observa más típicamente entre cepas de plantas o genotipos . Las plantas resisten consistentemente ciertos patógenos pero sucumben a otros; la resistencia suele ser específica para ciertas especies de patógenos o cepas de patógenos.
La resistencia de las plantas a las enfermedades es fundamental para la producción confiable de alimentos y permite reducir significativamente el uso agrícola de tierra, agua, combustible y otros insumos. Las plantas, tanto en poblaciones naturales como cultivadas, tienen una resistencia inherente a las enfermedades, pero esto no siempre las ha protegido.
La Gran Hambruna irlandesa de la década de 1840, causada por el oomiceto Phytophthora infestans , fue causada por el oomiceto . La primera variedad de banano cultivada en masa del mundo , Gros Michel, se perdió en la década de 1920 debido a la enfermedad de Panamá causada por el hongo Fusarium oxysporum . Las epidemias actuales de roya del tallo del trigo , roya de la hoja y roya amarilla que se propagan desde África oriental hasta el subcontinente indio son causadas por los hongos de la roya Puccinia graminis y P. striiformis . Otras epidemias incluyen el tizón del castaño , así como enfermedades graves y recurrentes de las plantas, como el tizón del arroz , el nematodo del quiste de la soja y el cancro de los cítricos . [1] [2]
Los patógenos de las plantas pueden propagarse rápidamente a grandes distancias, transportados por el agua, el viento, los insectos y los seres humanos. Se estima que, en grandes regiones y en muchas especies de cultivos, las enfermedades suelen reducir el rendimiento de las plantas en un 10 % cada año en los países o sistemas agrícolas más desarrollados, pero la pérdida de rendimiento a causa de las enfermedades suele superar el 20 % en los entornos menos desarrollados. [1]
Sin embargo, el control de enfermedades es razonablemente exitoso para la mayoría de los cultivos. El control de enfermedades se logra mediante el uso de plantas que han sido mejoradas para tener una buena resistencia a muchas enfermedades y mediante métodos de cultivo de plantas como la rotación de cultivos , semillas libres de patógenos, fecha de siembra y densidad de plantas adecuadas, control de la humedad del campo y uso de pesticidas .

El sistema inmunitario de las plantas cuenta con dos niveles interconectados de receptores: uno que detecta con mayor frecuencia las moléculas fuera de la célula y el otro que detecta con mayor frecuencia las moléculas dentro de la célula. Ambos sistemas detectan al intruso y responden activando las defensas antimicrobianas en la célula infectada y en las células vecinas. En algunos casos, las señales que activan las defensas se propagan al resto de la planta o incluso a las plantas vecinas. Los dos sistemas detectan diferentes tipos de moléculas patógenas y clases de proteínas receptoras de las plantas. [5] [6]
El primer nivel está gobernado principalmente por receptores de reconocimiento de patrones que se activan mediante el reconocimiento de patrones moleculares asociados a patógenos o microbios conservados evolutivamente (PAMP o MAMP). La activación de los PRR conduce a la señalización intracelular, la reprogramación transcripcional y la biosíntesis de una respuesta de salida compleja que limita la colonización. El sistema se conoce como inmunidad desencadenada por PAMP o inmunidad desencadenada por patrones (PTI). [7] [6] [8]
El segundo nivel, gobernado principalmente por los productos de los genes R , se suele denominar inmunidad activada por efectores (ETI). La ETI se activa normalmente por la presencia de "efectores" patógenos específicos y luego desencadena respuestas antimicrobianas fuertes (véase la sección sobre los genes R a continuación).
Además de PTI y ETI, las defensas de las plantas pueden activarse mediante la detección de compuestos asociados a daños (DAMP), como porciones de la pared celular de la planta liberadas durante una infección patógena. [9]
Las respuestas activadas por los receptores PTI y ETI incluyen activación de canales iónicos , explosión oxidativa , cambios redox celulares o cascadas de proteína quinasa que activan directamente cambios celulares (como el refuerzo de la pared celular o la producción de antimicrobianos) o activan cambios en la expresión genética que luego elevan otras respuestas defensivas.
Los sistemas inmunitarios de las plantas muestran algunas similitudes mecanísticas con los sistemas inmunitarios de los insectos y los mamíferos, pero también presentan muchas características específicas de las plantas. [10] Los dos niveles descritos anteriormente son fundamentales para la inmunidad de las plantas, pero no describen completamente los sistemas inmunitarios de las plantas. Además, muchos ejemplos específicos de PTI o ETI aparentes violan las definiciones comunes de PTI/ETI, lo que sugiere la necesidad de definiciones y/o paradigmas más amplios. [11]
El término resistencia cuantitativa (que se analiza a continuación) se refiere a la resistencia de las plantas a las enfermedades que está controlada por múltiples genes y múltiples mecanismos moleculares, cada uno de los cuales tiene pequeños efectos sobre el rasgo de resistencia general. La resistencia cuantitativa suele contrastarse con la resistencia a la ETI mediada por genes R de efecto principal único.
Muchos investigadores denominan MAMP a las PAMP , moléculas conservadas que habitan en múltiples géneros de patógenos. Las defensas inducidas por la percepción de MAMP son suficientes para repeler a la mayoría de los patógenos. Sin embargo, las proteínas efectoras de patógenos (ver a continuación) están adaptadas para suprimir las defensas basales como PTI. Se han descubierto muchos receptores para MAMP (y DAMP). Los MAMP y DAMP suelen ser detectados por las quinasas receptoras transmembrana que llevan dominios extracelulares LRR o LysM . [5]
La inmunidad desencadenada por efectores (ETI) se activa por la presencia de efectores patógenos. La respuesta ETI depende de los genes R y se activa por cepas patógenas específicas. La ETI de las plantas a menudo causa una respuesta hipersensible apoptótica .
Las plantas han desarrollado genes R (genes de resistencia) cuyos productos median la resistencia a cepas específicas de virus, bacterias, oomicetos, hongos, nematodos o insectos. Los productos de los genes R son proteínas que permiten el reconocimiento de efectores patógenos específicos, ya sea a través de la unión directa o por el reconocimiento de la alteración del efector de una proteína huésped. [6] Muchos genes R codifican proteínas NB-LRR (proteínas con dominios de repetición ricos en leucina y de unión a nucleótidos , también conocidas como proteínas NLR o proteínas STAND, entre otros nombres). La mayoría de los sistemas inmunes de las plantas tienen un repertorio de 100 a 600 homólogos de genes R diferentes. Se ha demostrado que los genes R individuales median la resistencia a cepas específicas de virus, bacterias, oomicetos, hongos, nematodos o insectos. Los productos de los genes R controlan un amplio conjunto de respuestas de resistencia a enfermedades cuya inducción suele ser suficiente para detener el crecimiento/propagación de patógenos.
Los genes R estudiados generalmente confieren especificidad para cepas particulares de una especie patógena (aquellas que expresan el efector reconocido). Como lo señaló por primera vez Harold Flor en su formulación de la relación gen por gen de mediados del siglo XX , un gen R de planta tiene especificidad para un gen de avirulencia de patógeno (gen Avr). Ahora se sabe que los genes de avirulencia codifican efectores. El gen Avr del patógeno debe tener una especificidad coincidente con el gen R para que ese gen R confiera resistencia, lo que sugiere una interacción receptor/ ligando para los genes Avr y R. [10] Alternativamente, un efector puede modificar su objetivo celular huésped (o un señuelo molecular de ese objetivo), y el producto del gen R (proteína NLR) activa las defensas cuando detecta la forma modificada del objetivo huésped o señuelo. [6] [12]
Los efectores son fundamentales para el potencial patógeno o simbiótico de los microbios y los animales microscópicos que colonizan plantas, como los nematodos. [13] [14] [15] Los efectores suelen ser proteínas que se administran fuera del microbio y dentro de la célula huésped. Estos efectores derivados del colonizador manipulan la fisiología y el desarrollo de la célula huésped. Como tales, los efectores ofrecen ejemplos de coevolución (ejemplo: una proteína fúngica que funciona fuera del hongo pero dentro de las células vegetales ha evolucionado para asumir funciones específicas de la planta). La gama de huéspedes patógenos está determinada, entre otras cosas, por la presencia de efectores apropiados que permiten la colonización de un huésped particular. [5] Los efectores derivados de patógenos son una herramienta poderosa para identificar funciones de la planta que desempeñan papeles clave en la enfermedad y en la resistencia a la enfermedad. Aparentemente, la mayoría de los efectores funcionan para manipular la fisiología del huésped para permitir que se produzca la enfermedad. Los patógenos bacterianos de plantas bien estudiados suelen expresar unas pocas docenas de efectores, a menudo entregados al huésped por un aparato de secreción de tipo III . [13] Los hongos, oomicetos y nematodos patógenos de plantas aparentemente expresan unos cientos de efectores. [14] [15]
Los llamados efectores "centrales" se definen operativamente por su amplia distribución en la población de un patógeno en particular y su contribución sustancial a la virulencia del patógeno. La genómica se puede utilizar para identificar efectores centrales, que luego se pueden utilizar para descubrir nuevos alelos del gen R , que se pueden utilizar en el mejoramiento de plantas para la resistencia a las enfermedades.
Se entiende que las vías de ARNm de las plantas son componentes importantes de la inmunidad desencadenada por patrones moleculares asociados a patógenos (PAMP) (PTI) y la inmunidad desencadenada por efectores (ETI). [16] [17] Se ha demostrado que los microARN inducidos por bacterias (miARN) en Arabidopsis influyen en la señalización hormonal, incluida la auxina, el ácido abscísico (ABA), el ácido jasmónico (JA) y el ácido salicílico (SA). [18] [19] Los avances en estudios de todo el genoma revelaron una adaptación masiva de los patrones de expresión de miARN del huésped después de la infección por los patógenos fúngicos Fusarium virguliforme , [20] Erysiphe graminis , [21] Verticillium dahliae , [22] y Cronartium quercuum , [23] y el oomiceto Phytophthora sojae . [24] Los cambios en la expresión de ARNm en respuesta a patógenos fúngicos indican que el silenciamiento de genes puede estar involucrado en esta vía de defensa. Sin embargo, también hay evidencia de que la respuesta de defensa antifúngica a la infección por Colletotrichum spp. en el maíz no está completamente regulada por la inducción de miRNA específico, sino que puede actuar para ajustar el equilibrio entre los componentes genéticos y metabólicos tras la infección. [ cita requerida ]
El transporte de sRNA durante la infección probablemente se ve facilitado por vesículas extracelulares (EV) y cuerpos multivesiculares (MVB). [25] La composición del ARN en las EV de las plantas no se ha evaluado por completo, pero es probable que sean, en parte, responsables del tráfico de ARN. Las plantas pueden transportar ARN virales, ARNm , miRNA y pequeños ARN interferentes (siRNA) sistémicamente a través del floema. [26] Se cree que este proceso ocurre a través de los plasmodesmos e involucra proteínas de unión al ARN que ayudan a la localización del ARN en las células del mesófilo. Aunque se han identificado en el floema con ARNm, no hay evidencia determinante de que medien el transporte de ARN a larga distancia. [27] Por lo tanto, las EV pueden contribuir a una vía alternativa de carga de ARN en el floema, o posiblemente podrían transportar ARN a través del apoplasto. [28] También hay evidencia de que las EV de plantas pueden permitir la transferencia interespecies de ARN pequeños mediante interferencia de ARN, como el silenciamiento génico inducido por el huésped (HIGS). [29] [30] El transporte de ARN entre plantas y hongos parece ser bidireccional, ya que se ha demostrado que los ARN pequeños del patógeno fúngico Botrytis cinerea se dirigen a los genes de defensa del huésped en Arabidopsis y el tomate. [31]
En un pequeño número de casos, los genes de las plantas son eficaces contra una especie patógena completa, aunque esa especie sea patógena en otros genotipos de esa especie huésped. Algunos ejemplos incluyen la cebada MLO contra el mildiú polvoroso , el trigo Lr34 contra la roya de la hoja y el trigo Yr36 contra la roya lineal del trigo . Puede existir una serie de mecanismos para este tipo de resistencia dependiendo del gen particular y la combinación planta-patógeno. Otras razones para una inmunidad vegetal eficaz pueden incluir una falta de coadaptación (el patógeno y/o la planta carecen de múltiples mecanismos necesarios para la colonización y el crecimiento dentro de esa especie huésped), o un conjunto particularmente eficaz de defensas preformadas. [ cita requerida ]
La señalización de defensa de las plantas se activa mediante los receptores de detección de patógenos que se describen en una sección anterior. [5] Los receptores activados con frecuencia provocan la producción reactiva de oxígeno y óxido nítrico , flujos de iones de calcio , potasio y protones , niveles alterados de ácido salicílico y otras hormonas y la activación de quinasas MAP y otras quinasas proteicas específicas . [10] Estos eventos a su vez conducen típicamente a la modificación de proteínas que controlan la transcripción genética y la activación de la expresión genética asociada a la defensa . [8]
Se han identificado numerosos genes y/o proteínas, así como otras moléculas, que median la transducción de señales de defensa de las plantas. [32] [33] La dinámica del tráfico de vesículas y del citoesqueleto ayuda a orientar las respuestas de defensa de las plantas hacia el punto de ataque del patógeno.
La actividad del sistema inmunológico de las plantas está regulada en parte por hormonas de señalización como: [34] [35]
Puede haber una comunicación cruzada sustancial entre estas vías. [34]
Al igual que ocurre con muchas vías de transducción de señales, la expresión de genes de plantas durante las respuestas inmunitarias puede regularse mediante degradación. Esto ocurre a menudo cuando la unión de las hormonas a los receptores hormonales estimula la degradación asociada a la ubiquitina de las proteínas represoras que bloquean la expresión de ciertos genes. El resultado neto es la expresión de genes activada por hormonas. Ejemplos: [36]
La ubiquitinación desempeña un papel central en la señalización celular que regula procesos como la degradación de proteínas y la respuesta inmunológica. [37] Aunque una de las principales funciones de la ubiquitina es dirigirse a las proteínas para su destrucción, también es útil en las vías de señalización, la liberación de hormonas, la apoptosis y la translocación de materiales a lo largo de la célula. La ubiquitinación es un componente de varias respuestas inmunitarias. Sin el funcionamiento adecuado de la ubiquitina, la invasión de patógenos y otras moléculas dañinas aumentaría drásticamente debido al debilitamiento de las defensas inmunitarias. [37]
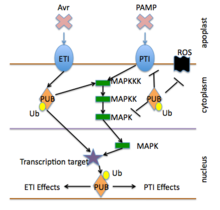
La enzima ubiquitina ligasa E3 es un componente principal que proporciona especificidad en las vías de degradación de proteínas, incluidas las vías de señalización inmunitaria. [36] Los componentes de la enzima E3 se pueden agrupar según los dominios que contienen e incluyen varios tipos. [38]
Estos incluyen la subunidad única Ring y U-box, HECT y CRL . [39] [40] Las vías de señalización de las plantas, incluidas las respuestas inmunes, están controladas por varias vías de retroalimentación, que a menudo incluyen retroalimentación negativa; y pueden ser reguladas por enzimas de desubiquitinación, degradación de factores de transcripción y degradación de reguladores negativos de la transcripción. [36] [41]
Las diferencias en la resistencia de las plantas a las enfermedades suelen ser incrementales o cuantitativas en lugar de cualitativas. El término resistencia cuantitativa (QR) se refiere a la resistencia de las plantas a las enfermedades que está controlada por múltiples genes y múltiples mecanismos moleculares que tienen cada uno efectos pequeños o menores en el rasgo de resistencia general. [42] La QR es importante en el mejoramiento de plantas porque la resistencia resultante suele ser más duradera (efectiva durante más años) y es más probable que sea efectiva contra la mayoría o todas las cepas de un patógeno en particular. La QR suele ser efectiva contra una especie de patógeno o un grupo de especies estrechamente relacionadas, en lugar de ser ampliamente efectiva contra múltiples patógenos. [42] La QR se obtiene a menudo a través del mejoramiento de plantas sin conocimiento de los loci genéticos causales o los mecanismos moleculares. Es probable que la QR dependa de muchos de los componentes del sistema inmunológico de la planta analizados en este artículo, así como de los rasgos que son exclusivos de ciertas parejas planta-patógeno (como la sensibilidad a ciertos efectores de patógenos), así como de los rasgos generales de la planta como las características de la superficie de la hoja o el sistema de raíces o la arquitectura del dosel de la planta. El término QR es sinónimo de resistencia genética menor . [43]
La resistencia de las plantas adultas (APR) es un término especializado que se refiere a la resistencia cuantitativa que no es efectiva en la etapa de plántula pero sí a lo largo de muchas etapas restantes del crecimiento de la planta. [43] [44] [42] La diferencia entre la resistencia de las plantas adultas y la resistencia de las plántulas es especialmente importante en los cultivos anuales . [45] La resistencia de las plántulas es la resistencia que comienza en la etapa de plántula del desarrollo de la planta y continúa durante toda su vida. Cuando lo utilizan los especialistas, el término no se refiere a la resistencia que solo está activa durante la etapa de plántula. "Resistencia de las plántulas" pretende ser sinónimo de resistencia de genes principales o resistencia en todas las etapas (ASR), y se utiliza como contraste a "resistencia de las plantas adultas". [43] La resistencia de las plántulas a menudo está mediada por genes R individuales, pero no todos los genes R codifican la resistencia de las plántulas.
Los fitomejoradores enfatizan la selección y el desarrollo de líneas de plantas resistentes a enfermedades. Las enfermedades de las plantas también se pueden controlar parcialmente mediante el uso de pesticidas y prácticas de cultivo como la rotación de cultivos , la labranza, la densidad de plantación, semillas libres de enfermedades y la limpieza de equipos, pero las variedades de plantas con resistencia inherente (determinada genéticamente) a las enfermedades son generalmente preferidas. [2] El mejoramiento para la resistencia a las enfermedades comenzó cuando las plantas fueron domesticadas por primera vez. Los esfuerzos de mejoramiento continúan porque las poblaciones de patógenos están bajo presión de selección y desarrollan una mayor virulencia, los patógenos se mueven (o son movidos) a nuevas áreas, el cambio de prácticas de cultivo o el clima favorecen a algunos patógenos y pueden reducir la eficacia de la resistencia, y el mejoramiento de plantas para otros rasgos puede alterar la resistencia previa. [46] Una línea de plantas con resistencia aceptable contra un patógeno puede carecer de resistencia contra otros.
La crianza para la resistencia generalmente incluye:
La resistencia se considera duradera si continúa siendo efectiva durante varios años de uso generalizado a medida que evolucionan las poblaciones de patógenos. La " resistencia vertical " es específica de ciertas razas o cepas de una especie de patógeno, a menudo está controlada por genes R individuales y puede ser menos duradera. La resistencia horizontal o de amplio espectro contra una especie de patógeno completa a menudo es solo incompletamente efectiva, pero más duradera, y a menudo está controlada por muchos genes que se segregan en las poblaciones de cría. [2] La durabilidad de la resistencia es importante incluso cuando se espera que futuras variedades mejoradas estén en camino: el tiempo promedio desde el reconocimiento humano de una nueva amenaza de enfermedad fúngica hasta el lanzamiento de un cultivo resistente a ese patógeno es de al menos doce años. [47] [48]
Cultivos como la papa, la manzana, el plátano y la caña de azúcar suelen propagarse mediante reproducción vegetativa para preservar variedades de plantas muy deseables, porque en el caso de estas especies, el cruzamiento alógamo altera gravemente los rasgos preferidos. Véase también propagación asexual . Los cultivos propagados vegetativamente pueden estar entre los mejores objetivos para la mejora de la resistencia mediante el método biotecnológico de transformación de plantas para gestionar los genes que afectan a la resistencia a las enfermedades. [1]
El mejoramiento científico para la resistencia a enfermedades se originó con Sir Rowland Biffen , quien identificó un solo gen recesivo para la resistencia a la roya amarilla del trigo. Casi todos los cultivos fueron mejorados para incluir genes de resistencia a enfermedades (R), muchos de ellos por introgresión de parientes silvestres compatibles. [1]
El término GM ( "genéticamente modificado" ) se utiliza a menudo como sinónimo de transgénico para referirse a plantas modificadas mediante tecnologías de ADN recombinante. Las plantas transgénicas/GM con resistencia a enfermedades contra plagas de insectos han tenido un gran éxito como productos comerciales, especialmente en maíz y algodón, y se plantan anualmente en más de 20 millones de hectáreas en más de 20 países en todo el mundo [49] (ver también cultivos genéticamente modificados ). La resistencia a enfermedades de las plantas transgénicas contra patógenos microbianos se demostró por primera vez en 1986. La expresión de secuencias de genes de proteína de la cubierta viral confirió resistencia al virus a través de pequeños ARN . Esto resultó ser un mecanismo ampliamente aplicable para inhibir la replicación viral. [50] Combinando genes de proteína de la cubierta de tres virus diferentes, los científicos desarrollaron híbridos de calabaza con resistencia multiviral validada en el campo. Niveles similares de resistencia a esta variedad de virus no se habían logrado mediante el mejoramiento convencional.
Una estrategia similar se desplegó para combatir el virus de la mancha anular de la papaya , que en 1994 amenazó con destruir la industria de la papaya de Hawái . Los ensayos de campo demostraron una eficacia excelente y una alta calidad de la fruta. En 1998 se aprobó la venta de la primera papaya transgénica resistente al virus. La resistencia a las enfermedades ha durado más de 15 años. La papaya transgénica representa aproximadamente el 85% de la producción hawaiana. La fruta está aprobada para la venta en los EE. UU., Canadá y Japón.
Las líneas de papa que expresan secuencias de replicasa viral que confieren resistencia al virus del enrollamiento de la hoja de la papa se vendieron bajo los nombres comerciales NewLeaf Y y NewLeaf Plus, y fueron ampliamente aceptadas en la producción comercial en 1999-2001, hasta que McDonald's Corp. decidió no comprar papas GM y Monsanto decidió cerrar su negocio de papas NatureMark. [51] Las papas NewLeaf Y y NewLeaf Plus tenían dos rasgos GM, ya que también expresaban resistencia mediada por Bt al escarabajo de la papa.
Hasta 2013, ningún otro cultivo con resistencia diseñada a enfermedades microbianas patógenas había llegado al mercado, aunque más de una docena estaban en algún estado de desarrollo y prueba.
La investigación dirigida a la resistencia diseñada sigue múltiples estrategias. Una es transferir PRR útiles a especies que carecen de ellos. La identificación de PRR funcionales y su transferencia a una especie receptora que carece de un receptor ortólogo podría proporcionar una vía general para repertorios de PRR adicionales ampliados. Por ejemplo, el receptor EF-Tu (EFR) PRR de Arabidopsis reconoce el factor de elongación de la traducción bacteriana EF-Tu . La investigación realizada en el Laboratorio Sainsbury demostró que el despliegue de EFR en Nicotiana benthamiana o Solanum lycopersicum (tomate), que no pueden reconocer EF-Tu , confirió resistencia a una amplia gama de patógenos bacterianos. La expresión de EFR en tomate fue especialmente efectiva contra la bacteria del suelo extendida y devastadora Ralstonia solanacearum . [52] Por el contrario, el gen Verticillium 1 ( Ve1 ) del tomate puede transferirse del tomate a Arabidopsis , donde confiere resistencia a los aislados de Verticillium de la raza 1. [1]
La segunda estrategia intenta utilizar múltiples genes NLR simultáneamente, una estrategia de mejoramiento conocida como apilamiento. Las variedades generadas por mejoramiento molecular asistido por ADN o por transferencia de genes probablemente mostrarán una resistencia más duradera, porque los patógenos tendrían que mutar múltiples genes efectores. La secuenciación de ADN permite a los investigadores “extraer” funcionalmente genes NLR de múltiples especies/cepas. [1]
El gen efector avrBs2 de Xanthomona perforans es el agente causal de la enfermedad de las manchas bacterianas en pimientos y tomates. La primera búsqueda “racionalizada por efectores” de un gen R potencialmente duradero se produjo tras el hallazgo de que avrBs2 se encuentra en la mayoría de las especies de Xanthomonas causantes de enfermedades y es necesario para la adaptación de los patógenos. El gen NLR Bs2 del pimiento silvestre, Capsicum chacoense , se trasladó al tomate, donde inhibió el crecimiento del patógeno. Los ensayos de campo demostraron una resistencia robusta sin productos químicos bactericidas. Sin embargo, cepas raras de Xanthomonas superaron la resistencia mediada por Bs2 en pimientos mediante la adquisición de mutaciones avrBs2 que evitan el reconocimiento pero mantienen la virulencia. La acumulación de genes R que reconocen cada uno un efector central diferente podría retrasar o impedir la adaptación. [1]
Más de 50 loci en cepas de trigo confieren resistencia a enfermedades contra patógenos de la roya del tallo, la hoja y la roya amarilla del trigo. El gen NLR de la roya del tallo 35 ( Sr35 ), clonado de un pariente diploide del trigo cultivado, Triticum monococcum , proporciona resistencia al aislado de roya del trigo Ug99 . De manera similar, Sr33 , del pariente del trigo Aegilops tauschii , codifica un ortólogo de trigo para los genes de resistencia al mildiú polvoroso Mla de la cebada . Ambos genes son inusuales en el trigo y sus parientes. Combinados con el gen Sr2 que actúa de forma aditiva con al menos Sr33, podrían proporcionar resistencia duradera a las enfermedades de Ug99 y sus derivados. [1]
Otra clase de genes de resistencia a enfermedades de las plantas abre una “trampa” que mata rápidamente a las células invadidas, deteniendo la proliferación de patógenos. Los efectores tipo activador de transcripción (TAL) de Xanthomonas y Ralstonia son proteínas de unión al ADN que activan la expresión de genes hospedadores para mejorar la virulencia de los patógenos. Tanto el linaje del arroz como el del pimiento desarrollaron de forma independiente sitios de unión a efectores TAL que, en cambio, actúan como un verdugo que induce la muerte hipersensible de las células hospedadoras cuando se regulan al alza. Xa27 del arroz y Bs3 y Bs4c del pimiento son genes “ejecutores” (o “verdugos”) que codifican proteínas vegetales no homólogas de función desconocida. Los genes ejecutores se expresan solo en presencia de un efector TAL específico. [1]
Se demostró la existencia de genes ejecutores modificados mediante el rediseño exitoso del promotor Bs3 del pimiento para que contuviera dos sitios de unión adicionales para los efectores TAL de cepas patógenas dispares. Posteriormente, se implementó un gen ejecutor modificado en el arroz mediante la adición de cinco sitios de unión de efectores TAL al promotor Xa27 . La construcción sintética Xa27 confirió resistencia contra las especies de Xanthomonas que causan el tizón bacteriano y la raya bacteriana de la hoja. [1]
La mayoría de los patógenos vegetales reprograman los patrones de expresión de los genes hospedantes para beneficiar directamente al patógeno. Los genes reprogramados necesarios para la supervivencia y proliferación del patógeno pueden considerarse como “genes de susceptibilidad a enfermedades”. Los genes de resistencia recesivos son candidatos a la susceptibilidad a enfermedades. Por ejemplo, una mutación deshabilitó un gen de Arabidopsis que codifica la pectato liasa (involucrada en la degradación de la pared celular), confiriendo resistencia al patógeno del mildiú polvoroso Golovinomyces cichoracearum . De manera similar, el gen MLO de la cebada y los ortólogos del MLO del guisante y el tomate mutados espontáneamente también confieren resistencia al mildiú polvoroso. [1]
El gen Lr34 proporciona resistencia parcial a las royas amarillas y de las hojas y al oídio en el trigo. El gen Lr34 codifica un transportador de casete de unión a trifosfato de adenosina (ATP) (ABC). El alelo dominante que proporciona resistencia a las enfermedades se encontró recientemente en el trigo cultivado (no en las cepas silvestres) y, al igual que el MLO , proporciona resistencia de amplio espectro en la cebada. [1]
Los alelos naturales de los factores de iniciación de la elongación de la traducción del hospedador eif4e y eif4g también son genes recesivos de resistencia viral. Algunos se han utilizado para controlar los potyvirus en la cebada, el arroz, el tomate, el pimiento, el guisante, la lechuga y el melón. El descubrimiento motivó una selección exitosa de mutantes para los alelos eif4e inducidos químicamente en el tomate. [1]
La variación natural del promotor puede conducir a la evolución de alelos recesivos de resistencia a enfermedades. Por ejemplo, el gen de resistencia recesivo xa13 en el arroz es un alelo de Os-8N3 . Os-8N3 es activado transcripcionalmente por cepas de Xanthomonas oryzae pv. oryzae que expresan el efector TAL PthXo1 . El gen xa13 tiene un elemento de unión al efector mutado en su promotor que elimina la unión de PthXo1 y hace que estas líneas sean resistentes a cepas que dependen de PthXo1 . Este hallazgo también demostró que Os-8N3 es necesario para la susceptibilidad. [1]
Xa13/Os-8N3 es necesario para el desarrollo del polen, lo que demuestra que dichos alelos mutantes pueden ser problemáticos si el fenotipo de susceptibilidad a la enfermedad altera la función en otros procesos. Sin embargo, las mutaciones en el elemento de unión al efector TAL Os11N3 (OsSWEET14) se realizaron fusionando los efectores TAL con nucleasas ( TALEN ). Las plantas de arroz editadas genómicamente con sitios de unión de Os11N3 alterados siguieron siendo resistentes a Xanthomonas oryzae pv. oryzae , pero aún proporcionaron una función de desarrollo normal. [1]
La resistencia basada en el silenciamiento de ARN es una herramienta poderosa para diseñar cultivos resistentes. La ventaja del ARNi como una nueva terapia génica contra infecciones fúngicas, virales y bacterianas en plantas radica en el hecho de que regula la expresión génica a través de la degradación del ARN mensajero , la represión de la traducción y la remodelación de la cromatina a través de pequeños ARN no codificantes. Mecanísticamente, los procesos de silenciamiento están guiados por productos de procesamiento del desencadenante del ARN bicatenario ( dsRNA ), que se conocen como pequeños ARN interferentes y microARN . [53]
Entre las miles de especies de microorganismos patógenos de plantas, sólo una pequeña minoría tiene la capacidad de infectar a una amplia gama de especies de plantas. La mayoría de los patógenos, en cambio, muestran un alto grado de especificidad del hospedador. A menudo se dice que las especies de plantas no hospedadoras expresan resistencia al no hospedador . El término resistencia al hospedador se utiliza cuando una especie de patógeno puede ser patógena en la especie hospedadora pero ciertas cepas de esa especie de planta resisten a ciertas cepas de la especie patógena. Las causas de la resistencia al hospedador y la resistencia al no hospedador pueden superponerse. El rango de hospedadores de patógenos está determinado, entre otras cosas, por la presencia de efectores apropiados que permitan la colonización de un hospedador en particular. [5] El rango de hospedadores de patógenos puede cambiar bastante repentinamente si, por ejemplo, la capacidad del patógeno para sintetizar una toxina o efector específico del hospedador se obtiene mediante redistribución/mutación de genes, o mediante transferencia horizontal de genes . [54] [55]
Las poblaciones nativas suelen caracterizarse por una diversidad sustancial de genotipos y poblaciones dispersas (crecimiento en una mezcla con muchas otras especies de plantas). También han experimentado una coevolución planta-patógeno . Por lo tanto, mientras no se introduzcan o evolucionen nuevos patógenos, dichas poblaciones generalmente exhiben solo una baja incidencia de epidemias de enfermedades graves . [56]
Los sistemas agrícolas de monocultivo proporcionan un entorno ideal para la evolución de patógenos, porque ofrecen una alta densidad de especímenes objetivo con genotipos similares/idénticos. [56] El aumento de la movilidad que surge de los sistemas de transporte modernos proporciona a los patógenos acceso a más objetivos potenciales. [56] El cambio climático puede alterar el rango geográfico viable de las especies de patógenos y hacer que algunas enfermedades se conviertan en un problema en áreas donde antes la enfermedad era menos importante. [56]
Estos factores hacen que la agricultura moderna sea más propensa a las epidemias de enfermedades. Las soluciones habituales incluyen la cría constante de especies resistentes a las enfermedades, el uso de pesticidas, el uso de inspecciones fronterizas y restricciones a la importación de plantas, el mantenimiento de una diversidad genética significativa dentro del acervo genético de los cultivos (véase diversidad de cultivos ) y la vigilancia constante para acelerar la iniciación de respuestas apropiadas. Algunas especies de patógenos tienen una capacidad mucho mayor para superar la resistencia de las plantas a las enfermedades que otras, a menudo debido a su capacidad de evolucionar rápidamente y de dispersarse ampliamente. [56]
La plaga del castaño se detectó por primera vez en los castaños americanos que crecían en lo que hoy se conoce como el Zoológico del Bronx en el año 1904. Durante los años posteriores a este incidente, se debatió sobre cuál era la identidad del patógeno, así como el enfoque adecuado para su control. Los primeros intentos de solucionar el problema en los castaños implicaban soluciones químicas o físicas. Intentaron utilizar fungicidas, cortar ramas de los árboles para detener la infección y eliminar por completo los árboles infectados de las viviendas para no permitir que infectaran a los demás. Todas estas estrategias resultaron infructuosas. Incluso se pusieron en marcha medidas de cuarentena que se vieron facilitadas por la aprobación de la Ley de Cuarentena Vegetal. La plaga del castaño siguió siendo un gran problema a medida que se propagaba rápidamente por los bosques densamente poblados de castaños. En 1914, se consideró la idea de inducir resistencia a la plaga en los árboles mediante diversos medios y mecanismos de reproducción. [57]