Los macrófagos ( / ˈm æ k r oʊ f eɪ dʒ / ; abreviado M φ , MΦ o MP ) son un tipo de glóbulo blanco del sistema inmune innato que engulle y digiere patógenos, como células cancerosas , microbios , restos celulares y sustancias extrañas, que no tienen proteínas específicas de las células corporales sanas en su superficie. [1] [2] Este proceso se llama fagocitosis , que actúa para defender al huésped contra infecciones y lesiones. [3]
Los macrófagos se encuentran en prácticamente todos los tejidos, [4] donde patrullan en busca de patógenos potenciales mediante un movimiento ameboide . Toman diversas formas (con varios nombres) en todo el cuerpo (p. ej., histiocitos , células de Kupffer , macrófagos alveolares , microglia y otros), pero todos son parte del sistema de fagocitos mononucleares . Además de la fagocitosis, desempeñan un papel fundamental en la defensa no específica ( inmunidad innata ) y también ayudan a iniciar mecanismos de defensa específicos ( inmunidad adaptativa ) al reclutar otras células inmunes como los linfocitos . Por ejemplo, son importantes como presentadores de antígenos a las células T. En los seres humanos, los macrófagos disfuncionales causan enfermedades graves como la enfermedad granulomatosa crónica que resultan en infecciones frecuentes.
Además de aumentar la inflamación y estimular el sistema inmunológico, los macrófagos también desempeñan un papel antiinflamatorio importante y pueden disminuir las reacciones inmunológicas a través de la liberación de citocinas . Los macrófagos que estimulan la inflamación se denominan macrófagos M1, mientras que los que la disminuyen y estimulan la reparación tisular se denominan macrófagos M2. [5] Esta diferencia se refleja en su metabolismo; los macrófagos M1 tienen la capacidad única de metabolizar la arginina a la molécula "asesina" óxido nítrico , mientras que los macrófagos M2 tienen la capacidad única de metabolizar la arginina a la molécula "reparadora" ornitina . [6] Sin embargo, esta dicotomía ha sido cuestionada recientemente a medida que se ha descubierto una mayor complejidad. [7]
Los macrófagos humanos tienen un diámetro de aproximadamente 21 micrómetros (0,00083 pulgadas) [8] y se producen por la diferenciación de monocitos en los tejidos. Se pueden identificar mediante citometría de flujo o tinción inmunohistoquímica por su expresión específica de proteínas como CD14 , CD40 , CD11b , CD64 , F4/80 (ratones)/ EMR1 (humanos), lisozima M, MAC-1 /MAC-3 y CD68 . [9]
Los macrófagos fueron descubiertos y nombrados por primera vez por Élie Metchnikoff , un zoólogo del Imperio ruso, en 1884. [10] [11]
La mayoría de los macrófagos se encuentran ubicados en puntos estratégicos donde es probable que se produzca una invasión microbiana o una acumulación de partículas extrañas. Estas células juntas como grupo se conocen como sistema fagocítico mononuclear y anteriormente se conocían como sistema reticuloendotelial. Cada tipo de macrófago, determinado por su ubicación, tiene un nombre específico:
Las investigaciones sobre las células de Kupffer se ven obstaculizadas porque, en el caso de los seres humanos, las células de Kupffer solo son accesibles para el análisis inmunohistoquímico a partir de biopsias o autopsias. En ratas y ratones, son difíciles de aislar y, tras la purificación, solo se pueden obtener aproximadamente 5 millones de células de un ratón.
Los macrófagos pueden expresar funciones paracrinas dentro de órganos que son específicas de la función de ese órgano. En el testículo , por ejemplo, se ha demostrado que los macrófagos pueden interactuar con las células de Leydig secretando 25-hidroxicolesterol , un oxisterol que las células de Leydig vecinas pueden convertir en testosterona . [15] Además, los macrófagos testiculares pueden participar en la creación de un entorno inmunológico privilegiado en el testículo y en la mediación de la infertilidad durante la inflamación del testículo.
Los macrófagos residentes cardíacos participan en la conducción eléctrica a través de la comunicación de unión estrecha con los miocitos cardíacos . [16]
Los macrófagos se pueden clasificar según su función fundamental y su activación. Según esta clasificación, existen macrófagos de activación clásica (M1) , macrófagos de cicatrización de heridas (también conocidos como macrófagos de activación alternativa (M2) ) y macrófagos reguladores (Mregs). [17]
Los macrófagos que residen en tejidos sanos adultos derivan de monocitos circulantes o se establecen antes del nacimiento y luego se mantienen durante la vida adulta independientemente de los monocitos. [18] [19] Por el contrario, la mayoría de los macrófagos que se acumulan en sitios enfermos generalmente derivan de monocitos circulantes. [20] La extravasación de leucocitos describe la entrada de monocitos en tejido dañado a través del endotelio de los vasos sanguíneos a medida que se convierten en macrófagos. Los monocitos son atraídos a un sitio dañado por sustancias químicas a través de la quimiotaxis , desencadenada por una variedad de estímulos que incluyen células dañadas, patógenos y citocinas liberadas por macrófagos que ya están en el sitio. En algunos sitios como el testículo, se ha demostrado que los macrófagos pueblan el órgano a través de la proliferación. [21] A diferencia de los neutrófilos de vida corta , los macrófagos sobreviven más tiempo en el cuerpo, hasta varios meses.
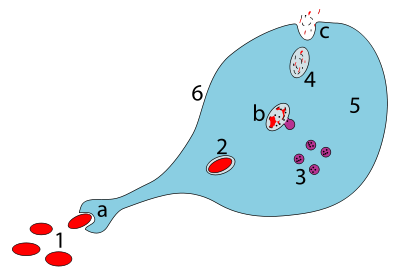
Los macrófagos son fagocitos profesionales y están altamente especializados en la eliminación de células muertas o moribundas y de restos celulares. Esta función es importante en la inflamación crónica, ya que las primeras etapas de la inflamación están dominadas por los neutrófilos, que son ingeridos por los macrófagos cuando alcanzan la mayoría de edad (consulte CD31 para obtener una descripción de este proceso). [22]
Los neutrófilos son atraídos primero a un sitio, donde realizan su función y mueren, antes de que ellos o sus trampas extracelulares de neutrófilos sean fagocitados por los macrófagos. [22] [23] Cuando están en el sitio, la primera ola de neutrófilos, después del proceso de envejecimiento y después de las primeras 48 horas, estimula la aparición de los macrófagos por lo que estos macrófagos luego ingerirán los neutrófilos envejecidos. [22]
La eliminación de células moribundas es manejada, en mayor medida, por macrófagos fijos , que permanecerán en lugares estratégicos como los pulmones, el hígado, el tejido neural , los huesos, el bazo y el tejido conectivo, ingiriendo materiales extraños como patógenos y reclutando macrófagos adicionales si es necesario. [24]
Cuando un macrófago ingiere un patógeno, éste queda atrapado en un fagosoma , que luego se fusiona con un lisosoma . Dentro del fagolisosoma , las enzimas y los peróxidos tóxicos digieren el patógeno. Sin embargo, algunas bacterias, como Mycobacterium tuberculosis , se han vuelto resistentes a estos métodos de digestión. Las Salmonellae tifoideas inducen su propia fagocitosis por los macrófagos del huésped in vivo e inhiben la digestión por acción lisosomal, utilizando así los macrófagos para su propia replicación y provocando la apoptosis de los macrófagos. [25] Los macrófagos pueden digerir más de 100 bacterias antes de que finalmente mueran debido a sus propios compuestos digestivos.
Cuando un patógeno invade, los macrófagos residentes en el tejido se encuentran entre las primeras células en responder. [26] Dos de las principales funciones de los macrófagos residentes en el tejido son fagocitar el antígeno entrante y secretar citocinas proinflamatorias que inducen inflamación y reclutan otras células inmunes al sitio. [27]

Los macrófagos pueden internalizar antígenos a través de la fagocitosis mediada por receptores. [28] Los macrófagos tienen una amplia variedad de receptores de reconocimiento de patrones (PRR) que pueden reconocer patrones moleculares asociados a microbios (MAMP) de patógenos. Muchos PRR, como los receptores tipo Toll (TLR), los receptores carroñeros (SR), los receptores de lectina tipo C, entre otros, reconocen patógenos para la fagocitosis. [28] Los macrófagos también pueden reconocer patógenos para la fagocitosis indirectamente a través de las opsoninas , que son moléculas que se adhieren a los patógenos y los marcan para la fagocitosis. [29] Las opsoninas pueden causar una adhesión más fuerte entre el macrófago y el patógeno durante la fagocitosis, por lo tanto, las opsoninas tienden a mejorar la actividad fagocítica de los macrófagos. [30] Tanto las proteínas del complemento como los anticuerpos pueden unirse a los antígenos y opsonizarlos. Los macrófagos tienen receptores de complemento 1 (CR1) y 3 (CR3) que reconocen las proteínas de complemento unidas a patógenos C3b e iC3b, respectivamente, así como receptores γ cristalizables en fragmentos (FcγRs) que reconocen la región cristalizable en fragmentos (Fc) de los anticuerpos de inmunoglobulina G (IgG) unidos a antígenos . [29] [31] Al fagocitar y digerir patógenos, los macrófagos pasan por un estallido respiratorio donde se consume más oxígeno para suministrar la energía necesaria para producir especies reactivas de oxígeno (ROS) y otras moléculas antimicrobianas que digieren los patógenos consumidos. [27] [32]
El reconocimiento de MAMP por PRR puede activar macrófagos residentes en el tejido para secretar citocinas proinflamatorias que reclutan otras células inmunes. Entre los PRR, los TLR juegan un papel importante en la transducción de señales que conduce a la producción de citocinas. [28] La unión de MAMP a TLR desencadena una serie de eventos posteriores que finalmente activan el factor de transcripción NF-κB y dan como resultado la transcripción de los genes de varias citocinas proinflamatorias, incluidas IL-1β , IL-6 , TNF-α , IL-12B e interferones de tipo I como IFN-α e IFN-β. [33] Sistémicamente, IL-1β, IL-6 y TNF-α inducen fiebre e inician la respuesta de fase aguda en la que el hígado secreta proteínas de fase aguda . [26] [27] [34] A nivel local, IL-1β y TNF-α provocan vasodilatación, donde los espacios entre las células epiteliales de los vasos sanguíneos se ensanchan, y una regulación positiva de las moléculas de adhesión de la superficie celular en las células epiteliales para inducir la extravasación de leucocitos . [26] [27]
Los neutrófilos se encuentran entre las primeras células inmunes reclutadas por los macrófagos para salir de la sangre a través de la extravasación y llegar al sitio de la infección. [34] Los macrófagos secretan muchas quimiocinas como CXCL1 , CXCL2 y CXCL8 (IL-8) que atraen a los neutrófilos al sitio de la infección. [26] [34] Una vez que los neutrófilos han terminado de fagocitar y eliminar el antígeno al final de la respuesta inmune, experimentan apoptosis y los macrófagos se reclutan de los monocitos de la sangre para ayudar a eliminar los restos apoptóticos. [35]
Los macrófagos también reclutan otras células inmunes como monocitos, células dendríticas, células asesinas naturales, basófilos, eosinófilos y células T a través de quimiocinas como CCL2 , CCL4 , CCL5 , CXCL8 , CXCL9 , CXCL10 y CXCL11 . [26] [34] Junto con las células dendríticas, los macrófagos ayudan a activar las células asesinas naturales (NK) a través de la secreción de interferones tipo I (IFN-α e IFN-β) e IL-12 . IL-12 actúa con IL-18 para estimular la producción de interferón gamma (IFN-γ) citocina proinflamatoria por las células NK, que sirve como una fuente importante de IFN-γ antes de que se active el sistema inmunológico adaptativo. [34] [36] El IFN-γ mejora la respuesta inmune innata al inducir un fenotipo más agresivo en los macrófagos, lo que les permite matar patógenos de manera más eficiente. [34]
Algunos de los quimioatrayentes de células T secretados por los macrófagos incluyen CCL5 , CXCL9 , CXCL10 y CXCL11 . [26]

Los macrófagos son células presentadoras de antígenos (APC) profesionales, lo que significa que pueden presentar péptidos de antígenos fagocitados en moléculas del complejo mayor de histocompatibilidad (MHC) II en su superficie celular para las células T auxiliares. [38] Los macrófagos no son activadores primarios de células T auxiliares vírgenes que nunca se han activado previamente, ya que los macrófagos residentes en el tejido no viajan a los ganglios linfáticos donde residen las células T auxiliares vírgenes. [39] [40] Aunque los macrófagos también se encuentran en órganos linfoides secundarios como los ganglios linfáticos, no residen en zonas de células T y no son eficaces para activar las células T auxiliares vírgenes. [39] Los macrófagos en los tejidos linfoides están más involucrados en la ingestión de antígenos y evitando que entren en la sangre, así como en la absorción de desechos de los linfocitos apoptóticos. [39] [41] Por lo tanto, los macrófagos interactúan principalmente con células T auxiliares previamente activadas que han abandonado el ganglio linfático y han llegado al sitio de la infección o con células T de memoria residentes en el tejido. [40]
Los macrófagos proporcionan ambas señales necesarias para la activación de las células T colaboradoras: 1) Los macrófagos presentan la molécula MHC clase II unida al péptido antigénico para que sea reconocida por el receptor de células T (TCR) correspondiente, y 2) el reconocimiento de patógenos por los PRR induce a los macrófagos a regular positivamente las moléculas coestimuladoras CD80 y CD86 (también conocidas como B7 ) que se unen a CD28 en las células T colaboradoras para proporcionar la señal coestimuladora. [34] [38] Estas interacciones permiten que las células T colaboradoras alcancen la función efectora completa y les proporcionan señales continuas de supervivencia y diferenciación que les impiden sufrir apoptosis debido a la falta de señalización del TCR. [38] Por ejemplo, la señalización de IL-2 en las células T regula positivamente la expresión de la proteína antiapoptótica Bcl-2 , pero la producción de IL-2 por parte de las células T y el receptor de IL-2 de alta afinidad IL-2RA requieren una señal continua del reconocimiento del TCR del antígeno unido al MHC. [34] [42]
Los macrófagos pueden alcanzar diferentes fenotipos de activación a través de interacciones con diferentes subconjuntos de células T auxiliares, como TH 1 y TH 2. [ 17] Aunque existe un amplio espectro de fenotipos de activación de macrófagos, hay dos fenotipos principales que se reconocen comúnmente. [17] Son los macrófagos activados clásicamente, o macrófagos M1, y los macrófagos activados alternativamente, o macrófagos M2. Los macrófagos M1 son proinflamatorios, mientras que los macrófagos M2 son principalmente antiinflamatorios. [17]
Las células TH 1 desempeñan un papel importante en la activación clásica de los macrófagos como parte de la respuesta inmune tipo 1 contra patógenos intracelulares (como bacterias intracelulares ) que pueden sobrevivir y replicarse dentro de las células huésped, especialmente aquellos patógenos que se replican incluso después de ser fagocitados por macrófagos. [43] Después de que el TCR de las células TH 1 reconoce moléculas MHC clase II unidas a péptidos antigénicos específicos en los macrófagos, las células TH 1 1) secretan IFN-γ y 2) regulan positivamente la expresión del ligando CD40 (CD40L), que se une a CD40 en los macrófagos. [44] [34] Estas 2 señales activan los macrófagos y mejoran su capacidad para matar patógenos intracelulares a través del aumento de la producción de moléculas antimicrobianas como el óxido nítrico (NO) y el superóxido (O 2- ). [26] [34] Esta mejora de la capacidad antimicrobiana de los macrófagos por parte de las células TH 1 se conoce como activación clásica de los macrófagos, y los macrófagos activados se conocen como macrófagos activados clásicamente o macrófagos M1. Los macrófagos M1 a su vez regulan positivamente las moléculas B7 y la presentación de antígenos a través de moléculas MHC de clase II para proporcionar señales que sostienen la ayuda de las células T. [44] La activación de los macrófagos TH 1 y M1 es un ciclo de retroalimentación positiva, en el que el IFN-γ de las células TH 1 regula positivamente la expresión de CD40 en los macrófagos; la interacción entre el CD40 en los macrófagos y el CD40L en las células T activa a los macrófagos para que secreten IL-12; y la IL-12 promueve una mayor secreción de IFN-γ de las células TH 1 . [34] [44] El contacto inicial entre el antígeno MHC II unido al macrófago y el TCR sirve como punto de contacto entre las dos células donde se concentra la mayor parte de la secreción de IFN-γ y CD-40L en las células T, por lo que es probable que solo se activen los macrófagos que interactúan directamente con las células T H 1. [34]
Además de activar los macrófagos M1, las células TH 1 expresan el ligando Fas (FasL) y la linfotoxina beta (LT-β) para ayudar a matar a los macrófagos crónicamente infectados que ya no pueden matar patógenos. [34] La muerte de los macrófagos crónicamente infectados libera patógenos al espacio extracelular que luego pueden ser eliminados por otros macrófagos activados. [34] Las células TH 1 también ayudan a reclutar más monocitos, el precursor de los macrófagos, al sitio de la infección. Las TH 1 secretan TNF-α y LT-α para facilitar la unión de los vasos sanguíneos a los monocitos y su salida. [34] Las TH 1 secretan CCL2 como quimioatrayente para los monocitos. IL-3 y GM-CSF liberados por las células TH 1 estimulan una mayor producción de monocitos en la médula ósea. [34]
Cuando los patógenos intracelulares no pueden eliminarse, como en el caso de Mycobacterium tuberculosis , el patógeno se contiene a través de la formación de granuloma , una agregación de macrófagos infectados rodeados de células T activadas. [45] Los macrófagos que bordean los linfocitos activados a menudo se fusionan para formar células gigantes multinucleadas que parecen tener una mayor capacidad antimicrobiana debido a su proximidad a las células T H 1, pero con el tiempo, las células en el centro comienzan a morir y forman tejido necrótico. [40] [45]
Las células T H 2 desempeñan un papel importante en la activación alternativa de los macrófagos como parte de la respuesta inmune tipo 2 contra grandes patógenos extracelulares como los helmintos . [34] [46] Las células T H 2 secretan IL-4 e IL-13, que activan los macrófagos para convertirse en macrófagos M2, también conocidos como macrófagos activados alternativamente. [46] [47] Los macrófagos M2 expresan arginasa-1 , una enzima que convierte la arginina en ornitina y urea . [46] La ornitina ayuda a aumentar la contracción del músculo liso para expulsar el gusano y también participa en la reparación de tejidos y heridas. La ornitina puede metabolizarse aún más a prolina , que es esencial para sintetizar colágeno . [46] Los macrófagos M2 también pueden disminuir la inflamación al producir antagonista del receptor de IL-1 (IL-1RA) y receptores de IL-1 que no conducen a una señalización inflamatoria descendente (IL-1RII). [34] [48]
Otra parte de la activación de la inmunidad adaptativa implica la estimulación de CD8 + a través de la presentación cruzada de péptidos antigénicos en moléculas MHC de clase I. Los estudios han demostrado que los macrófagos proinflamatorios son capaces de realizar la presentación cruzada de antígenos en moléculas MHC de clase I, pero aún no está claro si la presentación cruzada de macrófagos desempeña un papel en la activación de células T CD8 + vírgenes o de memoria . [27] [49] [41]
Se ha demostrado que los macrófagos secretan las citocinas BAFF y APRIL, que son importantes para el cambio de isotipo de las células plasmáticas. APRIL e IL-6 secretadas por los precursores de los macrófagos en la médula ósea ayudan a mantener la supervivencia de las células plasmáticas alojadas en la médula ósea. [50]
Existen varias formas activadas de macrófagos. [17] A pesar de un espectro de formas de activar los macrófagos, hay dos grupos principales designados M1 y M2 . Macrófagos M1: como se mencionó anteriormente (anteriormente denominados macrófagos activados clásicamente), [52] los macrófagos "asesinos" M1 son activados por LPS e IFN-gamma , y secretan altos niveles de IL-12 y bajos niveles de IL-10 . Los macrófagos M1 tienen funciones proinflamatorias, bactericidas y fagocíticas. [53] Por el contrario, la designación M2 "reparadora" (también denominada macrófagos activados alternativamente) se refiere ampliamente a los macrófagos que funcionan en procesos constructivos como la cicatrización de heridas y la reparación de tejidos, y aquellos que desactivan la activación dañina del sistema inmunológico al producir citocinas antiinflamatorias como IL-10 . M2 es el fenotipo de los macrófagos tisulares residentes y puede elevarse aún más por IL-4 . Los macrófagos M2 producen niveles elevados de IL-10 y TGF-beta y niveles bajos de IL-12. Los macrófagos asociados a tumores son principalmente del fenotipo M2 y parecen promover activamente el crecimiento tumoral. [54]
Los macrófagos existen en una variedad de fenotipos que están determinados por el papel que desempeñan en la maduración de la herida. Los fenotipos se pueden separar predominantemente en dos categorías principales: M1 y M2. Los macrófagos M1 son el fenotipo dominante observado en las primeras etapas de la inflamación y son activados por cuatro mediadores clave: interferón-γ (IFN-γ), factor de necrosis tumoral (TNF) y patrones moleculares asociados al daño (DAMP). Estas moléculas mediadoras crean una respuesta proinflamatoria que, a su vez, produce citocinas proinflamatorias como la interleucina-6 y el TNF. A diferencia de los macrófagos M1, los macrófagos M2 secretan una respuesta antiinflamatoria mediante la adición de interleucina-4 o interleucina-13. También desempeñan un papel en la cicatrización de heridas y son necesarios para la revascularización y la reepitelización. Los macrófagos M2 se dividen en cuatro tipos principales según sus funciones: M2a, M2b, M2c y M2d. La forma en que se determinan los fenotipos M2 aún es tema de discusión, pero los estudios han demostrado que su entorno les permite adaptarse al fenotipo más apropiado para curar la herida de manera eficiente. [53]
Los macrófagos M2 son necesarios para la estabilidad vascular. Producen factor de crecimiento endotelial vascular-A y TGF-β1 . [53] Existe un cambio de fenotipo de macrófagos M1 a M2 en heridas agudas, sin embargo, este cambio se ve afectado en heridas crónicas. Esta desregulación da como resultado una cantidad insuficiente de macrófagos M2 y sus factores de crecimiento correspondientes que ayudan en la reparación de la herida. Con una falta de estos factores de crecimiento/citocinas antiinflamatorias y una sobreabundancia de citocinas proinflamatorias de los macrófagos M1, las heridas crónicas no pueden sanar de manera oportuna. Normalmente, después de que los neutrófilos comen desechos/patógenos, realizan apoptosis y son eliminados. En este punto, la inflamación no es necesaria y M1 experimenta un cambio a M2 (antiinflamatorio). Sin embargo, la desregulación ocurre ya que los macrófagos M1 son incapaces/no fagocitan neutrófilos que han experimentado apoptosis, lo que conduce a un aumento de la migración de macrófagos y la inflamación. [53]
Tanto los macrófagos M1 como los M2 desempeñan un papel en la promoción de la aterosclerosis . Los macrófagos M1 promueven la aterosclerosis mediante la inflamación. Los macrófagos M2 pueden eliminar el colesterol de los vasos sanguíneos, pero cuando el colesterol se oxida, los macrófagos M2 se convierten en células espumosas apoptóticas que contribuyen a la placa ateromatosa de la aterosclerosis. [55] [56]
El primer paso para entender la importancia de los macrófagos en la reparación, el crecimiento y la regeneración muscular es que hay dos "olas" de macrófagos con el inicio del uso del músculo dañado: subpoblaciones que tienen y no tienen una influencia directa en la reparación del músculo. La ola inicial es una población fagocítica que aparece durante períodos de mayor uso muscular que son suficientes para causar lisis de la membrana muscular e inflamación de la membrana, que puede ingresar y degradar el contenido de las fibras musculares lesionadas. [57] [58] [59] Estos macrófagos fagocíticos de invasión temprana alcanzan su concentración más alta aproximadamente 24 horas después del inicio de alguna forma de lesión o recarga de células musculares. [60] Su concentración disminuye rápidamente después de 48 horas. [58] El segundo grupo son los tipos no fagocíticos que se distribuyen cerca de las fibras regenerativas. Estos alcanzan su pico entre dos y cuatro días y permanecen elevados durante varios días mientras el tejido muscular se está reconstruyendo. [58] La primera subpoblación no tiene ningún beneficio directo en la reparación del músculo, mientras que el segundo grupo no fagocítico sí lo tiene.
Se piensa que los macrófagos liberan sustancias solubles que influyen en la proliferación, diferenciación, crecimiento, reparación y regeneración del músculo, pero en este momento se desconoce el factor que se produce para mediar estos efectos. [60] Se sabe que la participación de los macrófagos en la promoción de la reparación tisular no es específica del músculo; se acumulan en numerosos tejidos durante la fase del proceso de curación después de una lesión. [61]
Los macrófagos son esenciales para la cicatrización de heridas . [62] Reemplazan a los neutrófilos polimorfonucleares como células predominantes en la herida el segundo día después de la lesión. [63] Atraídos al sitio de la herida por los factores de crecimiento liberados por las plaquetas y otras células, los monocitos del torrente sanguíneo ingresan al área a través de las paredes de los vasos sanguíneos. [64] La cantidad de monocitos en la herida alcanza su punto máximo entre un día y un día y medio después de que ocurre la lesión. Una vez que están en el sitio de la herida, los monocitos maduran y se convierten en macrófagos. El bazo contiene la mitad de los monocitos del cuerpo en reserva listos para ser desplegados en el tejido lesionado. [65] [66]
La función principal de los macrófagos es fagocitar bacterias y tejido dañado, [62] y también desbridan el tejido dañado liberando proteasas. [67] Los macrófagos también secretan una serie de factores como factores de crecimiento y otras citocinas, especialmente durante el tercer y cuarto día posterior a la herida. Estos factores atraen a la zona a las células implicadas en la etapa de proliferación de la cicatrización. [68] Los macrófagos también pueden restringir la fase de contracción. [69] Los macrófagos son estimulados por el bajo contenido de oxígeno de su entorno para producir factores que inducen y aceleran la angiogénesis [70] y también estimulan las células que reepitelizan la herida, crean tejido de granulación y depositan una nueva matriz extracelular . [71] [ mejor fuente necesaria ] Al secretar estos factores, los macrófagos contribuyen a impulsar el proceso de cicatrización de la herida a la siguiente fase.
Los científicos han descubierto que, además de ingerir restos materiales, los macrófagos participan en la regeneración típica de las extremidades de la salamandra. [72] [73] Descubrieron que la eliminación de los macrófagos de una salamandra dio como resultado un fracaso de la regeneración de las extremidades y una respuesta de cicatrización. [72] [73]
Como se ha descrito anteriormente, los macrófagos desempeñan un papel fundamental en la eliminación de células muertas o moribundas y de restos celulares. Los eritrocitos tienen una vida media de 120 días y, por tanto, los macrófagos del bazo y el hígado los destruyen constantemente. Los macrófagos también engullen macromoléculas y, por tanto, desempeñan un papel fundamental en la farmacocinética de los hierros parenterales . [ cita requerida ]
El hierro que se libera de la hemoglobina se almacena internamente en la ferritina o se libera a la circulación a través de la ferroportina . En los casos en que los niveles sistémicos de hierro están elevados o hay inflamación, los niveles elevados de hepcidina actúan sobre los canales de ferroportina de los macrófagos, lo que hace que el hierro permanezca dentro de los macrófagos. [ cita requerida ]

Los melanófagos son un subconjunto de macrófagos residentes en los tejidos capaces de absorber pigmento, ya sea nativo del organismo o exógeno (como los tatuajes ), del espacio extracelular. A diferencia de los melanocitos dendríticos de la unión , que sintetizan melanosomas y contienen varias etapas de su desarrollo, los melanófagos solo acumulan melanina fagocitada en fagosomas similares a lisosomas. [74] [75] Esto ocurre repetidamente a medida que el pigmento de los macrófagos dérmicos muertos es fagocitado por sus sucesores, preservando el tatuaje en el mismo lugar. [76]
Cada tejido alberga su propia población especializada de macrófagos residentes, que mantienen interconexiones recíprocas con el estroma y el tejido funcional. [77] [78] Estos macrófagos residentes son sésiles (no migratorios), proporcionan factores de crecimiento esenciales para apoyar la función fisiológica del tejido (por ejemplo, la comunicación cruzada entre macrófagos y neuronas en los intestinos), [79] y pueden proteger activamente el tejido del daño inflamatorio. [80]
Los macrófagos asociados a los nervios o NAM son aquellos macrófagos residentes en los tejidos que están asociados a los nervios. Se sabe que algunos de ellos tienen una morfología alargada de hasta 200 μm [81]
Debido a su papel en la fagocitosis, los macrófagos están implicados en muchas enfermedades del sistema inmunitario. Por ejemplo, participan en la formación de granulomas , lesiones inflamatorias que pueden ser causadas por un gran número de enfermedades. Se han descrito, por ejemplo, algunos trastornos, en su mayoría raros, de fagocitosis y función ineficaces de los macrófagos. [82]
En su función de células inmunitarias fagocíticas, los macrófagos se encargan de engullir a los patógenos para destruirlos. Algunos patógenos subvierten este proceso y, en su lugar, viven dentro del macrófago. Esto proporciona un entorno en el que el patógeno se oculta del sistema inmunitario y le permite replicarse. [ cita requerida ]
Las enfermedades que cursan con este tipo de comportamiento incluyen la tuberculosis (causada por Mycobacterium tuberculosis ) y la leishmaniasis (causada por especies de Leishmania ). [ cita requerida ]
Para minimizar la posibilidad de convertirse en el huésped de una bacteria intracelular, los macrófagos han desarrollado mecanismos de defensa como la inducción de óxido nítrico y de intermediarios reactivos de oxígeno, [83] que son tóxicos para los microbios. Los macrófagos también han desarrollado la capacidad de restringir el suministro de nutrientes del microbio e inducir la autofagia . [84]
Una vez engullido por un macrófago, el agente causal de la tuberculosis, Mycobacterium tuberculosis , [85] evita las defensas celulares y utiliza la célula para replicarse. Evidencias recientes sugieren que en respuesta a la infección pulmonar de Mycobacterium tuberculosis , los macrófagos periféricos maduran al fenotipo M1. El fenotipo M1 de los macrófagos se caracteriza por una mayor secreción de citocinas proinflamatorias (IL-1β, TNF-α e IL-6) y un aumento de las actividades glucolíticas esenciales para la eliminación de la infección. [1]
Tras la fagocitosis por parte de un macrófago, el parásito Leishmania se encuentra en una vacuola fagocítica. En circunstancias normales, esta vacuola fagocítica se transformaría en un lisosoma y su contenido sería digerido. Las Leishmania alteran este proceso y evitan ser destruidas; en su lugar, se instalan dentro de la vacuola. [ cita requerida ]
La infección de los macrófagos en las articulaciones se asocia con inflamación local durante y después de la fase aguda de Chikungunya (causada por CHIKV o virus Chikungunya). [86]
El adenovirus (la causa más común de conjuntivitis) puede permanecer latente en un macrófago huésped, con una diseminación viral continua durante 6 a 18 meses después de la infección inicial. [ cita requerida ]
Las especies de Brucella pueden permanecer latentes en un macrófago a través de la inhibición de la fusión fagosoma - lisosoma ; causa brucelosis (fiebre ondulante). [ cita requerida ]
Legionella pneumophila , el agente causante de la enfermedad del legionario , también establece su residencia dentro de los macrófagos. [ cita requerida ]
Los macrófagos son las células predominantes implicadas en la creación de las lesiones progresivas de la placa de la aterosclerosis . [87]
El reclutamiento focal de macrófagos ocurre después del inicio del infarto agudo de miocardio . Estos macrófagos funcionan para eliminar desechos, células apoptóticas y preparar el tejido para la regeneración . [88] Los macrófagos protegen contra la taquicardia ventricular inducida por isquemia en ratones hipocalémicos. [89]
Los macrófagos también desempeñan un papel en la infección por el virus de la inmunodeficiencia humana (VIH). Al igual que las células T , los macrófagos pueden infectarse con el VIH e incluso convertirse en un reservorio de la replicación continua del virus en todo el cuerpo. El VIH puede entrar en el macrófago a través de la unión de gp120 a CD4 y al segundo receptor de membrana, CCR5 (un receptor de quimiocina). Tanto los monocitos circulantes como los macrófagos sirven como reservorio para el virus. [90] Los macrófagos son más capaces de resistir la infección por VIH-1 que las células T CD4+, aunque la susceptibilidad a la infección por VIH difiere entre los subtipos de macrófagos. [91]
Los macrófagos pueden contribuir al crecimiento y progresión tumoral al promover la proliferación e invasión de células tumorales, fomentando la angiogénesis tumoral y suprimiendo las células inmunes antitumorales. [92] [93] Los compuestos inflamatorios, como el factor de necrosis tumoral (TNF)-alfa liberado por los macrófagos activan el interruptor genético factor nuclear-kappa B. NF-κB luego ingresa al núcleo de una célula tumoral y activa la producción de proteínas que detienen la apoptosis y promueven la proliferación celular y la inflamación. [94] Además, los macrófagos sirven como fuente de muchos factores proangiogénicos, incluido el factor endotelial vascular (VEGF), el factor de necrosis tumoral-alfa (TNF-alfa), el factor estimulante de colonias de macrófagos (M-CSF/CSF1) y la IL-1 y la IL-6 , [95] contribuyendo aún más al crecimiento tumoral.
Se ha demostrado que los macrófagos se infiltran en varios tumores. Su número se correlaciona con un mal pronóstico en ciertos cánceres, incluidos los cánceres de mama, cuello uterino, vejiga, cerebro y próstata. [96] [97] Algunos tumores también pueden producir factores, incluidos M-CSF/CSF1, MCP-1/CCL2 y angiotensina II , que desencadenan la amplificación y movilización de macrófagos en los tumores. [98] [99] [100] Además, los macrófagos del seno subcapsular en los ganglios linfáticos que drenan el tumor pueden suprimir la progresión del cáncer al contener la propagación de materiales derivados del tumor. [101]
Los estudios experimentales indican que los macrófagos pueden afectar todas las modalidades terapéuticas, incluyendo la cirugía , la quimioterapia , la radioterapia , la inmunoterapia y la terapia dirigida . [93] [102] [103] Los macrófagos pueden influir en los resultados del tratamiento tanto de forma positiva como negativa. Los macrófagos pueden ser protectores de diferentes maneras: pueden eliminar las células tumorales muertas (en un proceso llamado fagocitosis ) después de los tratamientos que matan estas células; pueden servir como depósitos de fármacos para algunos fármacos contra el cáncer; [104] también pueden ser activados por algunas terapias para promover la inmunidad antitumoral. [105] Los macrófagos también pueden ser perjudiciales de varias maneras: por ejemplo, pueden suprimir varias quimioterapias, [106] [107] radioterapias [108] [109] e inmunoterapias. [110] [111] Debido a que los macrófagos pueden regular la progresión tumoral, actualmente se están probando estrategias terapéuticas para reducir el número de estas células o para manipular sus fenotipos en pacientes con cáncer. [112] [113] Sin embargo, los macrófagos también están involucrados en la citotoxicidad mediada por anticuerpos (ADCC) y se ha propuesto que este mecanismo es importante para ciertos anticuerpos de inmunoterapia contra el cáncer. [114]
Se ha observado que un mayor número de macrófagos proinflamatorios en el tejido adiposo obeso contribuye a las complicaciones de la obesidad, incluida la resistencia a la insulina y la diabetes tipo 2. [115]
Por lo tanto, la modulación del estado inflamatorio de los macrófagos del tejido adiposo se ha considerado un posible objetivo terapéutico para tratar las enfermedades relacionadas con la obesidad. [116] Aunque los macrófagos del tejido adiposo están sujetos al control homeostático antiinflamatorio por la inervación simpática, los experimentos con ratones knock out del gen ADRB2 indican que este efecto se ejerce indirectamente a través de la modulación de la función de los adipocitos, y no a través de la activación directa del receptor adrenérgico Beta-2 , lo que sugiere que la estimulación adrenérgica de los macrófagos puede ser insuficiente para afectar la inflamación o la función del tejido adiposo en la obesidad. [117]
Dentro del tejido graso ( adiposo ) de ratones deficientes en CCR2 , hay un mayor número de eosinófilos , mayor activación de macrófagos alternativos y una propensión a la expresión de citocinas tipo 2. Además, este efecto se exageró cuando los ratones se volvieron obesos debido a una dieta alta en grasas. [118] Esto es causado parcialmente por un cambio de fenotipo de los macrófagos inducido por la necrosis de las células grasas ( adipocitos ). En un individuo obeso, algunos adipocitos estallan y sufren muerte necrótica, lo que hace que los macrófagos M2 residenciales cambien al fenotipo M1. Esta es una de las causas de un estado inflamatorio crónico sistémico de bajo grado asociado con la obesidad. [119] [120]
Aunque su estructura es muy similar a la de los macrófagos tisulares, los macrófagos intestinales han desarrollado características y funciones específicas en función de su entorno natural, que es el tracto digestivo. Los macrófagos y los macrófagos intestinales tienen una gran plasticidad, lo que hace que su fenotipo se vea alterado por sus entornos. [121] Al igual que los macrófagos, los macrófagos intestinales son monocitos diferenciados, aunque los macrófagos intestinales tienen que coexistir con el microbioma de los intestinos. Esto supone un reto teniendo en cuenta que las bacterias que se encuentran en el intestino no se reconocen como "propias" y podrían ser objetivos potenciales de fagocitosis por parte de los macrófagos. [122]
Para evitar la destrucción de las bacterias intestinales, los macrófagos intestinales han desarrollado diferencias clave en comparación con otros macrófagos. Principalmente, los macrófagos intestinales no inducen respuestas inflamatorias. Mientras que los macrófagos tisulares liberan varias citocinas inflamatorias, como IL-1, IL-6 y TNF-α, los macrófagos intestinales no producen ni secretan citocinas inflamatorias. Este cambio es causado directamente por el entorno de los macrófagos intestinales. Las células epiteliales intestinales circundantes liberan TGF-β , que induce el cambio de macrófago proinflamatorio a macrófago no inflamatorio. [122]
Aunque la respuesta inflamatoria está regulada a la baja en los macrófagos intestinales, la fagocitosis aún se lleva a cabo. No hay una caída en la eficiencia de la fagocitosis ya que los macrófagos intestinales pueden fagocitar eficazmente las bacterias, S. typhimurium y E. coli , pero los macrófagos intestinales todavía no liberan citocinas, incluso después de la fagocitosis. Además, los macrófagos intestinales no expresan receptores de lipopolisacáridos (LPS), IgA o IgG. [123] La falta de receptores de LPS es importante para el intestino ya que los macrófagos intestinales no detectan los patrones moleculares asociados a microbios (MAMPS/PAMPS) del microbioma intestinal. Tampoco expresan receptores de factores de crecimiento IL-2 e IL-3. [122]
Se ha demostrado que los macrófagos intestinales desempeñan un papel en la enfermedad inflamatoria intestinal (EII), como la enfermedad de Crohn (EC) y la colitis ulcerosa (CU). En un intestino sano, los macrófagos intestinales limitan la respuesta inflamatoria en el intestino, pero en un estado patológico, la cantidad y la diversidad de macrófagos intestinales se alteran. Esto conduce a la inflamación del intestino y a los síntomas de la enfermedad de la EII. Los macrófagos intestinales son fundamentales para mantener la homeostasis intestinal . La presencia de inflamación o patógenos altera esta homeostasis y, al mismo tiempo, altera los macrófagos intestinales. [124] Todavía no se ha determinado un mecanismo para la alteración de los macrófagos intestinales mediante el reclutamiento de nuevos monocitos o cambios en los macrófagos intestinales ya presentes. [123]
Además, un nuevo estudio revela que los macrófagos limitan el acceso del hierro a las bacterias al liberar vesículas extracelulares, lo que mejora los resultados de la sepsis. [125]
Los macrófagos fueron descubiertos por primera vez a finales del siglo XIX por Élie Metchnikoff . [126] Élie Metchnikoff revolucionó la rama de los macrófagos al combinar conocimientos filosóficos y el estudio evolutivo de la vida. [127] Más tarde, Van Furth durante la década de 1960 propuso la idea de que los monocitos sanguíneos circulantes en adultos permitieron el origen de todos los macrófagos tisulares. [128] En los últimos años, la publicación sobre los macrófagos ha llevado a la gente a creer que múltiples macrófagos tisulares residentes son independientes de los monocitos sanguíneos, ya que se forman durante la etapa embrionaria del desarrollo. [129] En el siglo XXI, todas las ideas sobre el origen de los macrófagos (presentes en los tejidos) se compilan para sugerir que los organismos fisiológicamente complejos forman macrófagos de forma independiente mediante mecanismos que no tienen que depender de los monocitos sanguíneos. [130]
Los macrófagos están presentes esencialmente en todos los tejidos, comenzando con el desarrollo embrionario y, además de su papel en la defensa del huésped y en la eliminación de células apoptóticas, cada vez se reconocen más por su función trófica y su papel en la regeneración.
=Monocitos/macrófagos. A menos que los estímulos para el reclutamiento de neutrófilos persistan en el sitio de la herida, la infiltración de neutrófilos cesa después de unos días, y los neutrófilos gastados son fagocitados por los macrófagos, que están presentes en el lado de la herida dentro de los 2 días posteriores a la lesión.
Los investigadores han identificado una célula que ayuda a la regeneración de las extremidades en las salamandras. Los macrófagos son un tipo de célula reparadora que devora células muertas y patógenos, y activa otras células inmunes para responder a los patógenos.