

La citocinesis ( / ˌ s aɪ t oʊ k ɪ ˈ n iː s ɪ s / ) es la parte del proceso de división celular y parte de la mitosis durante la cual el citoplasma de una sola célula eucariota se divide en dos células hijas. La división citoplasmática comienza durante o después de las últimas etapas de la división nuclear en la mitosis y la meiosis . Durante la citocinesis, el aparato del huso se divide y transporta las cromátidas duplicadas al citoplasma de las células hijas que se separan . De este modo garantiza que el número de cromosomas y el complemento se mantengan de una generación a la siguiente y que, excepto en casos especiales, las células hijas serán copias funcionales de la célula madre. Después de completarse la telofase y la citocinesis, cada célula hija ingresa a la interfase del ciclo celular .
Funciones particulares exigen diversas desviaciones del proceso de citocinesis simétrica; por ejemplo en la ovogénesis en animales el óvulo ocupa casi todo el citoplasma y orgánulos . Esto deja muy poco para los cuerpos polares resultantes , que en la mayoría de las especies mueren sin funcionar, aunque en otras especies asumen varias funciones especiales. [1] Otra forma de mitosis ocurre en tejidos como el hígado y el músculo esquelético ; omite la citocinesis, lo que produce células multinucleadas ( ver sincitio ).
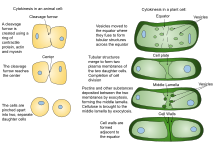
La citocinesis vegetal se diferencia de la citocinesis animal, en parte debido a la rigidez de las paredes celulares de las plantas. En lugar de que las células vegetales formen un surco de escisión como el que se desarrolla entre las células hijas de los animales, se forma una estructura divisoria conocida como placa celular en el citoplasma y crece hasta formar una nueva pared celular duplicada entre las células hijas de las plantas. Divide la célula en dos células hijas.
La citocinesis se parece en gran medida al proceso procariótico de fisión binaria , pero debido a las diferencias entre las estructuras y funciones de las células procarióticas y eucariotas, los mecanismos difieren. Por ejemplo, una célula bacteriana tiene un cromosoma circular (un cromosoma único en forma de bucle cerrado), a diferencia de los cromosomas lineales , generalmente múltiples, de los eucariotas. En consecuencia, las bacterias no construyen ningún huso mitótico durante la división celular. Además, la duplicación del ADN procariótico tiene lugar durante la separación real de los cromosomas; En la mitosis, la duplicación tiene lugar durante la interfase antes de que comience la mitosis, aunque las cromátidas hijas no se separan completamente antes de la anafase .
La palabra "citocinesis" ( / ˌ s aɪ t oʊ k aɪ ˈ n iː s ɪ s , - t ə -, - k ə -/ [2] [3] ) utiliza formas combinadas de cito- + kine- + -sis , neolatino del latín clásico y del griego antiguo , que refleja " célula " y kinesis ("movimiento, movimiento"). Fue acuñado por Charles Otis Whitman en 1887. [4]
El origen de este término es del griego κύτος ( kytos , un hueco), derivado latino cyto (celular), griego κίνησις ( kínesis , movimiento).
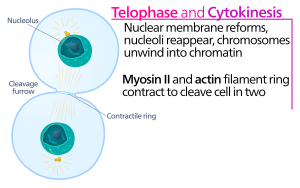
La citocinesis de las células animales comienza poco después del inicio de la separación de las cromátidas hermanas en la anafase de la mitosis . El proceso se puede dividir en los siguientes pasos distintos: reorganización del huso en anafase, especificación del plano de división, ensamblaje y contracción del anillo de actina-miosina y abscisión. [5] La fiel partición del genoma en células hijas emergentes se garantiza mediante la estrecha coordinación temporal de los eventos individuales anteriores mediante vías de señalización molecular.
La citocinesis de las células animales comienza con la estabilización de los microtúbulos y la reorganización del huso mitótico para formar el huso central. El huso central (o zona media del huso ) se forma cuando fibras de microtúbulos no cinetocoros se agrupan entre los polos del huso. Varias especies diferentes, incluidas H. sapiens , D. melanogaster y C. elegans, requieren el huso central para sufrir citocinesis de manera eficiente, aunque el fenotipo específico asociado con su ausencia varía de una especie a otra (por ejemplo, ciertas células de Drosophila). Los tipos son incapaces de formar un surco de escisión sin el huso central, mientras que tanto en embriones de C. elegans como en células de cultivo de tejidos humanos se observa que se forma e ingresa un surco de escisión, pero luego regresa antes de que se complete la citocinesis). El proceso de reorganización del huso mitótico y formación del huso central es causado por la disminución de la actividad de CDK1 durante la anafase. [5] La disminución de la actividad de CDK1 en la transición metafase-anafase conduce a la desfosforilación de sitios inhibidores en múltiples componentes del huso central. En primer lugar, la eliminación de una fosforilación de CDK1 de una subunidad del CPC (el complejo cromosómico pasajero) permite su translocalización al huso central desde los centrómeros, donde se localiza durante la metafase. Además de ser un componente estructural del propio huso central, el CPC también desempeña un papel en la fosforregulación de otros componentes del huso central, incluido PRC1 (proteína agrupadora de microtúbulos necesaria para la citocinesis 1) y MKLP1 (una proteína motora de cinesina). Originalmente inhibido por la fosforilación mediada por CDK1, PRC1 ahora puede formar un homodímero que se une selectivamente a la interfaz entre microtúbulos antiparalelos, facilitando la organización espacial de los microtúbulos del huso central. MKLP1, junto con la proteína activadora de GTPasa de la familia Rho CYK-4 (también denominada MgcRacGAP), forma el complejo centralspindlin. Centralspindlin se une al huso central como grupos de orden superior. La formación del grupo de centralspindlin es promovida por la fosforilación de MLKP1 por Aurora B, un componente de CPC. En resumen, el autoensamblaje del huso central se inicia a través de la fosforregulación de múltiples componentes del huso central por la disminución de la actividad de CDK1, ya sea directa o indirectamente, en la transición metafase-anafase. El huso central puede tener múltiples funciones en la citocinesis, incluido el control de la posición del surco de escisión, la entrega de vesículas de membrana al surco de escisión y la formación de la estructura de la parte media del cuerpo que se requiere para los pasos finales de la división. [6]
El segundo paso de la citocinesis de las células animales implica la especificación del plano de división y la formación de surcos citocinéticos. El posicionamiento preciso del plano de división entre las dos masas de cromosomas segregados es esencial para evitar la pérdida de cromosomas. Mientras tanto, el mecanismo por el cual el huso determina el plano de división en las células animales es quizás el misterio más persistente de la citocinesis y un tema de intenso debate. Existen tres hipótesis de inducción de surcos. [6] La primera es la hipótesis de la estimulación astral, que postula que los microtúbulos astrales de los polos del huso transportan una señal que induce surcos a la corteza celular, donde las señales de dos polos se enfocan de alguna manera en un anillo en el huso. Una segunda posibilidad, denominada hipótesis del huso central, es que el surco de escisión sea inducido por un estímulo positivo que se origina en el ecuador del huso central. El huso central puede contribuir a la especificación del plano de división al promover la concentración y activación de la pequeña GTPasa RhoA en la corteza ecuatorial. Una tercera hipótesis es la de la relajación astral. Postula que los haces activos de actina-miosina se distribuyen por toda la corteza celular y la inhibición de su contracción cerca de los polos del huso da como resultado un gradiente de actividad contráctil que es mayor en el punto medio entre los polos. En otras palabras, los microtúbulos astrales generan una señal negativa que aumenta la relajación cortical cerca de los polos. Estudios genéticos y de micromanipulación láser en embriones de C. elegans han demostrado que el huso envía dos señales redundantes a la corteza celular, una procedente del huso central y una segunda señal derivada del aster del huso, lo que sugiere la implicación de múltiples mecanismos combinados en la colocación del surco de escisión. El predominio de una señal particular varía entre tipos de células y organismos. Y es posible que se requiera multitud y redundancia parcial de señales para hacer que el sistema sea robusto y aumentar la precisión espacial. [5]
En el surco de escisión de la citocinesis , es el anillo contráctil de actina-miosina el que impulsa el proceso de escisión, durante el cual la membrana y la pared celular crecen hacia adentro, lo que eventualmente pellizca a la célula madre en dos. Los componentes clave de este anillo son la proteína filamentosa actina y la proteína motora miosina II. El anillo contráctil se ensambla ecuatorialmente (en el medio de la célula) en la corteza celular (adyacente a la membrana celular). La familia de proteínas Rho (proteína RhoA en células de mamíferos) es un regulador clave de la formación y contracción de anillos contráctiles en células animales. [6] La vía RhoA promueve el ensamblaje del anillo de actina-miosina mediante dos efectores principales. Primero, RhoA estimula la nucleación de filamentos de actina no ramificados mediante la activación de forminas relacionadas con Diáfano. Esta generación local de nuevos filamentos de actina es importante para la formación del anillo contráctil. [6] Este proceso de formación de filamentos de actina también requiere una proteína llamada profilina, que se une a los monómeros de actina y ayuda a cargarlos en el extremo del filamento. En segundo lugar, RhoA promueve la activación de la miosina II por la quinasa ROCK, que activa la miosina II directamente mediante la fosforilación de la cadena ligera de miosina y también inhibe la miosina fosfatasa mediante la fosforilación de la subunidad dirigida a la fosfatasa MYPT. Además de actina y miosina II, el anillo contráctil contiene la proteína de andamiaje anilina. La anilina se une a la actina, la miosina, la RhoA y la CYK-4 y, por lo tanto, vincula la corteza ecuatorial con las señales del huso central. También contribuye a la unión del anillo de actina-miosina a la membrana plasmática. Además, la anilina genera fuerzas contráctiles rectificando las fluctuaciones térmicas. [7] También se ha especulado que otra proteína, la septina, sirve como andamio estructural sobre el cual se organiza el aparato de citocinesis. Después de su ensamblaje, la contracción del anillo de actina-miosina conduce al ingreso de la membrana plasmática adherida, que divide el citoplasma en dos dominios de células hermanas emergentes. La fuerza para los procesos contráctiles se genera mediante movimientos a lo largo de la actina por parte de la proteína motora miosina II. La miosina II utiliza la energía libre liberada cuando se hidroliza el ATP para moverse a lo largo de estos filamentos de actina, constriñendo la membrana celular para formar un surco de escisión . La hidrólisis continua hace que este surco de escisión ingrese (se mueva hacia adentro), un proceso sorprendente que es claramente visible a través de un microscopio óptico .
El surco citocinético ingresa hasta que se forma una estructura en la parte media del cuerpo (compuesta de material proteico denso en electrones), donde el anillo de actina-miosina ha alcanzado un diámetro de aproximadamente 1 a 2 μm. La mayoría de los tipos de células animales permanecen conectadas por un puente citocinético intercelular durante varias horas hasta que se dividen mediante un proceso independiente de actina denominado abscisión, el último paso de la citocinesis. [5] [8]
El proceso de abscisión divide físicamente la parte media del cuerpo en dos. La abscisión se produce mediante la eliminación de estructuras citoesqueléticas del puente citocinético, la constricción de la corteza celular y la fisión de la membrana plasmática. El puente intercelular está lleno de densos haces de microtúbulos antiparalelos que derivan del huso central. Estos microtúbulos se superponen en la parte media del cuerpo, que generalmente se cree que es una plataforma de destino para la maquinaria de abscisión.
La proteína espastina que corta los microtúbulos es en gran medida responsable del desmontaje de los haces de microtúbulos dentro del puente intercelular. La constricción cortical completa también requiere la eliminación de las estructuras citoesqueléticas subyacentes. El desmontaje del filamento de actina durante la citocinesis tardía depende del complejo PKCε-14-3-3, que inactiva RhoA después de la entrada al surco. El desmontaje de actina está controlado además por la GTPasa Rab35 y su efector, la fosfatidilinositol-4,5-bisfosfato 5-fosfatasa OCRL. Comprender el mecanismo por el cual la membrana plasmática finalmente se divide requiere más investigación.
La citocinesis debe controlarse temporalmente para garantizar que se produzca sólo después de que las cromátidas hermanas se separen durante la anafase de las divisiones celulares proliferativas normales. Para lograr esto, muchos componentes de la maquinaria de citocinesis están altamente regulados para garantizar que puedan realizar una función particular solo en una etapa particular del ciclo celular . [9] [10] La citocinesis ocurre solo después de que APC se une a CDC20. [ cita necesaria ] Esto permite que la separación de cromosomas y miosina funcione simultáneamente.
Después de la citocinesis, los microtúbulos no cinetocoros se reorganizan y desaparecen en un nuevo citoesqueleto a medida que el ciclo celular vuelve a la interfase (ver también ciclo celular ).
Debido a la presencia de una pared celular , la citocinesis en las células vegetales es significativamente diferente de la de las células animales. En lugar de formar un anillo contráctil, las células vegetales construyen una placa celular en el medio de la célula. Las etapas de la formación de la placa celular incluyen (1) la creación del fragmoplasto , una serie de microtúbulos que guían y sostienen la formación de la placa celular ; (2) tráfico de vesículas al plano de división y su fusión para generar una red tubular-vesicular; (3) fusión continua de los túbulos de la membrana y su transformación en láminas de membrana tras el depósito de callosa , seguido del depósito de celulosa y otros componentes de la pared celular ; (4) reciclaje del exceso de membrana y otros materiales de la placa celular ; y (5) fusión con la pared celular parental [11] [12]
El fragmoplasto se ensambla a partir de los restos del huso mitótico y sirve como vía para el tráfico de vesículas hacia la zona media del fragmoplasto. Estas vesículas contienen lípidos, proteínas y carbohidratos necesarios para la formación de un nuevo límite celular. Los estudios de tomografía electrónica han identificado el aparato de Golgi como la fuente de estas vesículas, [13] [14] pero otros estudios han sugerido que también contienen material endocitosado. [15] [16]
Estos túbulos luego se ensanchan y se fusionan lateralmente entre sí, formando finalmente una lámina plana fenestrada [8] . A medida que la placa celular madura, se eliminan grandes cantidades de material de membrana mediante endocitosis mediada por clatrina [7] . Finalmente, los bordes de la placa celular se fusionan con la membrana plasmática parental , a menudo de forma asimétrica, [17] completando así la citocinesis. Las fenestras restantes contienen hebras de retículo endoplásmico que las atraviesan y se cree que son las precursoras de los plasmodesmos [8] .
La construcción de la nueva pared celular comienza dentro de la luz de los túbulos estrechos de la placa celular joven . El orden en el que se depositan los diferentes componentes de la pared celular se ha determinado en gran medida mediante microscopía inmunoelectrónica. Los primeros componentes en llegar son pectinas , hemicelulosas y proteínas arabinogalactanos transportadas por las vesículas secretoras que se fusionan para formar la placa celular. [18] El siguiente componente que se agregará es la callosa , que se polimeriza directamente en la placa celular mediante callosa sintasas. A medida que la placa celular continúa madurando y se fusiona con la membrana plasmática parental, la callosa se reemplaza lentamente con celulosa , el componente principal de una pared celular madura [6] . La laminilla media (una capa similar a un pegamento que contiene pectina) se desarrolla a partir de la placa celular y sirve para unir las paredes celulares de las células contiguas. [19] [20]
El ingreso citocinético del surco está impulsado por la miosina ATPasa tipo II . Dado que las miosinas se reclutan en la región medial, las fuerzas contráctiles que actúan sobre la corteza se asemejan a una constricción en forma de "monedero" que tira hacia adentro. Esto conduce a la constricción interior. La membrana plasmática en virtud de su estrecha asociación con la corteza a través de proteínas reticulantes [21] Para la constricción del surco de escisión, se debe aumentar el área de superficie total suministrando la membrana plasmática a través de exocitosis. [22]
Los modelos teóricos muestran que la constricción simétrica requiere tanto de estabilización lateral como de fuerzas de constricción. [23] La reducción de la presión externa y de la tensión superficial (mediante el tráfico de membranas) reduce las fuerzas de estabilización y constricción requeridas.
CEP55 es una fosfoproteína mitótica que desempeña un papel clave en la citocinesis, la etapa final de la división celular. [24] [25]
En algunos casos, una célula puede dividir su material genético y aumentar de tamaño, pero no logra experimentar citocinesis. Esto da como resultado células más grandes con más de un núcleo. Por lo general, se trata de una aberración no deseada y puede ser un signo de células cancerosas. [26]