El ácido nítrico es un compuesto inorgánico con la fórmula H N O 3 . Es un ácido mineral altamente corrosivo . [6] El compuesto es incoloro, pero las muestras tienden a adquirir un tono amarillo con el tiempo debido a la descomposición en óxidos de nitrógeno . La mayoría del ácido nítrico disponible comercialmente tiene una concentración del 68% en agua. Cuando la solución contiene más del 86% de HNO 3 , se denomina ácido nítrico fumante . Dependiendo de la cantidad de dióxido de nitrógeno presente, el ácido nítrico fumante se caracteriza además como ácido nítrico fumante rojo en concentraciones superiores al 86%, o ácido nítrico fumante blanco en concentraciones superiores al 95%.
El ácido nítrico es el principal reactivo utilizado para la nitración (la adición de un grupo nitro , generalmente a una molécula orgánica ). Si bien algunos compuestos nitro resultantes son explosivos sensibles a los golpes y al calor , unos pocos son lo suficientemente estables como para usarse en municiones y demoliciones, mientras que otros son aún más estables y se usan como tintes sintéticos y medicamentos (por ejemplo , metronidazol ). El ácido nítrico también se usa comúnmente como un fuerte agente oxidante .
En general, se cree que el descubrimiento de ácidos minerales como el ácido nítrico se remonta a la alquimia europea del siglo XIII . [7] La opinión convencional es que el ácido nítrico fue descrito por primera vez en De inventione veritatis ("Sobre el descubrimiento de la verdad", de pseudo-Geber , después de c. 1300 ). [8]
Sin embargo, según Eric John Holmyard y Ahmad Y. al-Hassan , el ácido nítrico también aparece en varias obras árabes anteriores , como el Ṣundūq al-ḥikma ("Cofre de la sabiduría") atribuido a Jabir ibn Hayyan (siglo VIII) o el Taʿwīdh al-Ḥākim atribuido al califa fatimí al-Hakim bi-Amr Allah (985-1021). [9]
La receta del Ṣundūq al-ḥikma atribuida a Jabir ha sido traducida de la siguiente manera: [10] [11]
Toma cinco partes de flores de nitro puro , tres partes de vitriolo de Chipre y dos partes de alumbre del Yemen . Tritúralas bien, por separado, hasta que queden como polvo y luego colócalas en un matraz. Tapa este último con una fibra de palma y acóplale un recipiente de vidrio. Luego invierte el aparato y calienta la parte superior (es decir, el matraz que contiene la mezcla) a fuego lento. Por el calor fluirá hacia abajo un aceite como la mantequilla de vaca.
El ácido nítrico también se encuentra en obras posteriores a 1300 atribuidas falsamente a Alberto Magno y Ramon Llull (ambos del siglo XIII). Estas obras describen la destilación de una mezcla que contiene nitro y vitriolo verde , a la que llaman "agua fuerte" (aqua fortis). [12] [13] [14]
En el siglo XVII, Johann Rudolf Glauber ideó un proceso para obtener ácido nítrico destilando nitrato de potasio con ácido sulfúrico. En 1776, Antoine Lavoisier citó el trabajo de Joseph Priestley para señalar que se puede convertir a partir de óxido nítrico (al que llama "aire nitroso"), "combinado con un volumen aproximadamente igual de la parte más pura del aire común, y con una cantidad considerable de agua". [15] [a] En 1785, Henry Cavendish determinó su composición precisa y demostró que se podía sintetizar haciendo pasar una corriente de chispas eléctricas a través del aire húmedo . [12] En 1806, Humphry Davy informó los resultados de extensos experimentos de electrólisis de agua destilada y concluyó que el ácido nítrico se producía en el ánodo a partir del gas nitrógeno atmosférico disuelto. Utilizó una batería de alto voltaje y electrodos y recipientes no reactivos, como conos de electrodos de oro que funcionaban también como recipientes puenteados por amianto húmedo. [16]
La producción industrial de ácido nítrico a partir del aire atmosférico comenzó en 1905 con el proceso Birkeland-Eyde , también conocido como proceso de arco. [17] Este proceso se basa en la oxidación del nitrógeno atmosférico por el oxígeno atmosférico a óxido nítrico con un arco eléctrico de temperatura muy alta. Se obtuvieron rendimientos de hasta aproximadamente 4-5% de óxido nítrico a 3000 °C, y menos a temperaturas más bajas. [17] [18] El óxido nítrico se enfrió y oxidó por el oxígeno atmosférico restante a dióxido de nitrógeno, y este se absorbió posteriormente en agua en una serie de torres de absorción de columna de platos o de columna de relleno para producir ácido nítrico diluido. Las primeras torres burbujearon el dióxido de nitrógeno a través de agua y fragmentos de cuarzo no reactivos. Aproximadamente el 20% de los óxidos de nitrógeno producidos permanecieron sin reaccionar, por lo que las torres finales contenían una solución alcalina para neutralizar el resto. [19] El proceso era muy intensivo en energía y fue reemplazado rápidamente por el proceso Ostwald una vez que se dispuso de amoníaco barato.
Otro método de producción temprano fue inventado por el ingeniero francés Albert Nodon alrededor de 1913. Su método producía ácido nítrico a partir de la electrólisis del nitrato de calcio convertido por bacterias a partir de materia nitrogenada en turberas. Una olla de barro rodeada de piedra caliza se hundía en la turba y se fijaba con estacas de madera alquitranada para hacer un compartimento para el ánodo de carbono alrededor del cual se forma el ácido nítrico. El ácido nítrico se bombeaba desde una tubería de barro [20] que se hundía hasta el fondo de la olla. Se bombeaba agua fresca hacia la parte superior a través de otra tubería de barro para reemplazar el fluido eliminado. El interior se llenaba con coque . Los cátodos de hierro fundido se hundían en la turba que lo rodeaba. La resistencia era de unos 3 ohmios por metro cúbico y la energía suministrada era de unos 10 voltios. La producción de un depósito era de 800 toneladas por año. [20] [21]
Una vez que en 1913 se introdujo el proceso Haber para la producción eficiente de amoníaco, la producción de ácido nítrico a partir de amoníaco mediante el proceso Ostwald superó a la producción mediante el proceso Birkeland-Eyde. Este método de producción todavía se utiliza en la actualidad.
El ácido nítrico disponible comercialmente es un azeótropo con agua a una concentración de 68% de HNO3 . Esta solución tiene una temperatura de ebullición de 120,5 °C (249 °F) a 1 atm. Se conoce como "ácido nítrico concentrado". El azeótropo de ácido nítrico y agua es un líquido incoloro a temperatura ambiente.
Se conocen dos hidratos sólidos: el monohidrato HNO 3 ·H 2 O o nitrato de oxonio [H 3 O] + [NO 3 ] − y el trihidrato HNO 3 ·3H 2 O .
Ocasionalmente se observa una escala de densidad más antigua, con ácido nítrico concentrado especificado como 42 Baumé . [22]

El ácido nítrico está sujeto a descomposición térmica o lumínica y por este motivo se solía almacenar en botellas de vidrio marrón:
Esta reacción puede dar lugar a algunas variaciones no despreciables en la presión de vapor sobre el líquido porque los óxidos de nitrógeno producidos se disuelven parcial o totalmente en el ácido.
El dióxido de nitrógeno ( NO2 ) y/o el tetróxido de dinitrógeno ( N2O4 ) permanecen disueltos en el ácido nítrico , coloreándolo de amarillo o incluso rojo a temperaturas más altas. Mientras que el ácido puro tiende a emitir vapores blancos cuando se expone al aire, el ácido con dióxido de nitrógeno disuelto emite vapores de color marrón rojizo, lo que da lugar a los nombres comunes de "ácido nítrico fumante rojo" y "ácido nítrico fumante blanco". Los óxidos de nitrógeno ( NOx ) son solubles en ácido nítrico.
El ácido nítrico fumante de calidad comercial contiene 98% de HNO3 y tiene una densidad de 1,50 g/cm3 . Este grado se utiliza a menudo en la industria de los explosivos. No es tan volátil ni tan corrosivo como el ácido anhidro y tiene una concentración aproximada de 21,4 M.
El ácido nítrico fumante rojo , o RFNA, contiene cantidades sustanciales de dióxido de nitrógeno disuelto ( NO 2 ), lo que hace que la solución adquiera un color marrón rojizo. Debido al dióxido de nitrógeno disuelto, la densidad del ácido nítrico fumante rojo es menor, 1,490 g/cm 3 .
Se puede preparar ácido nítrico fumante inhibido, ya sea ácido nítrico fumante inhibido blanco (IWFNA) o ácido nítrico fumante inhibido rojo (IRFNA), mediante la adición de 0,6 a 0,7 % de fluoruro de hidrógeno (HF). Este fluoruro se agrega para brindar resistencia a la corrosión en tanques de metal. El fluoruro crea una capa de fluoruro metálico que protege el metal.
El ácido nítrico fumante blanco, ácido nítrico puro o WFNA, es muy parecido al ácido nítrico anhidro. Está disponible como ácido nítrico al 99,9 % por ensayo, o aproximadamente 24 molar . Una especificación para el ácido nítrico fumante blanco es que tiene un máximo de 2 % de agua y un máximo de 0,5 % de NO 2 disuelto . El ácido nítrico anhidro es un líquido incoloro, de baja viscosidad (móvil) con una densidad de 1,512–3 g/cm 3 que se solidifica a −42 °C (−44 °F) para formar cristales blancos. [ cita requerida ] Su viscosidad dinámica en condiciones estándar es de 0,76 cP. [23] A medida que se descompone en NO 2 y agua, obtiene un tinte amarillo. Hierve a 83 °C (181 °F). Generalmente se almacena en una botella de vidrio ámbar irrompible con el doble de volumen de espacio libre para permitir la acumulación de presión, pero incluso con esas precauciones la botella debe ventilarse mensualmente para liberar la presión.
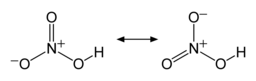
Los dos enlaces terminales N–O son casi equivalentes y relativamente cortos, de 1,20 y 1,21 Å. [24] Esto se puede explicar mediante teorías de resonancia ; las dos formas canónicas principales muestran algún carácter de doble enlace en estos dos enlaces, lo que hace que sean más cortos que los enlaces simples N–O . El tercer enlace N–O es alargado porque su átomo de O está unido al átomo de H, [25] [26] con una longitud de enlace de 1,41 Å en la fase gaseosa. [24] La molécula es ligeramente aplanar (los planos NO2 y NOH están inclinados uno respecto del otro 2°) y hay una rotación restringida alrededor del enlace simple N–OH. [6] [27]
El ácido nítrico se considera normalmente un ácido fuerte a temperatura ambiente. Existe cierto desacuerdo sobre el valor de la constante de disociación del ácido, aunque el valor p K a suele indicarse como inferior a −1. Esto significa que el ácido nítrico en solución diluida está completamente disociado, excepto en soluciones extremadamente ácidas. El valor p K a aumenta a 1 a una temperatura de 250 °C. [28]
El ácido nítrico puede actuar como base con respecto a un ácido como el ácido sulfúrico :
El ion nitronio , [NO 2 ] + , es el reactivo activo en las reacciones de nitración aromática . Como el ácido nítrico tiene propiedades tanto ácidas como básicas, puede experimentar una reacción de autoprotólisis, similar a la autoionización del agua :
El ácido nítrico reacciona con la mayoría de los metales, pero los detalles dependen de la concentración del ácido y de la naturaleza del metal. El ácido nítrico diluido se comporta como un ácido típico en su reacción con la mayoría de los metales. El magnesio , el manganeso y el zinc liberan H2 :
El ácido nítrico puede oxidar metales no activos como el cobre y la plata . Con estos metales no activos o menos electropositivos, los productos dependen de la temperatura y la concentración de ácido. Por ejemplo, el cobre reacciona con ácido nítrico diluido a temperatura ambiente con una estequiometría de 3:8:
El óxido nítrico producido puede reaccionar con el oxígeno atmosférico para dar dióxido de nitrógeno . Con ácido nítrico más concentrado, el dióxido de nitrógeno se produce directamente en una reacción con una estequiometría de 1:4:
Al reaccionar con ácido nítrico, la mayoría de los metales dan los nitratos correspondientes . Algunos metaloides y metales dan los óxidos ; por ejemplo, Sn , As , Sb y Ti se oxidan en SnO 2 , As 2 O 5 , Sb 2 O 5 y TiO 2 respectivamente. [29]
Algunos metales preciosos , como el oro puro y los metales del grupo del platino, no reaccionan con el ácido nítrico, aunque el oro puro sí reacciona con agua regia , una mezcla de ácido nítrico concentrado y ácido clorhídrico . Sin embargo, algunos metales menos nobles ( Ag , Cu , ...) presentes en algunas aleaciones de oro relativamente pobres en oro, como el oro coloreado , pueden oxidarse y disolverse fácilmente con el ácido nítrico, lo que provoca cambios de color en la superficie de la aleación de oro. El ácido nítrico se utiliza como un medio barato en las joyerías para detectar rápidamente aleaciones con bajo contenido de oro (<14 quilates ) y evaluar rápidamente la pureza del oro.
Al ser un potente agente oxidante, el ácido nítrico reacciona con muchos compuestos no metálicos, a veces de forma explosiva. Dependiendo de la concentración de ácido, la temperatura y el agente reductor involucrado, los productos finales pueden ser variables. La reacción tiene lugar con todos los metales excepto la serie de metales nobles y ciertas aleaciones . Como regla general, las reacciones oxidantes ocurren principalmente con el ácido concentrado, favoreciendo la formación de dióxido de nitrógeno ( NO 2 ). Sin embargo, las potentes propiedades oxidantes del ácido nítrico son de naturaleza termodinámica , pero a veces sus reacciones de oxidación son más bien cinéticamente desfavorecidas. La presencia de pequeñas cantidades de ácido nitroso ( HNO 2 ) aumenta en gran medida la velocidad de reacción. [29]
Aunque el cromo (Cr), el hierro (Fe) y el aluminio (Al) se disuelven fácilmente en ácido nítrico diluido, el ácido concentrado forma una capa de óxido metálico que protege la mayor parte del metal de una mayor oxidación. La formación de esta capa protectora se denomina pasivación . [29] Las concentraciones típicas de pasivación varían del 20% al 50% en volumen. [30] [ cita completa requerida ] Los metales que se pasivan con ácido nítrico concentrado son hierro , cobalto , cromo , níquel y aluminio . [29]
El ácido nítrico, al ser un potente ácido oxidante , reacciona con muchos materiales orgánicos y las reacciones pueden ser explosivas. El grupo hidroxilo normalmente elimina un hidrógeno de la molécula orgánica para formar agua, y el grupo nitro restante ocupa el lugar del hidrógeno. La nitración de compuestos orgánicos con ácido nítrico es el método principal de síntesis de muchos explosivos comunes, como la nitroglicerina y el trinitrotolueno (TNT). Como es posible que se produzcan muchos subproductos menos estables, estas reacciones deben controlarse térmicamente con cuidado y los subproductos deben eliminarse para aislar el producto deseado.
La reacción con elementos no metálicos, con excepción del nitrógeno, el oxígeno, los gases nobles , el silicio y los halógenos distintos del yodo, generalmente los oxida a sus estados de oxidación más altos como ácidos con la formación de dióxido de nitrógeno para el ácido concentrado y óxido nítrico para el ácido diluido.
El ácido nítrico concentrado oxida I 2 , P 4 y S 8 en HIO 3 , H 3 PO 4 y H 2 SO 4 , respectivamente. [29] Aunque reacciona con grafito y carbono amorfo, no reacciona con el diamante; puede separar el diamante del grafito que oxida. [31]
El ácido nítrico reacciona con las proteínas para formar productos nitrados de color amarillo. Esta reacción se conoce como reacción xantoproteica . Esta prueba se lleva a cabo añadiendo ácido nítrico concentrado a la sustancia que se está probando y luego calentando la mezcla. Si hay proteínas que contienen aminoácidos con anillos aromáticos , la mezcla se vuelve amarilla. Al añadir una base como el amoníaco , el color se vuelve naranja. Estos cambios de color son causados por anillos aromáticos nitrados en la proteína. [32] [33] El ácido xantoproteico se forma cuando el ácido entra en contacto con las células epiteliales . Los respectivos cambios de color de la piel local son indicativos de precauciones de seguridad inadecuadas al manipular ácido nítrico.
La producción industrial de ácido nítrico utiliza el proceso Ostwald . Los procesos combinados de Ostwald y Haber son extremadamente eficientes y requieren únicamente aire y gas natural como materia prima . [34]
La innovación técnica del proceso de Ostwald son las condiciones adecuadas en las que el amoníaco anhidro se quema para formar óxido nítrico (NO) en lugar de dinitrógeno ( N 2 ). [34] [35] El óxido nítrico se oxida luego, a menudo con oxígeno atmosférico , para formar dióxido de nitrógeno ( NO 2 ):
El dióxido luego se desproporciona en agua en ácido nítrico y la materia prima de óxido nítrico:
La reacción neta es la oxidación máxima del amoniaco:
Los óxidos de nitrógeno disueltos se eliminan (en el caso del ácido nítrico fumante blanco) o permanecen en solución para formar ácido nítrico fumante rojo .
Las soluciones de ácido nítrico de grado comercial suelen tener entre un 52% y un 68% de ácido nítrico en masa, la concentración máxima destilable . Se puede lograr una mayor deshidratación hasta el 98% con H 2 SO 4 concentrado . [34] [36] Históricamente, también se producían concentraciones más altas de ácido disolviendo dióxido de nitrógeno adicional en el ácido, pero la última planta en los Estados Unidos dejó de utilizar ese proceso en 2012. [36]
Más recientemente, se han desarrollado medios electroquímicos para producir ácido anhidro a partir de materia prima de ácido nítrico concentrado. [37]
Existen numerosas síntesis de ácido nítrico a escala de laboratorio, la mayoría de las cuales se inspiran en técnicas industriales.
Una amplia variedad de sales de nitrato metatizan con ácido sulfúrico (H2SO4 ) , por ejemplo, el nitrato de sodio :
Luego, la destilación a 83 °C, el punto de ebullición del ácido nítrico, separa el residuo sólido de sal metálica. [26] La solución ácida resultante es el azeótropo al 68,5 %, y se puede concentrar aún más (como en la industria) con ácido sulfúrico o nitrato de magnesio . [36]
Como alternativa, la descomposición térmica del nitrato de cobre (II) produce dióxido de nitrógeno y gases de oxígeno; estos luego se pasan a través de agua o peróxido de hidrógeno [38] como en el proceso de Ostwald:

El principal uso industrial del ácido nítrico es la producción de fertilizantes . El ácido nítrico se neutraliza con amoníaco para dar nitrato de amonio . Esta aplicación consume entre el 75 y el 80% de los 26 millones de toneladas producidas anualmente (1987). Las otras aplicaciones principales son la producción de explosivos, precursores de nailon y compuestos orgánicos especiales. [39]
En la síntesis orgánica , industrial y de otro tipo, el grupo nitro es un grupo funcional versátil . Una mezcla de ácidos nítrico y sulfúrico introduce un sustituyente nitro en varios compuestos aromáticos mediante sustitución aromática electrofílica . Muchos explosivos, como el TNT , se preparan de esta manera:
El ácido sulfúrico concentrado o el óleum absorben el exceso de agua.
El grupo nitro se puede reducir para dar un grupo amina , lo que permite la síntesis de compuestos de anilina a partir de varios nitrobencenos :
El precursor del nailon , el ácido adípico , se produce a gran escala mediante la oxidación del "aceite KA", una mezcla de ciclohexanona y ciclohexanol , con ácido nítrico. [39]
El ácido nítrico se ha utilizado en diversas formas como oxidante en cohetes de combustible líquido . Estas formas incluyen ácido nítrico fumante rojo, ácido nítrico fumante blanco, mezclas con ácido sulfúrico y estas formas con inhibidor de HF. [40] El IRFNA ( ácido nítrico fumante rojo inhibido ) fue uno de los tres componentes de combustible líquido para el misil BOMARC . [41]
El ácido nítrico se puede utilizar para convertir metales en formas oxidadas, como por ejemplo, convertir el metal de cobre en nitrato cúprico . También se puede utilizar en combinación con ácido clorhídrico como agua regia para disolver metales nobles como el oro (como ácido cloroáurico ). Estas sales se pueden utilizar para purificar el oro y otros metales con una pureza superior al 99,9 % mediante procesos de recristalización y precipitación selectiva . Su capacidad para disolver determinados metales de forma selectiva o ser un disolvente para muchas sales metálicas lo hace útil en los procesos de separación del oro .
En el análisis elemental por ICP-MS , ICP-AES , GFAA y AA de llama, se utiliza ácido nítrico diluido (0,5–5,0 %) como compuesto matriz para determinar trazas de metal en soluciones. [42] Se requiere ácido ultrapuro de grado traza de metal para dicha determinación, porque pequeñas cantidades de iones metálicos podrían afectar el resultado del análisis.
También se utiliza normalmente en el proceso de digestión de muestras de agua turbia, muestras de lodos, muestras sólidas, así como otros tipos de muestras únicas que requieren análisis elemental mediante ICP-MS , ICP-OES , ICP-AES , GFAA y espectroscopia de absorción atómica de llama . Normalmente, estas digestiones utilizan una solución al 50 % del HNO3 adquirido mezclado con agua DI tipo 1.
En electroquímica , el ácido nítrico se utiliza como agente dopante químico para semiconductores orgánicos y en procesos de purificación de nanotubos de carbono en bruto .
El ácido nítrico se utiliza a menudo en concentraciones bajas (aproximadamente el 10 %) para envejecer artificialmente el pino y el arce . El color que se obtiene es un gris dorado muy parecido al de la madera muy vieja tratada con cera o aceite ( acabado de la madera ). [43]
Los efectos corrosivos del ácido nítrico se aprovechan para algunas aplicaciones especiales, como el grabado en imprenta, el decapado de acero inoxidable o la limpieza de obleas de silicio en la electrónica. [44]
Para grabar metales y revelar su microestructura se utiliza una solución de ácido nítrico, agua y alcohol (nital ). La norma ISO 14104 es una de las normas que detallan este conocido procedimiento. [45]
El ácido nítrico se utiliza en combinación con ácido clorhídrico o solo para limpiar portaobjetos y cubreobjetos de vidrio para aplicaciones de microscopía de alta gama. [46] También se utiliza para limpiar el vidrio antes de platearlo al fabricar espejos de plata. [47]
Las mezclas acuosas disponibles comercialmente de ácido nítrico al 5-30% y ácido fosfórico al 15-40% se utilizan comúnmente para limpiar equipos de alimentos y lácteos, principalmente para eliminar los compuestos de calcio y magnesio precipitados (ya sea depositados a partir del flujo de proceso o resultantes del uso de agua dura durante la producción y la limpieza). El contenido de ácido fosfórico ayuda a pasivar las aleaciones ferrosas contra la corrosión por el ácido nítrico diluido. [ cita requerida ]
El ácido nítrico se puede utilizar como prueba puntual para alcaloides como el LSD , dando una variedad de colores dependiendo del alcaloide. [48]
El ácido nítrico desempeña un papel fundamental en PUREX y otros métodos de reprocesamiento de combustible nuclear , ya que puede disolver muchos actínidos diferentes . Los nitratos resultantes se convierten en varios complejos que pueden reaccionar y extraerse de forma selectiva para separar los metales entre sí.
El ácido nítrico es un ácido corrosivo y un potente agente oxidante . El principal peligro que presenta son las quemaduras químicas , ya que lleva a cabo hidrólisis ácida con proteínas ( amida ) y grasas ( éster ), que en consecuencia descompone el tejido vivo (por ejemplo, la piel y la carne ). El ácido nítrico concentrado tiñe la piel humana de amarillo debido a su reacción con la queratina . Estas manchas amarillas se vuelven anaranjadas cuando se neutralizan. [49] Los efectos sistémicos son poco probables y la sustancia no se considera carcinógena ni mutágena. [50]
El tratamiento estándar de primeros auxilios para los derrames de ácido sobre la piel es, al igual que para otros agentes corrosivos, la irrigación con grandes cantidades de agua. El lavado se continúa durante al menos 10 a 15 minutos para enfriar el tejido que rodea la quemadura de ácido y evitar daños secundarios. La ropa contaminada se quita inmediatamente y la piel subyacente se lava a fondo.
Al ser un fuerte agente oxidante, el ácido nítrico puede reaccionar violentamente con muchos compuestos.
El ácido nítrico es uno de los tipos de ácido más comunes utilizados en los ataques con ácido . [51]