Teoría de las colisiones
La teoría de las colisiones es una teoría propuesta por Max Trautz[1] en 1916 y por William Lewis en 1918, que explica cómo ocurren las reacciones químicas y por qué las velocidades de reacción difieren para diversas reacciones.
Las colisiones exitosas tienen suficiente (energía de activación), al momento del impacto, para romper los enlaces existentes y formar nuevos enlaces, resultando en los productos de la reacción.
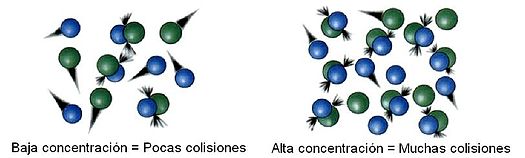
El incrementar la concentración de los reactivos y aumentar la temperatura lleva a más colisiones y por tanto a más colisiones exitosas, incrementando la velocidad de la reacción.
Cuando un catalizador está involucrado en la colisión entre las moléculas reaccionantes, se requiere una menor energía para que tome lugar el cambio químico, y por lo tanto más colisiones tienen la energía suficiente para que ocurra la reacción.
La teoría de las colisiones está cercanamente relacionada con la cinética química.
donde: Considérese la reacción: En la teoría de las colisiones se considera que dos partículas
colisionarán si sus núcleos se aproximan más cerca de cierta distancia.
de la reacción y es, en principio, el área correspondiente a un círculo cuyo radio (
Una molécula en movimiento barrerá por lo tanto un volumen πr²ABcA por segundo conforme se mueve, donde
La solución del problema de los dos cuerpos señala que dos diferentes cuerpos en movimiento pueden ser tratados como un cuerpo que tiene la masa reducida de ambos y se mueve con la velocidad del centro de masas, así que, en este sistema
Por tanto la rapidez de una reacción bimolecular para gases ideales será: donde: El producto
Una vez que una teoría es formulada su validez debe ser probada, esto es, comparar sus predicciones con el resultado de los experimentos.
La expresión es similar a la ecuación de Arrhenius, y brinda la primera explicación teórica de dicha ecuación sobre una base molecular.
La razón para eso es que se ha supuesto que las partículas son esféricas y capaces de reaccionar en todas direcciones; eso no es verdad, debido a que la orientación de las colisiones no es siempre la correcta.
Por ejemplo en la reacción de hidrogenación del etileno, la molécula de H2 debe aproximarse a la zona del enlace entre los átomos, y solo una pequeña cantidad de todas las posibles colisiones cumplirán este requerimiento.
Para aliviar este problema, un nuevo concepto debe ser introducido: el «factor estérico», ρ.
Es definido como la razón entre el valor experimental y el predicho (o la razón entre el factor de frecuencia y la frecuencia de colisión), y es la mayoría de las veces menor que la unidad.
[4] Usualmente, cuanto más complejas sean las moléculas de los reactivos, será menor el factor estérico.
La desviación de la unidad puede tener diferentes causas: las moléculas no son esféricas, así que son posibles diferentes geometrías; no toda la energía cinética es entregada en sitio correcto; la presencia de un disolvente (cuando es aplicado a disoluciones), etc.
La teoría de las colisiones puede ser aplicada a reacciones en disolución; en ese caso, la jaula de disolvente tiene un efecto en las moléculas reaccionantes y varias colisiones pueden tomar lugar en un único encuentro, lo cual lleva a que los factores preexponenciales predichos sean muy grandes.
Los valores de ρ mayores que la unidad pueden ser atribuidos a contribuciones entrópicas favorables.