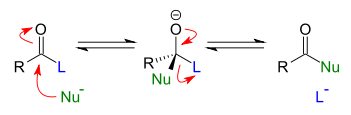
Sustitución nucleófila acílica
Los nucleófilos, en esta reacción, incluyen, por ejemplo, reactivos aniónicos como alcóxidos y enolatos o bases como las aminas.
En este caso en el "ataque" del nucleófilo sobre el grupo carbonilo se forma, como antes, un intermedio tetraédrico con el nucleófilo, el grupo saliente y el átomo de oxígeno cargado negativamente unidos al átomo de carbono central.
El resultado es que el nucleófilo ha tomado la posición ocupada previamente por el grupo saliente.
Esto se explica porque al desplazarse hacia la derecha del carbono en la tabla periódica la electronegatividad aumenta y el tamaño de un elemento decrece, esto último implica un peor solapamiento entre orbitales, de tal manera que la resonancia disminuye siendo el átomo de carbono del grupo carbonilo más electrófilo, aumentando pues su reactividad.
En definitiva, cuanto más importante sea la segunda forma resonante de la representación anterior, menor reactividad frente a la sustitución nucleófila acílica.