Sarcómero
Las fibras musculares individuales son sincitios muy grandes, que pueden tener hasta varios centímetros de longitud.
En los sarcómeros, los filamentos contráctiles de actina y miosina se integran en un orden paracristalino por la acción de proteínas citoesqueléticas accesorias, formando lo que a menudo se denomina el «citoesqueleto sarcomérico».
[4] El sarcómero es un conjunto multiproteico (supra-macromolecular) altamente ordenado, de los más grandes conocidos en biología.
La microscopía confocal mediante la inmuno-histoquímica y la inmuno-fluorescencia permite visualizar la ubicación de una molécula proteica específica en el límite de un sarcómero (disco Z) para determinar su longitud o para ubicar su centro (línea M).
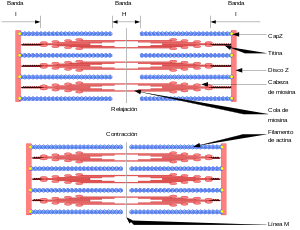
El sarcómero aparece con varias regiones densas diferentes, cada área resulta compuesta de muchos miofilamentos conectados con las áreas periféricas (los discos Z), o dentro de la región central (la banda M), que divide en dos mitades especulares la estructura sarcomérica.
Esta última es una proteína elástica (la más grande del organismo), y posee dos funciones: En la banda A del sarcómero se encuentran los filamentos de miosina (filamento grueso), responsables de la contracción muscular.
Estas forman una red intrincada con otras proteínas α-actinin, titin, nebulin y myotilin.
Sin embargo, la evidencia aún cuestiona la posibilidad de que las proteínas funcionen como plantillas, o andamios.
[12] Los filamentos intermedios sirven como andamiaje que conecta el sarcómero con las mitocondrias o el núcleo, para mantener la integridad celular y para contribuir a la transducción mecánica.
La titina ensambla el citoesqueleto sarcomérico, estas numerosas interacciones también coordinan los dominios de señalización y las enzimas metabólicas.
[10] Durante la contracción del músculo desaparece la Zona H y se comprime la Banda I.

Discos Z (en verde) .
Líneas M (en rojo) .
Microscopía confocal . inmuno-fluorescencia .

Thick filament= Filamento grueso (en azul) . Tomografía crioelectrónica . B= Reconstrucción 3D.


Thick filament= Filamento grueso (miosina) derecha.
Thin filament = Filamento fino en verde (actina) .