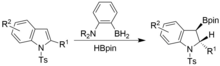Par de Lewis frustrado
Por ejemplo, se ha demostrado anteriormente que una mezcla de triciclohexilfosfina (PCy3) y tris (pentafluorofenil) borano reacciona con H2 para dar los iones de fosfonio y borato respectivos:
FLP también son reactivos frente a muchos sustratos insaturados más allá de H2.
Las hidrogenaciones de estos sustratos insaturados pueden efectuarse mediante reacciones catalizadas por metal.
El centro de iminio resultante sufre un ataque nucleofílico por el anión borohidruro para formar la amina.
Las aminas pequeñas se unen al borano, apagando las reacciones adicionales.
Este FLP cataliza la hidrogenación enantioselectiva de algunas aril iminas en alto rendimiento pero modesto ee (hasta 83%).
Las iminas sustituidas con metoxi muestran un rendimiento superior y el de ee.
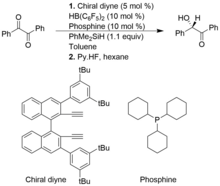
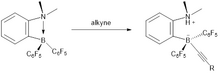
Sin embargo, en comparación con la hidrosililación tipo Piers convencional, las hidrosililaciones asimétricas tipo Piers no están tan bien desarrolladas En el siguiente ejemplo, el alquenilborano quiral se forma in situ a partir del diino quiral y el HB (C6F5)2.
[11] La condición para esta reacción eran relativamente suave utilizando 2 bar de H2.
Un paso protodeborilación libera los cis -alqueno producto, que se obtiene debido al proceso de syn-hidroborilación, y regenerar el catalizador.
La reacción es una syn-hidroboración, y como resultado se observa una alta selectividad cis.
En la etapa final del ciclo catalítico, el grupo C6F5 se escinde más fácilmente que un grupo alquilo, causando la degradación del catalizador en lugar de la liberación de alcano.
Por lo tanto, esta adición no procede mucho, la formación del alqueno parece favorecida.
Por lo tanto, este proceso de hidrogenación no es adecuado para los alquinos terminales y solo dará pentafluorobenceno.
Las borilaciones aromáticas se utilizan a menudo en el desarrollo farmacéutico, particularmente debido a la abundancia, bajo costo y baja toxicidad de los compuestos de boro en comparación con los metales nobles.
El sustrato para la reacción tiene dos requisitos principales, fuertemente ligados al mecanismo de la borilación.
Primero, el sustrato debe ser rico en electrones, ejemplificado por la ausencia de una reacción con tiofeno, mientras que sus derivados más ricos en electrones, metoxitiofeno y 3,4-etilendioxitiofeno, pueden experimentar una reacción con el amino-borano.
[13] La desromatización también se puede lograr en condiciones similares, pero utilizando indoles de N-tosilo.
[14] También se ha observado la borilación de enlaces SH en tioles por un proceso deshidrogenante.
Los alcoholes y las aminas como el terc-butanol y la terc-butilamina forman productos estables que evitan la catálisis debido a un fuerte enlace π entre el par solitario del átomo de N/O y el boro, mientras que lo mismo no es cierto para los tioles, lo que permite un catálisis exitoso.
En todos los casos, la formación de gas H2 es una fuerza impulsora fuerte para las reacciones.
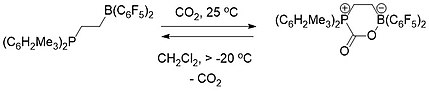
[16] Se utilizaron tanto una FLP intermolecular (Esquema 1) como intramolecular (Esquema 2) que consiste en una fosfina y un borano para capturar y liberar selectivamente el dióxido de carbono.