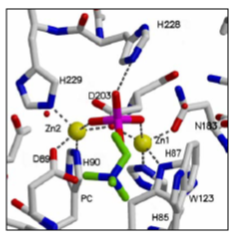
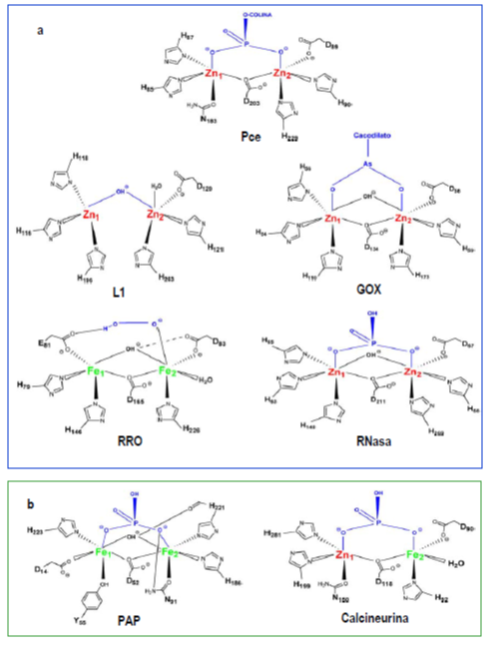
Hidrólisis enzimática
Estas enzimas ejercen un efecto catalítico hidrolizante, es decir, producen la ruptura de enlaces por agua según:
[1] A continuación se explican todos los grupos de enzimas hidrolasas, citando como ejemplos las más importantes en humanos.
Bajo el nombre de esterasas se comprenden una amplia cantidad de importantes enzimas que producen la ruptura del enlace éster formado por los ácidos inorgánicos (fosfórico, sulfúrico) u orgánicos diversos con diferentes alcoholes o tioles.
Pese a las numerosas investigaciones existe todavía cierta incoherencia, dada la escasa especificidad de acción para muchas esterasas.
Se localiza en el sistema nervioso central, en las placas terminales motóricas del músculo estriado, en la placenta y superficie de eritrocitos, así como en los trombocitos.
Las dos primeras enzimas son las más importantes y poseen el mismo nombre sistemático de: Ambas catalizan la misma reacción pero a pH diferente: Monoéster ortofosfórico + H2O → alcohol + ortofosfato Poseen una amplia especificidad, catalizando también transfosforilaciones.
Interviene en el metabolismo glucídico y en la síntesis de fosfoproteidos y fosfolípidos, catalizando la reacción: L-(o D)-fosfoserina + H2O → L-(o D)-serina + ortofosfato Ribonucleasas que atacan específicamente a los nucleótidos con grupo fosfato en la posición que indica en número dando el ribonucleótido correspondiente.
Se encuentra ampliamente distribuida en el cuerpo, siendo los órganos más ricos la próstata, lóbulo posterior de la hipófisis, hígado, viniendo luego cerebro, riñón, testículos, etc.
Ambas enzimas se encuentran en las células de diversos órganos, con mayor cantidad en los tejidos de gran actividad mitósica, pero mientras que la primera localizada en el núcleo celular es prácticamente inactiva y sólo se activa al agregar iones magnesio, la segunda es inactivada por estos iones.
Algunas patologías en las que se ha observado una variación de esta enzima son afecciones pancreáticas, hepatitis, leucemia, lupus eritematoso, etc. Libera trifosfato y desoxiguanosina y actúa también sobre el GTP (guanosina trifosfato).
Actúa sobre almidón, glucógeno, polisacáridos relacionados y oligosacáridos produciendo beta maltosa por una inversión.
Ataca los enlaces β-1,4 que existen entre el ácido N-acetilmuramínico y los radicales de 2-acetilamino-2-desoxi-D-glucosa, en un mucopolisacárido o mucopéptido.
Su papel en procesos vitales del organismo no está muy clara, pero se dice que su función principal es la de intervenir en el metabolismo.
Su papel biológico no está claro, se ha indicado una intervención en la síntesis o hidrólisis de la parathormona y actuación opuesta a la succinato deshidrogenasa.
Esta enzima, presente también en pequeñas cantidades en orina e histoquímicamente localizada en las “cerdas de cepillo” de los tubulus proximales, experimenta gran aumento en los trastornos funcionales renales, pielografías intravenosas, etc.[3] Atacan el terminal carboxílico COO.
[1] Es un grupo interesante de enzimas segregadas por el jugo intestinal, aunque existe en otros órganos.
Completan la hidrólisis proteica al actuar sobre péptidos cortos no hidrolizados por otras enzimas digestivas.
Un 1 % del pepsinógeno entra en la circulación sanguínea y luego se elimina por vía renal como uropepsinógeno.
También se ha probado la presencia de tripsina en el cristalino, leucocitos, eritrocitos, piel, parótida, riñón e hipófisis.
Luego la enzima se regenera hidrolizando el enlace que aún la une al residuo ácido, y éste queda libre como segundo producto de la reacción.
Es eficaz en proteínas como la elastina, la fibrina, la albúmina y la caseína, pero no en la queratina o el colágeno.
Parece estar relacionada con la arteriosclerosis, y es la única enzima digestiva capaz de romper la elastina.
La C actúa sobre enlaces de aminoácidos aromáticos adyacentes a un grupo α-amino libre.
La catepsina se encuentra en pequeñas concentraciones en diferentes tejidos animales como bazo, riñón, hígado, leucocitos, eritrocitos y plaquetas, así como en el estómago.
La plasmina (o fibrolisina) hidroliza los ésteres de la L-arginina y la L-lisina, solubilizando la fibrina.
Se encuentra en bacterias, hongos, musgos, leguminosas, glóbulos rojos, hígado y bazo de rata, así como en los eritrocitos humanos.
Destruye al inhibidor de la precipitación del fosfato cálcico que se encuentra en el plasma y la orina.
Cataliza la reacción: ATP + H2O → ADP + ortofosfato Esta actividad tiene lugar en la miosina, actomiosina, mitocondrias, microsomas y membrana celular.
Cataliza la reacción: ATP + H2O → AMP + pirofosfato Actúa también sobre ITP, GTP, CTP y UTP.
Muchas esterasas se obtienen del hígado de animales como el cerdo y el conejo.