Fotorrespiración
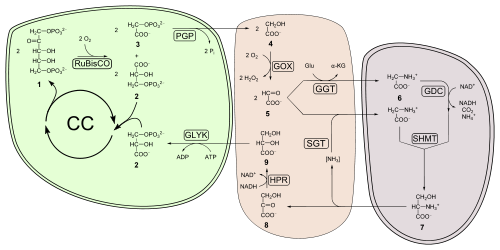
A finales de los 60, Bill Ogren, consternado por el “efecto Warburg”, probó que existe competencia entre el O2 y el CO2 en la fotosíntesis, concluyendo que ambas moléculas compiten por la enzima encargada de fijar el CO2 en las plantas, la llamada en esos momentos ribulosa-1,5-bisfosfato carboxilasa.
Con ayuda de su estudiante, George Bowes, comprobaron, en 1971, que la enzima tiene actividad de oxigenasa, la enzima pasó a denominarse con su nombre actual, ribulosa-1,5-bisfosfato carboxilasa oxigenasa, más conocida como RuBisCO.
Posteriormente, el glioxilato puede convertirse en glicina por la transaminación con glutamato por la glutamato-glioxilato aminotransferasa, dando origen a un alfa-cetoglutarato (que se retomará más adelante); o por transaminación con serina, mediada por la serina-glioxilato aminotransferasa, que origina también hidroxipiruvato (reacción importante en un paso posterior).
El ion amonio puede transportarse hacia cloroplasto, donde sirve para reconstituir el glutamato anteriormente, mediante la acción de la glutamina sintetasa y la glutamina-glutarato aminotransferasa.
Esta última reacción es la que le otorga una mala reputación a la fotorrespiración, ya que aquí hay una pérdida del 25 % de carbono en forma de CO2, lo cual no resulta beneficioso para la planta.
En caso contrario, el hidroxipiruvato puede salir a citosol y pasar por la misma reacción con la enzima homóloga de citoplasma.