
Una vacuna de ADN es un tipo de vacuna que transfecta una secuencia de ADN codificante de antígeno específico en las células de un organismo como mecanismo para inducir una respuesta inmune. [1] [2]
Las vacunas de ADN funcionan inyectando un plásmido modificado genéticamente que contiene la secuencia de ADN que codifica el o los antígenos contra los que se busca una respuesta inmunitaria, de modo que las células produzcan directamente el antígeno, provocando así una respuesta inmunológica protectora . [3] Las vacunas de ADN tienen ventajas teóricas sobre las vacunas convencionales, incluida la "capacidad de inducir una gama más amplia de tipos de respuesta inmunitaria". [4] Se han probado varias vacunas de ADN para uso veterinario . [3] En algunos casos, se ha obtenido protección contra enfermedades en animales, en otros no. [3] Se están realizando investigaciones sobre el abordaje para enfermedades virales, bacterianas y parasitarias en humanos, así como para cánceres. [4] En agosto de 2021, las autoridades indias dieron aprobación de emergencia a ZyCoV-D . Desarrollada por Cadila Healthcare , es la primera vacuna de ADN aprobada para humanos. [5]
Las vacunas convencionales contienen antígenos específicos de un patógeno o virus atenuados que estimulan una respuesta inmunitaria en el organismo vacunado. Las vacunas de ADN son miembros de las vacunas genéticas , porque contienen una información genética (ADN o ARN) que codifica la producción celular ( biosíntesis de proteínas ) de un antígeno . Las vacunas de ADN contienen ADN que codifica antígenos específicos de un patógeno. El ADN se inyecta en el cuerpo y es absorbido por las células, cuyos procesos metabólicos normales sintetizan proteínas basadas en el código genético del plásmido que han absorbido. Debido a que estas proteínas contienen regiones de secuencias de aminoácidos que son características de bacterias o virus, se reconocen como extrañas y cuando son procesadas por las células huésped y se muestran en su superficie, el sistema inmunológico se alerta, lo que luego desencadena respuestas inmunitarias. [6] [7] Alternativamente, el ADN puede encapsularse en proteína para facilitar la entrada a la célula. Si esta proteína de la cápside se incluye en el ADN, la vacuna resultante puede combinar la potencia de una vacuna viva sin riesgos de reversión. [ cita requerida ]
En 1983, Enzo Paoletti y Dennis Panicali del Departamento de Salud de Nueva York idearon una estrategia para producir vacunas de ADN recombinante mediante el uso de ingeniería genética para transformar la vacuna común contra la viruela en vacunas que podrían prevenir otras enfermedades. [8] Alteraron el ADN del virus de la viruela bovina insertando un gen de otros virus (a saber, el virus del herpes simple , el de la hepatitis B y el de la gripe ). [9] [10] En 1993, Jeffrey Ulmer y sus colaboradores de Merck Research Laboratories demostraron que la inyección directa de ADN plasmídico en ratones que codificaba un antígeno de la gripe protegía a los animales contra una infección experimental posterior con el virus de la gripe. [11] En 2016, una vacuna de ADN para el virus del Zika comenzó a probarse en humanos en los Institutos Nacionales de Salud . Se planeó que el estudio involucrara hasta 120 sujetos de entre 18 y 35 años. Por otra parte, Inovio Pharmaceuticals y GeneOne Life Science comenzaron las pruebas de una vacuna de ADN diferente contra el Zika en Miami. La vacuna del NIH se inyecta en la parte superior del brazo a alta presión. La fabricación de las vacunas en grandes cantidades seguía sin resolverse hasta agosto de 2016. [12] Se están realizando ensayos clínicos de vacunas de ADN para prevenir el VIH. [13]
En agosto de 2021, las autoridades indias dieron la aprobación de emergencia a ZyCoV-D. Desarrollada por Cadila Healthcare , es la primera vacuna de ADN contra la COVID-19 . [5]
Hasta 2021, [actualizar]no se han aprobado vacunas de ADN para uso humano en Estados Unidos. Pocos ensayos experimentales han provocado una respuesta lo suficientemente fuerte como para proteger contra la enfermedad y la utilidad de la técnica aún está por demostrarse en humanos.
Se ha aprobado una vacuna veterinaria de ADN para proteger a los caballos del virus del Nilo Occidental. [14] Otra vacuna contra el virus del Nilo Occidental se ha probado con éxito en petirrojos americanos. [15]
También se está investigando la inmunización con ADN como un medio para desarrollar sueros antiveneno. [1] La inmunización con ADN se puede utilizar como una plataforma tecnológica para la inducción de anticuerpos monoclonales. [2]
Las vacunas de ADN provocan la mejor respuesta inmunitaria cuando se utilizan vectores de alta expresión. Estos son plásmidos que generalmente consisten en un promotor viral fuerte para impulsar la transcripción y traducción in vivo del gen (o ADN complementario ) de interés. [18] El intrón A a veces se puede incluir para mejorar la estabilidad del ARNm y, por lo tanto, aumentar la expresión de la proteína. [19] Los plásmidos también incluyen una fuerte señal de poliadenilación /terminación de la transcripción , como las secuencias de poliadenilación de la hormona de crecimiento bovina o la beta-globulina de conejo . [6] [7] [20] Los vectores policistrónicos (con múltiples genes de interés) a veces se construyen para expresar más de un inmunógeno, o para expresar un inmunógeno y una proteína inmunoestimulante. [21]
Dado que el plásmido (que contiene un código genético relativamente pequeño de hasta 200 Kbp ) es el "vehículo" a partir del cual se expresa el inmunógeno, es esencial optimizar el diseño del vector para lograr la máxima expresión de la proteína. [21] Una forma de mejorar la expresión de la proteína es optimizar el uso de codones de los ARNm patógenos para las células eucariotas . Los patógenos suelen tener diferentes contenidos de AT que las especies objetivo, por lo que alterar la secuencia genética del inmunógeno para reflejar los codones más comúnmente utilizados en la especie objetivo puede mejorar su expresión. [22]
Otra consideración es la elección del promotor . El promotor SV40 se utilizó convencionalmente hasta que la investigación mostró que los vectores impulsados por el promotor del virus del sarcoma de Rous (RSV) tenían tasas de expresión mucho más altas. [6] Más recientemente, la expresión y la inmunogenicidad se han incrementado aún más en sistemas modelo mediante el uso del promotor temprano inmediato del citomegalovirus (CMV) y un elemento transcripcional retroviral que actúa en cis . [23] Las modificaciones adicionales para mejorar las tasas de expresión incluyen la inserción de secuencias potenciadoras, intrones sintéticos , secuencias líderes tripartitas de adenovirus (TPL) y modificaciones a las secuencias de poliadenilación y terminación transcripcional. [6] Un ejemplo de plásmido de vacuna de ADN es pVAC, que utiliza el promotor SV40 .
Los fenómenos de inestabilidad estructural son de particular interés para la fabricación de plásmidos, la vacunación con ADN y la terapia génica. [24] Las regiones accesorias pertenecientes a la estructura principal del plásmido pueden participar en una amplia gama de fenómenos de inestabilidad estructural. Los catalizadores bien conocidos de la inestabilidad genética incluyen repeticiones directas, invertidas y en tándem, que son evidentes en muchos vectores de clonación y expresión disponibles comercialmente. Por lo tanto, la reducción o eliminación completa de secuencias de la estructura principal no codificantes extrañas reduciría significativamente la propensión a que se produzcan tales eventos y, en consecuencia, el potencial recombinogénico general del plásmido. [25]
Una vez que el plásmido se inserta en el núcleo de la célula transfectada, codifica una cadena peptídica de un antígeno extraño. En su superficie, la célula muestra el antígeno extraño con moléculas de clase I y clase II del complejo de histocompatibilidad (MHC). La célula presentadora de antígeno viaja entonces a los ganglios linfáticos y presenta el péptido antigénico y la molécula coestimuladora, lo que envía señales a las células T, lo que inicia la respuesta inmunitaria. [26]
Los inmunógenos pueden dirigirse a varios compartimentos celulares para mejorar las respuestas de anticuerpos o de células T citotóxicas. Los antígenos secretados o unidos a la membrana plasmática son más eficaces para inducir respuestas de anticuerpos que los antígenos citosólicos , mientras que las respuestas de las células T citotóxicas pueden mejorarse dirigiendo los antígenos hacia la degradación citoplasmática y la posterior entrada en la vía del complejo mayor de histocompatibilidad (MHC) de clase I. [7] Esto se logra generalmente mediante la adición de señales de ubiquitina N-terminal . [27] [28] [29]
La conformación de la proteína también puede afectar las respuestas de los anticuerpos. Las estructuras "ordenadas" (como las partículas virales) son más eficaces que las estructuras desordenadas. [30] Las cadenas de minigenes (o epítopos de MHC de clase I ) de diferentes patógenos aumentan las respuestas de las células T citotóxicas a algunos patógenos, especialmente si también se incluye un epítopo TH. [7]
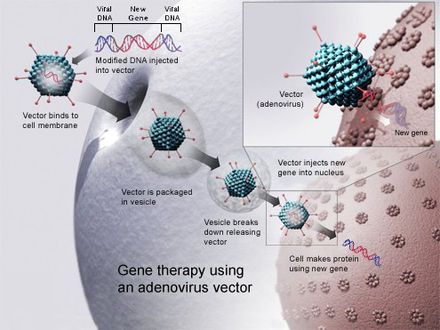
Las vacunas de ADN se han introducido en tejidos animales mediante múltiples métodos. En 1999, los dos métodos más populares eran la inyección de ADN en solución salina : mediante una aguja hipodérmica estándar o mediante una pistola de administración de genes. [31] En los años intermedios se han documentado varias otras técnicas.
La inyección en solución salina normalmente se realiza por vía intramuscular (IM) en el músculo esquelético , o por vía intradérmica (ID), entregando ADN a los espacios extracelulares. Esto puede ser asistido ya sea 1) por electroporación ; [32] 2) dañando temporalmente las fibras musculares con miotoxinas como la bupivacaína ; o 3) usando soluciones hipertónicas de solución salina o sacarosa . [6] Las respuestas inmunes a este método pueden verse afectadas por factores que incluyen el tipo de aguja, [16] la alineación de la aguja, la velocidad de la inyección, el volumen de la inyección, el tipo de músculo y la edad, el sexo y la condición fisiológica del receptor. [6]
La administración mediante pistolas genéticas acelera balísticamente el ADN plasmídico (pDNA) que ha sido absorbido en micropartículas de oro o tungsteno hacia las células objetivo, utilizando helio comprimido como acelerador. [6] [21]
Las alternativas incluyeron la instilación en aerosol de ADN desnudo en superficies mucosas , como la mucosa nasal y pulmonar , [21] y la administración tópica de pDNA en los ojos [33] y la mucosa vaginal. [21] La administración a superficies mucosas también se ha logrado utilizando preparaciones de liposomas catiónicos-ADN, [7] microesferas biodegradables , [34] [21] vectores atenuados de Salmonalla , [35] Shigella o Listeria para administración oral a la mucosa intestinal [36] y vectores de adenovirus recombinantes. [21]
Se ha empleado un vehículo híbrido compuesto de células bacterianas y polímeros sintéticos para la administración de vacunas de ADN. Un núcleo interno de E. coli y una capa externa de poli(beta-aminoéster) funcionan sinérgicamente para aumentar la eficiencia al abordar las barreras asociadas con la administración de genes a las células presentadoras de antígenos , que incluyen la captación e internalización celular, el escape fagosómico y la concentración de carga intracelular. [ jerga ] Probado en ratones, se encontró que el vector híbrido induce una respuesta inmunitaria. [37] [38]
Otro enfoque para la vacunación con ADN es la inmunización con bibliotecas de expresión (ELI). Mediante esta técnica, es posible administrar todos los genes de un patógeno a la vez, lo que puede ser útil para patógenos que son difíciles de atenuar o cultivar. [6] La ELI se puede utilizar para identificar qué genes inducen una respuesta protectora. Esto se ha probado con Mycoplasma pulmonis , un patógeno pulmonar murino con un genoma relativamente pequeño . Incluso las bibliotecas de expresión parcial pueden inducir protección frente a un desafío posterior. [39]
El método de administración determina la dosis necesaria para generar una respuesta inmunitaria eficaz. Las inyecciones salinas requieren cantidades variables de ADN, de 10 μg a 1 mg, mientras que las administraciones con pistolas genéticas requieren de 100 a 1000 veces menos. [40] Generalmente, se requieren de 0,2 μg a 20 μg, aunque se han reportado cantidades tan bajas como 16 ng. [6] Estas cantidades varían según la especie. Los ratones, por ejemplo, requieren aproximadamente 10 veces menos ADN que los primates . [7] Las inyecciones salinas requieren más ADN porque el ADN se administra a los espacios extracelulares del tejido objetivo (normalmente músculo), donde tiene que superar barreras físicas (como la lámina basal y grandes cantidades de tejido conectivo ) antes de que sea absorbido por las células, mientras que las administraciones con pistolas genéticas impulsan/fuerzan el ADN directamente dentro de las células, lo que resulta en un menor "desperdicio". [6] [7]
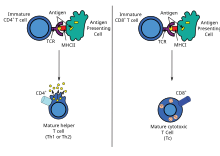
La inmunización con ADN puede generar múltiples respuestas de linfocitos T , incluida la linfoproliferación y la generación de una variedad de perfiles de citocinas . Una ventaja importante de las vacunas de ADN es la facilidad con la que se pueden manipular para sesgar el tipo de ayuda de las células T hacia una respuesta TH1 o TH2. [41] Cada tipo tiene patrones distintivos de expresión de linfocinas y quimiocinas, tipos específicos de inmunoglobulinas , patrones de tráfico de linfocitos y tipos de respuestas inmunitarias innatas .
El tipo de ayuda de células T generada está influenciado por el método de administración y el tipo de inmunógeno expresado, así como la orientación de diferentes compartimentos linfoides. [6] [42] Generalmente, las inyecciones con agujas salinas (ya sea IM o ID) tienden a inducir respuestas TH1, mientras que la administración con pistola genética genera respuestas TH2. [41] [42] Esto es cierto para los antígenos intracelulares y unidos a la membrana plasmática, pero no para los antígenos secretados, que parecen generar respuestas TH2, independientemente del método de administración. [43]
Generalmente, el tipo de ayuda de células T generada es estable en el tiempo y no cambia cuando se expone a un desafío o después de inmunizaciones posteriores que normalmente habrían generado el tipo opuesto de respuesta en una muestra ingenua. [41] [42] Sin embargo, Mor et al . (1995) [18] inmunizaron y reforzaron ratones con pDNA que codifica la proteína circumsporozoíto del parásito de la malaria del ratón Plasmodium yoelii (PyCSP) y encontraron que la respuesta TH2 inicial cambió, después del refuerzo, a una respuesta TH1.
No se entiende cómo funcionan estos diferentes métodos, las formas de antígeno expresado y los diferentes perfiles de ayuda de las células T. Se pensaba que las cantidades relativamente grandes de ADN utilizadas en la inyección IM eran responsables de la inducción de respuestas TH1. Sin embargo, la evidencia no muestra diferencias relacionadas con la dosis en el tipo de TH. [41] El tipo de ayuda de células T generada está determinado por el estado diferenciado de las células presentadoras de antígeno . Las células dendríticas pueden diferenciarse para secretar IL-12 (que apoya el desarrollo de células TH1) o IL-4 (que apoya las respuestas TH2). [44] El pDNA inyectado con aguja se endocita en la célula dendrítica, que luego se estimula para diferenciarse para la producción de citocina TH1 (IL-12), [45] mientras que la pistola genética bombardea el ADN directamente en la célula, evitando así la estimulación TH1.
La polarización en la ayuda de las células T es útil para influir en las respuestas alérgicas y las enfermedades autoinmunes . En las enfermedades autoinmunes, el objetivo es cambiar la respuesta TH1 autodestructiva (con su actividad de células T citotóxicas asociada) a una respuesta TH2 no destructiva. Esto se ha aplicado con éxito en la preparación previa a la enfermedad para el tipo de respuesta deseado en modelos preclínicos [7] y es algo exitoso en cambiar la respuesta para una enfermedad establecida. [46]
Una de las ventajas de las vacunas de ADN es que pueden inducir linfocitos T citotóxicos (CTL) sin el riesgo inherente asociado con las vacunas vivas. Las respuestas de CTL se pueden generar contra epítopos de CTL inmunodominantes e inmunorecesivos, [47] así como epítopos de CTL subdominantes , [34] [ jerga ] de una manera que parece imitar la infección natural . Esto puede resultar una herramienta útil para evaluar los epítopos de CTL y su papel en la concesión de inmunidad.
Las células T citotóxicas reconocen péptidos pequeños (8-10 aminoácidos ) unidos a moléculas de MHC de clase I. [48] Estos péptidos se derivan de proteínas citosólicas que se degradan y se entregan a la molécula naciente de MHC de clase I dentro del retículo endoplasmático (RE). [48] La orientación de los productos genéticos directamente al RE (mediante la adición de una secuencia de señal de inserción del RE en el extremo N ) debería mejorar las respuestas de los CTL. Esto se demostró con éxito utilizando virus vaccinia recombinantes que expresan proteínas de la gripe , [48] pero el principio también debería ser aplicable a las vacunas de ADN. La orientación de antígenos para la degradación intracelular (y, por lo tanto, la entrada en la vía de MHC de clase I) mediante la adición de secuencias de señal de ubiquitina , o la mutación de otras secuencias de señal, demostró ser eficaz para aumentar las respuestas de los CTL. [28]
Las respuestas de los CTL se pueden mejorar mediante la co-inoculación con moléculas coestimulantes como B7-1 o B7-2 para vacunas de ADN contra la nucleoproteína de la influenza, [47] [49] o GM-CSF para vacunas de ADN contra el modelo de malaria murina P. yoelii . [50] Se ha demostrado que la co-inoculación con plásmidos que codifican las moléculas coestimulantes IL-12 y TCA3 aumenta la actividad de los CTL contra los antígenos de la nucleoproteína del VIH-1 y de la influenza. [49] [51]
Las respuestas de anticuerpos provocadas por las vacunas de ADN están influenciadas por múltiples variables, entre ellas el tipo de antígeno, la ubicación del antígeno (es decir, intracelular o secretado), el número, la frecuencia y la dosis de inmunización, y el sitio y el método de administración del antígeno.
Las respuestas humorales después de una única inyección de ADN pueden durar mucho más que después de una única inyección con una proteína recombinante. Las respuestas de anticuerpos contra la proteína de la envoltura del virus de la hepatitis B (HBV) (HBsAg) se han mantenido hasta 74 semanas sin refuerzo, mientras que se demostró el mantenimiento de por vida de la respuesta protectora a la hemaglutinina de la gripe en ratones después de la administración de una pistola genética. [52] Las células secretoras de anticuerpos (ASC) migran a la médula ósea y al bazo para la producción de anticuerpos a largo plazo, y generalmente se localizan allí después de un año. [52]
En la Tabla 4 se resumen las comparaciones de las respuestas de anticuerpos generadas por la infección natural (vírica), la inmunización con proteína recombinante y la inmunización con pDNA. Las respuestas de anticuerpos generadas por ADN aumentan mucho más lentamente que cuando se produce una infección natural o una inmunización con proteína recombinante. Se pueden requerir hasta 12 semanas para alcanzar los títulos máximos en ratones, aunque la administración de refuerzo puede reducir el intervalo. Esta respuesta probablemente se deba a los bajos niveles de antígeno expresados durante varias semanas, lo que favorece las fases primaria y secundaria de la respuesta de anticuerpos. [ aclaración necesaria ] Se inyectó una vacuna de ADN que expresaba la proteína de envoltura pequeña y media del VHB en adultos con hepatitis crónica. La vacuna dio como resultado la producción específica de interferón gamma en células. También se desarrollaron células T específicas para antígenos de proteínas de envoltura media. La respuesta inmunitaria de los pacientes no fue lo suficientemente sólida como para controlar la infección por VHB [53]
Además, los títulos de anticuerpos específicos generados por la vacunación con ADN son inferiores a los obtenidos tras la vacunación con una proteína recombinante. Sin embargo, los anticuerpos inducidos por la inmunización con ADN muestran una mayor afinidad por los epítopos nativos que los anticuerpos inducidos por proteínas recombinantes. En otras palabras, la inmunización con ADN induce una respuesta cualitativamente superior. Los anticuerpos se pueden inducir después de una vacunación con ADN, mientras que las vacunas con proteínas recombinantes generalmente requieren un refuerzo. La inmunización con ADN se puede utilizar para sesgar el perfil de TH de la respuesta inmunitaria y, por tanto, el isotipo del anticuerpo, lo que no es posible ni con la infección natural ni con la inmunización con proteínas recombinantes. Las respuestas de anticuerpos generadas por ADN son útiles como herramienta preparatoria. Por ejemplo, se pueden generar anticuerpos policlonales y monoclonales para su uso como reactivos. [ cita requerida ]
Cuando se demostró por primera vez la captación de ADN y su posterior expresión in vivo en células musculares , [54] se pensó que estas células eran únicas debido a su extensa red de túbulos T. Utilizando microscopía electrónica , se propuso que la captación de ADN era facilitada por caveolas (o fosas no recubiertas de clatrina). [55] Sin embargo, investigaciones posteriores revelaron que otras células (como los queratinocitos , los fibroblastos y las células epiteliales de Langerhans ) también podían internalizar ADN. [46] [56] No se conoce el mecanismo de captación de ADN.
Dos teorías dominan: que la captación in vivo de ADN ocurre de forma no específica, en un método similar a la fagocitosis o pinocitosis , [21] o a través de receptores específicos. [57] Estos podrían incluir un receptor de superficie de 30 kDa o receptores depuradores de macrófagos . [ aclaración necesaria ] El receptor de superficie de 30 kDa se une específicamente a fragmentos de ADN de 4500 pb (que luego se internalizan) y se encuentra en las APC profesionales y las células T. Los receptores depuradores de macrófagos se unen a una variedad de macromoléculas, incluidos los polirribonucleótidos y , por lo tanto, son candidatos para la captación de ADN. [57] [58] La captación de ADN mediada por receptores podría verse facilitada por la presencia de secuencias de poliguanilato . Los sistemas de administración de pistolas genéticas , el empaquetado de liposomas catiónicos y otros métodos de administración evitan este método de entrada, pero comprenderlo puede ser útil para reducir costos ( por ejemplo, al reducir el requerimiento de citofectinas), lo que podría ser importante en la cría de animales.

Estudios realizados con ratones quiméricos han demostrado que el antígeno es presentado por células derivadas de la médula ósea, que incluyen células dendríticas, macrófagos y células B especializadas llamadas células presentadoras de antígenos profesionales (APC). [49] [59] Después de la inoculación con pistola genética en la piel, las células de Langerhans transfectadas migran al ganglio linfático de drenaje para presentar antígenos. [7] Después de las inyecciones IM e ID, las células dendríticas presentan antígeno en el ganglio linfático de drenaje [56] y se han encontrado macrófagos transfectados en la sangre periférica. [60]
Además de la transfección directa de células dendríticas o macrófagos, se produce una iniciación cruzada tras la administración de ADN por vía intramuscular, intradérmica y pistola génica. La iniciación cruzada se produce cuando una célula derivada de la médula ósea presenta péptidos de proteínas sintetizadas en otra célula en el contexto del MHC de clase 1. Esto puede iniciar respuestas de células T citotóxicas y parece ser importante para una respuesta inmunitaria primaria completa. [7] [61]
La administración de ADN por vía intramuscular e intradérmica inicia respuestas inmunitarias de forma diferente. En la piel, los queratinocitos, fibroblastos y células de Langerhans captan y expresan antígenos y son responsables de inducir una respuesta de anticuerpos primaria. Las células de Langerhans transfectadas migran fuera de la piel (en el plazo de 12 horas) hasta el ganglio linfático de drenaje, donde preparan respuestas secundarias de células B y T. En el músculo esquelético, las células musculares estriadas son las que se transfectan con mayor frecuencia, pero parecen no ser importantes en la respuesta inmunitaria. En cambio, el ADN inoculado por vía intramuscular "se lava" en el ganglio linfático de drenaje en cuestión de minutos, donde las células dendríticas distales se transfectan y luego inician una respuesta inmunitaria. Los miocitos transfectados parecen actuar como un "reservorio" de antígeno para el tráfico de células APC profesionales. [21] [54] [61]
La vacunación con ADN genera una memoria inmunitaria eficaz mediante la exposición de complejos antígeno-anticuerpo en las células dendríticas foliculares (CDF), que son potentes estimuladores de las células B. Las células T pueden ser estimuladas por células dendríticas del centro germinal similares. Las CDF pueden generar una memoria inmunitaria porque la producción de anticuerpos "se superpone" a la expresión a largo plazo del antígeno, lo que permite que se formen inmunocomplejos antígeno-anticuerpo y sean expuestos por las CDF. [7]
Tanto las células T auxiliares como las citotóxicas pueden controlar las infecciones virales mediante la secreción de interferones. Las células T citotóxicas suelen matar a las células infectadas por virus. Sin embargo, también pueden ser estimuladas para secretar citocinas antivirales como IFN-γ y TNF-α , que no matan a la célula, pero limitan la infección viral al regular a la baja la expresión de los componentes virales. [62] Las vacunas de ADN se pueden utilizar para frenar las infecciones virales mediante un control no destructivo mediado por IFN. Esto se demostró para la hepatitis B. [63] El IFN-γ es de vital importancia para controlar las infecciones de malaria [64] y es un factor a tener en cuenta para las vacunas de ADN contra la malaria.
Una vacuna eficaz debe inducir una respuesta inmunitaria adecuada para un patógeno determinado. Las vacunas de ADN pueden polarizar la ayuda de las células T hacia perfiles TH1 o TH2 y generar CTL y/o anticuerpos cuando sea necesario. Esto se puede lograr mediante modificaciones en la forma del antígeno expresado (es decir, intracelular frente a secretado), el método y la vía de administración o la dosis. [41] [42] [65] [66] [67] También se puede lograr mediante la coadministración de ADN plasmídico que codifica moléculas reguladoras inmunitarias, es decir, citocinas, linfocinas o moléculas coestimulantes. Estos " adyuvantes genéticos " se pueden administrar como:
En general, la administración conjunta de agentes proinflamatorios (como diversas interleucinas , factor de necrosis tumoral y GM-CSF) más citocinas inductoras de TH2 aumenta las respuestas de anticuerpos, mientras que los agentes proinflamatorios y las citocinas inductoras de TH1 disminuyen las respuestas humorales y aumentan las respuestas citotóxicas (más importantes en la protección viral). A veces se utilizan moléculas coestimulantes como B7-1 , B7-2 y CD40L .
Este concepto se aplicó en la administración tópica de pDNA que codifica IL-10 . [33] El plásmido que codifica B7-1 (un ligando en APC) mejoró con éxito la respuesta inmune en modelos tumorales. La mezcla de plásmidos que codifican GM-CSF y la proteína circumsporozoíto de P. yoelii (PyCSP) mejoró la protección contra el desafío posterior (mientras que PyCSP codificada por plásmido sola no lo hizo). Se propuso que GM-CSF causó que las células dendríticas presentaran antígeno de manera más eficiente y mejoraran la producción de IL-2 y la activación de células TH, impulsando así el aumento de la respuesta inmune. [50] Esto se puede mejorar aún más mediante la primera preparación con una mezcla de pPyCSP y pGM-CSF, seguida de un refuerzo con un poxvirus recombinante que expresa PyCSP. [68] Sin embargo, la coinyección de plásmidos que codifican GM-CSF (o IFN-γ, o IL-2) y una proteína de fusión de la proteína de superficie del merozoito 1 (C-terminal) de P. chabaudi -proteína de superficie del virus de la hepatitis B (PcMSP1-HBs) eliminó la protección contra el desafío, en comparación con la protección adquirida mediante la administración de pPcMSP1-HBs solo. [30]
Las ventajas de los adyuvantes genéticos son su bajo coste y su sencilla administración, así como la evitación de citocinas recombinantes inestables y adyuvantes "convencionales" potencialmente tóxicos (como el alumbre , el fosfato de calcio , el monofosforil lípido A, la toxina del cólera , los liposomas recubiertos con manano y catiónicos, QS21 , la carboximetilcelulosa y el ubenimex ). [7] [21] Sin embargo, no se ha establecido la toxicidad potencial de la expresión prolongada de citocinas. En muchas especies animales de importancia comercial, no se han identificado ni aislado genes de citocinas. Además, varias citocinas codificadas por plásmidos modulan el sistema inmunitario de forma diferente según el momento de administración. Por ejemplo, algunos ADN plasmídicos de citocinas se administran mejor después del pDNA del inmunógeno, porque la administración previa o conjunta puede disminuir las respuestas específicas y aumentar las respuestas no específicas. [69]
El ADN plasmídico en sí parece tener un efecto adyuvante en el sistema inmunológico. [6] [7] El ADN derivado de bacterias puede desencadenar mecanismos de defensa inmune innatos, la activación de células dendríticas y la producción de citocinas TH1. [45] [70] Esto se debe al reconocimiento de ciertas secuencias de dinucleótidos CpG que son inmunoestimulantes. [66] [71] Las secuencias estimuladoras de CpG (CpG-S) ocurren veinte veces más frecuentemente en el ADN derivado de bacterias que en eucariotas. Esto se debe a que los eucariotas muestran "supresión de CpG", es decir, los pares de dinucleótidos CpG ocurren con mucha menos frecuencia de lo esperado. Además, las secuencias CpG-S están hipometiladas. Esto ocurre con frecuencia en el ADN bacteriano, mientras que los motivos CpG que ocurren en eucariotas están metilados en el nucleótido de citosina. Por el contrario, las secuencias de nucleótidos que inhiben la activación de una respuesta inmune (denominadas neutralizantes de CpG o CpG-N) están sobrerrepresentadas en los genomas eucariotas. [72] La secuencia inmunoestimulante óptima es un dinucleótido CpG no metilado flanqueado por dos purinas 5' y dos pirimidinas 3' . [66] [70] Además, las regiones flanqueantes fuera de este hexámero inmunoestimulante deben ser ricas en guanina para asegurar la unión y la captación en las células diana.
El sistema innato trabaja con el sistema inmunitario adaptativo para generar una respuesta contra la proteína codificada por el ADN. Las secuencias CpG-S inducen la activación de las células B policlonales y la regulación positiva de la expresión y secreción de citocinas. [73] Los macrófagos estimulados secretan IL-12, IL-18 , TNF-α, IFN-α, IFN-β e IFN-γ, mientras que las células B estimuladas secretan IL-6 y algo de IL-12. [21] [73] [74]
La manipulación de las secuencias CpG-S y CpG-N en la estructura plasmídica de las vacunas de ADN puede garantizar el éxito de la respuesta inmunitaria al antígeno codificado y conducir la respuesta inmunitaria hacia un fenotipo TH1. Esto es útil si un patógeno requiere una respuesta TH para su protección. Las secuencias CpG-S también se han utilizado como adyuvantes externos para la vacunación con ADN y proteínas recombinantes con tasas de éxito variables. Otros organismos con motivos CpG hipometilados han demostrado la estimulación de la expansión de células B policlonales. [75] El mecanismo detrás de esto puede ser más complicado que la simple metilación: no se ha descubierto que el ADN murino hipometilado genere una respuesta inmunitaria.
La mayor parte de la evidencia de secuencias CpG inmunoestimulantes proviene de estudios en ratones. La extrapolación de estos datos a otras especies requiere precaución: cada especie puede requerir diferentes secuencias flanqueantes, ya que las especificidades de unión de los receptores depuradores varían entre especies. Además, especies como los rumiantes pueden ser insensibles a las secuencias inmunoestimulantes debido a su gran carga gastrointestinal.
Las respuestas inmunitarias activadas con ADN pueden potenciarse mediante la administración de proteína recombinante o de poxvirus recombinantes. Las estrategias de "activación-potenciación" con proteína recombinante han logrado aumentar tanto el título de anticuerpos neutralizantes como la avidez y persistencia de los anticuerpos para inmunógenos débiles, como la proteína de la envoltura del VIH-1. [7] [76] Se ha demostrado que las potenciaciones con virus recombinantes son muy eficaces para potenciar las respuestas de CTL activadas con ADN. La activación con ADN centra la respuesta inmunitaria en el inmunógeno requerido, mientras que la potenciación con el virus recombinante proporciona una mayor cantidad de antígeno expresado, lo que conduce a un gran aumento de las respuestas de CTL específicas.
En varios estudios, las estrategias de sensibilización y refuerzo han tenido éxito en la inducción de protección contra el desafío de la malaria. Los ratones sensibilizados con ADN plasmídico que codifica la proteína de superficie de circumsporozoito de Plasmodium yoelii (PyCSP), luego reforzados con un virus vaccinia recombinante que expresa la misma proteína, tuvieron niveles significativamente más altos de anticuerpos, actividad CTL e IFN-γ, y por lo tanto niveles más altos de protección, que los ratones inmunizados y reforzados con ADN plasmídico solo. [77] Esto se puede mejorar aún más mediante la sensibilización con una mezcla de plásmidos que codifican PyCSP y GM-CSF murino, antes de reforzar con el virus vaccinia recombinante. [68] También se ha demostrado una estrategia de sensibilización y refuerzo eficaz para el modelo de malaria de simios P. knowlesi . [78] Se administró a monos Rhesus una vacuna de ADN multicomponente y multietapa que codificaba dos antígenos de la etapa hepática (la proteína de superficie del circumsporozoito [PkCSP] y la proteína de superficie del esporozoito 2 [PkSSP2]) y dos antígenos de la etapa sanguínea (la proteína de superficie del merozoito apical 1 [PkAMA1] y la proteína de superficie del merozoito 1 [PkMSP1p42]). Luego se les administró un refuerzo con un virus de la viruela del canario recombinante que codificaba los cuatro antígenos (ALVAC-4). Los monos inmunizados desarrollaron anticuerpos contra los esporozoitos y los eritrocitos infectados, y respuestas de células T secretoras de IFN-γ contra los péptidos de PkCSP. Se logró una protección parcial contra el desafío con esporozoitos y se redujo significativamente la parasitemia media, en comparación con los monos de control. Estos modelos, si bien no son ideales para la extrapolación a P. falciparum en humanos, serán importantes en los ensayos preclínicos.
La eficiencia de la inmunización con ADN se puede mejorar estabilizando el ADN contra la degradación y aumentando la eficiencia de la entrega de ADN a las células presentadoras de antígenos . [7] Esto se ha demostrado recubriendo micropartículas catiónicas biodegradables (como poli(lactida-co-glicolida) formulada con bromuro de cetiltrimetilamonio ) con ADN. Estas micropartículas recubiertas de ADN pueden ser tan efectivas para generar CTL como los virus recombinantes, especialmente cuando se mezclan con alumbre. Las partículas de 300 nm de diámetro parecen ser más eficientes para la captación por las células presentadoras de antígenos. [7]
Los vectores basados en alfavirus recombinantes se han utilizado para mejorar la eficiencia de la vacunación con ADN. [7] El gen que codifica el antígeno de interés se inserta en el replicón del alfavirus, reemplazando los genes estructurales pero dejando intactos los genes de la replicasa no estructural. El virus Sindbis y el virus del bosque Semliki se han utilizado para construir replicones de alfavirus recombinantes . A diferencia de las vacunas de ADN convencionales, los vectores de alfavirus matan las células transfectadas y solo se expresan transitoriamente. Los genes de la replicasa del alfavirus se expresan además del inserto de la vacuna. No está claro cómo los replicones de alfavirus generan una respuesta inmunitaria, pero puede deberse a los altos niveles de proteína expresados por este vector, respuestas de citocinas inducidas por el replicón o apoptosis inducida por el replicón que conduce a una mayor captación de antígenos por las células dendríticas.
{{cite book}}: |journal=ignorado ( ayuda )