El trilostano , que se vende bajo la marca Vetoryl , entre otras, es un medicamento que se ha utilizado en el tratamiento del síndrome de Cushing , el síndrome de Conn y el cáncer de mama posmenopáusico en humanos. [6] [7] [8] [9] [1] Se retiró para su uso en humanos en los Estados Unidos en la década de 1990 [10], pero posteriormente se aprobó para su uso en medicina veterinaria en la década de 2000 para tratar el síndrome de Cushing en perros. [11] Se toma por vía oral . [1]
El trilostano se ha utilizado en el tratamiento del síndrome de Cushing (hipercortisolismo), el síndrome de Conn (hiperaldosteronismo) y el cáncer de mama posmenopáusico en humanos. [7] [1] Cuando se usa para tratar el cáncer de mama, el trilostano se administra en combinación con un corticosteroide para prevenir la deficiencia de glucocorticoides . [1]
El trilostano no debe utilizarse en mujeres embarazadas . [1]
No se debe administrar trilostano a un perro que:
Los efectos secundarios del trilostano junto con un corticosteroide en humanos incluyen efectos secundarios gastrointestinales como gastritis , náuseas , vómitos y diarrea . [1] Los medicamentos antiinflamatorios no esteroides (AINE) pueden disminuir la incidencia de diarrea con trilostano. [1] Los efectos secundarios gastrointestinales graves del trilostano solo o en combinación con un AINE como úlcera péptica , gastritis erosiva , perforación gástrica , hematemesis y melena pueden ocurrir en algunas personas. [1] Puede ocurrir granulocitopenia reversible y parestesia oral transitoria con trilostano. [1]
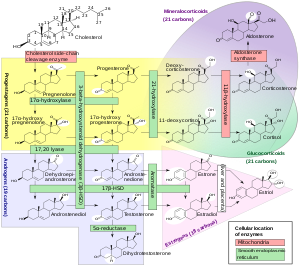
El trilostano es un inhibidor de la esteroidogénesis . [1] Es específicamente un inhibidor de la 3β-hidroxiesteroide deshidrogenasa (3β-HSD). [1] [15] Como resultado de esta acción, el trilostano bloquea la conversión de Δ 5 -3β- hidroxiesteroides , incluyendo pregnenolona , 17α-hidroxipregnenolona , dehidroepiandrosterona (DHEA) y androstenediol , en Δ 4 -3- cetoesteroides , incluyendo progesterona , 17α-hidroxiprogesterona , androstenediona y testosterona , respectivamente. [1] En consecuencia, el trilostano inhibe la producción de todas las clases de hormonas esteroides , incluyendo andrógenos , estrógenos , progestágenos , glucocorticoides y mineralocorticoides . [1]
El mecanismo de acción del trilostano en el síndrome de Cushing y el síndrome de Conn es inhibir la producción de corticosteroides como el cortisol y la aldosterona en las glándulas suprarrenales . [16] [17] El trilostano también se ha utilizado como abortivo debido a su inhibición de la síntesis de progesterona. [1] [18]
El trilostano no es un inhibidor de la aromatasa y, por lo tanto, no inhibe la conversión de andrógenos como la androstenediona y la testosterona en estrógenos como la estrona y el estradiol . [1] Sin embargo, el trilostano puede inhibir la síntesis de estrógenos al inhibir la síntesis de andrógenos. [1]
Además de la inhibición de la esteroidogénesis, se ha descubierto que el trilostano actúa como un antiestrógeno no competitivo , a través de interacciones directas y presumiblemente alostéricas con el receptor de estrógeno . [1] [19] [20] La eficacia del trilostano en el cáncer de mama posmenopáusico puede estar relacionada con esta aparente actividad antiestrogénica. [1] [19] [20] También se ha descubierto que el trilostano actúa como un agonista del receptor de andrógenos . [21] Como tal, su uso en hombres con cáncer de próstata puede justificar precaución. [1]
El trilostano se metaboliza en el hígado . [1] El principal metabolito del trilostano es el 17-cetotrilostano. [1] La conversión de trilostano en 17-cetotrilostano es reversible , lo que sugiere que el trilostano y el 17-cetotrilostano experimentan una interconversión en el cuerpo. [1] El 17-cetotrilostano circula a niveles 3 veces más altos que el trilostano y es más activo que el trilostano como inhibidor de 3β-HSD. [1] Las semividas de eliminación del trilostano y el 17-cetotrilostano son ambas de 1,2 horas, y ambos compuestos se eliminan de la sangre entre 6 y 8 horas después de una dosis de trilostano. [1] El 17-cetotrilostano se excreta por los riñones . [1]
El trilostano, también conocido como 4α,5-epoxi-3,17β-dihidroxi-5α-androst-2-eno-2-carbonitrilo, es un esteroide androstano sintético y un derivado de derivados androstano 5α-reducidos como 3α-androstanodiol , 3β-androstanodiol y dihidrotestosterona . [6]
El trilostano se prepara a partir de testosterona en una síntesis de cuatro pasos . [ cita requerida ]
El trilostano se retiró del mercado estadounidense para uso humano en abril de 1994. [22] [23] [10] Continuó estando disponible en el Reino Unido para uso en humanos bajo la marca Modrenal para el tratamiento de la enfermedad de Cushing y el cáncer de mama en humanos, pero finalmente se suspendió también en este país. [10] [24] [25] [26]
El trilostano fue aprobado en los Estados Unidos en 2008 para el tratamiento de la enfermedad de Cushing (hiperadrenocorticismo) en perros bajo la marca Vetoryl. [27] Estuvo disponible con receta médica en el Reino Unido para perros bajo la marca Vetoryl durante algún tiempo antes de que fuera aprobado en los Estados Unidos. [12] El fármaco también se utiliza para tratar el trastorno cutáneo alopecia X en perros. [22] [28] [29]
El trilostano fue el primer fármaco aprobado para tratar el síndrome de Cushing dependiente de la hipófisis y de las glándulas suprarrenales en perros. [ cita requerida ] Solo otro fármaco, Anipryl (nombre comercial veterinario) selegilina , está aprobado por la FDA para tratar la enfermedad de Cushing en perros, pero solo para tratar el síndrome de Cushing no complicado dependiente de la hipófisis. [30] El único tratamiento previo para la enfermedad fue el uso de mitotano (nombre comercial Lysodren) fuera de etiqueta . [31] [32]
Varias farmacias de Estados Unidos venden trilostano para perros. [ cita requerida ] Desde la aprobación de Vetoryl en Estados Unidos en diciembre de 2008, [27] las farmacias de medicamentos ya no pueden usar un producto farmacéutico a granel para fines de preparación de medicamentos, sino que deben preparar el medicamento a partir de Vetoryl. [33]
En marzo de 2024, el Comité de Medicamentos Veterinarios (CVMP) de la Agencia Europea de Medicamentos adoptó un dictamen positivo, recomendando la concesión de una autorización de comercialización para el medicamento veterinario Trilocur, suspensión oral para perros. [2] El solicitante de este medicamento veterinario es Emdoka. [2] En marzo de 2024, el CVMP adoptó un dictamen positivo, recomendando la concesión de una autorización de comercialización para el medicamento veterinario Trilorale, suspensión oral para perros. [3] El solicitante de este medicamento veterinario es Axience. [3] Trilocur y Trilorale fueron aprobados para uso médico en la Unión Europea en mayo de 2024. [34] [35]
Trilostano es el nombre genérico del medicamento y su DCI, USAN, PROHIBICIÓN, y ENE. [6] [7] Su nombre de código de desarrollo fue WIN-24,540 . [6] [7]
El trilostano se ha comercializado bajo varias marcas, entre ellas Desopan, Modrastane, Modrenal, Trilox, Vetoryl, Oncovet TL y Winstan. [6] [7]
El trilostano está disponible para uso veterinario en países de todo el mundo. [36]
El trilostano se utiliza para el tratamiento del síndrome de Cushing en perros. La seguridad y eficacia del trilostano para esta indicación se han demostrado en varios estudios. [26] [31] El éxito se midió mediante mejoras tanto en los resultados de los análisis de sangre como en los síntomas físicos (normalización del apetito y del nivel de actividad, y disminución del jadeo, la sed y la micción ). [26] [31]
5870 (6516) C20H2:NOs 13647-35-3 42,5-Epoxi-173-hidroxi-3-oxo-50-androstano-22carbonitrilo = (22,42,52,173)-4,5-Epoxi-17-hidroxi-3-oxoandrostano-2-carbonitrilo (e) S Desopan, Modrastane, Modrenal, Trilostane", Trilox, Win 24 540, Winstan U Supresor adrenocortical (inhibidor de la biosíntesis de esteroides)