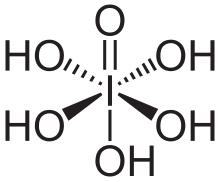
El ácido peryódico-Schiff ( PAS ) es un método de tinción utilizado para detectar polisacáridos como el glucógeno y mucosustancias como las glicoproteínas , los glicolípidos y las mucinas en los tejidos. La reacción del ácido peryódico oxida los dioles vecinales en estos azúcares , generalmente rompiendo el enlace entre dos carbonos adyacentes no involucrados en el enlace glucosídico o el cierre del anillo en el anillo de las unidades de monosacáridos que son partes de los polisacáridos largos, y creando un par de aldehídos en las dos puntas libres de cada anillo de monosacárido roto . La condición de oxidación tiene que estar suficientemente regulada para no oxidar más los aldehídos. Estos aldehídos luego reaccionan con el reactivo de Schiff para dar un color púrpura-magenta. A menudo se utiliza una tinción básica adecuada como contratinción .
• La tinción de PAS diastasa (PAS-D) es una tinción de PAS que se utiliza en combinación con la diastasa , una enzima que descompone el glucógeno.
• Azul alcián/ácido peryódico–Schiff (AB/PAS o AB-PAS) utiliza azul alcián antes del paso PAS.
_PAS_stain.jpg/440px-Gastric_signet_ring_cell_carcinoma_histopatholgy_(2)_PAS_stain.jpg)
_PAS_stain.jpg/440px-Esophageal_candidiasis_(2)_PAS_stain.jpg)

La tinción PAS se utiliza principalmente para teñir estructuras que contienen una alta proporción de macromoléculas de carbohidratos ( glucógeno , glicoproteína , proteoglicanos ), que normalmente se encuentran, por ejemplo, en los tejidos conectivos , el moco , el glicocáliz y las láminas basales .
La tinción de PAS se puede utilizar para ayudar en el diagnóstico de varias afecciones médicas:
La presencia de glucógeno se puede confirmar en una sección de tejido mediante la digestión con diastasa del glucógeno de una sección y luego comparar una sección de PAS digerida con diastasa con una sección de PAS normal. El portaobjetos negativo a la diastasa mostrará una tinción magenta donde haya glucógeno dentro de una sección de tejido. El portaobjetos que haya sido tratado con diastasa no tendrá tinción positiva a PAS en esas ubicaciones del portaobjetos.
La tinción PAS también se utiliza para teñir celulosa . Un ejemplo sería la búsqueda de dispositivos médicos implantados compuestos de celulosa no oxidada.
Si la tinción PAS se realizará en tejido, el fijador recomendado es formalina tamponada neutra al 10 % o solución de Bouin . Para frotis de sangre , el fijador recomendado es metanol . No se recomienda el glutaraldehído porque puede haber grupos aldehído libres disponibles para reaccionar con el reactivo de Schiff , lo que puede dar lugar a una tinción con falsos positivos . [4]