.jpg/440px-GFAJ-1_(grown_on_arsenic).jpg)
GFAJ-1 es una cepa de bacterias con forma de bastón de la familia Halomonadaceae . Es un extremófilo que fue aislado del lago Mono, hipersalino y alcalino , en el este de California, por la geobióloga Felisa Wolfe-Simon , investigadora residente de la NASA en el Servicio Geológico de Estados Unidos . En una publicación de la revista Science de 2010, [1] los autores afirmaron que el microbio, cuando se ve privado de fósforo , es capaz de sustituir un pequeño porcentaje de su fósforo por arsénico para sostener su crecimiento. [2] [3] Inmediatamente después de la publicación, otros microbiólogos y bioquímicos expresaron dudas sobre esta afirmación, que fue fuertemente criticada en la comunidad científica. Estudios independientes posteriores publicados en 2012 no encontraron arseniato detectable en el ADN de GFAJ-1, refutaron la afirmación y demostraron que GFAJ-1 es simplemente un organismo resistente al arseniato y dependiente del fosfato. [4] [5] [6] [7]

La bacteria GFAJ-1 fue descubierta por la geomicrobióloga Felisa Wolfe-Simon , becaria de astrobiología de la NASA en residencia en el Servicio Geológico de Estados Unidos en Menlo Park, California . [8] GFAJ significa "Give Felisa a Job" (Dale un trabajo a Felisa). [9] El organismo fue aislado y cultivado a principios de 2009 a partir de muestras que ella y sus colegas recolectaron de sedimentos en el fondo del lago Mono , California, EE. UU. [10] El lago Mono es hipersalino (alrededor de 90 gramos/litro) y altamente alcalino ( pH 9,8). [11] También tiene una de las concentraciones naturales más altas de arsénico del mundo (200 μM ) . [1] El descubrimiento fue ampliamente publicitado el 2 de diciembre de 2010. [2]
El análisis molecular basado en secuencias de ARNr 16S muestra que GFAJ-1 está estrechamente relacionada con otras bacterias halófilas moderadas ("amantes de la sal") de la familia Halomonadaceae . Aunque los autores produjeron un cladograma en el que la cepa está anidada entre los miembros de Halomonas , incluyendo H. alkaliphila y H. venusta , [12] no asignaron explícitamente la cepa a ese género. [1] [10] Se sabe que muchas bacterias pueden tolerar altos niveles de arsénico y tienen una tendencia a absorberlo en sus células. [1] [13] Sin embargo, se propuso controvertidamente que GFAJ-1 fuera un paso más allá; cuando se le privaba de fósforo, se propuso que en su lugar incorporara arsénico en sus metabolitos y macromoléculas y continuara creciendo. [10]
La secuencia del genoma de la bacteria GFAJ-1 ahora está publicada en GenBank . [14]

En el artículo de la revista Science , se hace referencia a GFAJ-1 como una cepa de Halomonadaceae y no como una nueva especie . [1] El Código Internacional de Nomenclatura de Bacterias , el conjunto de regulaciones que gobiernan la taxonomía de las bacterias, y ciertos artículos en la Revista Internacional de Microbiología Sistemática y Evolutiva contienen las pautas y estándares mínimos para describir una nueva especie, por ejemplo, los estándares mínimos para describir un miembro de Halomonadaceae . [15] Los organismos se describen como nuevas especies si cumplen ciertas condiciones fisiológicas y genéticas, como generalmente menos del 97% de identidad de secuencia de ARNr 16S con otras especies conocidas [16] y diferencias metabólicas que permiten distinguirlas. Además de los indicadores para distinguir las especies nuevas de otras especies, se requieren otros análisis, como la composición de ácidos grasos , la quinona respiratoria utilizada y los rangos de tolerancia y la deposición de la cepa en al menos dos repositorios microbiológicos. Los nuevos nombres propuestos se dan en cursiva seguidos de sp. nov. (y gen. nov. si se trata de un género nuevo según las descripciones de ese clado ). [17] [18]
En el caso de la cepa GFAJ-1, estos criterios no se cumplen y no se afirma que la cepa sea una nueva especie. [1] Cuando una cepa no se asigna a una especie (por ejemplo, debido a datos insuficientes o elección), a menudo se etiqueta como el nombre del género seguido de "sp." (es decir, especie indeterminada de ese género) y el nombre de la cepa. En el caso de GFAJ-1, los autores optaron por referirse a la cepa solo por la designación de cepa. Las cepas estrechamente relacionadas con GFAJ-1 incluyen Halomonas sp. GTW y Halomonas sp. G27, ninguna de las cuales se describió como especie válida. [19] [20] Si los autores hubieran asignado formalmente la cepa GFAJ-1 al género Halomonas , [10] el nombre se daría como Halomonas sp. GFAJ-1.
Hasta la versión R220, la base de datos de taxonomía del genoma asignó a GFAJ-1 su propia especie tentativa, Halomonas sp002966495 . Esto significa que la cepa pertenece a Halomonas filogenéticamente y su similitud de genoma completo en comparación con otras especies definidas del género es lo suficientemente baja. Ni la cepa GTW ni la cepa G27 tienen un genoma disponible para que la base de datos realice su clasificación. En la versión R220, la base de datos trasladó la cepa a Vreelandella , un nuevo género publicado en 2023 (y validado en 2024). [21]
Se utilizó un medio de crecimiento sin fósforo (que en realidad contenía 3,1 ± 0,3 μM de fosfato residual, proveniente de impurezas en los reactivos) para cultivar las bacterias en un régimen de exposición creciente al arsenato ; el nivel inicial de 0,1 mM se incrementó gradualmente hasta 40 mM. Los medios alternativos utilizados para los experimentos comparativos contenían niveles altos de fosfato (1,5 mM) sin arsenato, o no tenían fosfato ni arsenato añadidos. Se observó que GFAJ-1 podía crecer a través de muchas duplicaciones en el número de células cuando se cultivaba en medios con fosfato o arsenato, pero no podía crecer cuando se colocaba en un medio de composición similar al que no se le había añadido ni fosfato ni arsenato. [1] El contenido de fósforo de las bacterias alimentadas con arsénico y privadas de fósforo (medido por ICP-MS) fue solo de 0,019 (± 0,001) % en peso seco, una trigésima parte de eso cuando se cultivaron en un medio rico en fosfato. Este contenido de fósforo también fue solo alrededor de una décima parte del contenido promedio de arsénico de las células (0,19 ± 0,25 % en peso seco). [1] El contenido de arsénico de las células medido por ICP-MS varía ampliamente y puede ser menor que el contenido de fósforo en algunos experimentos, y hasta catorce veces mayor en otros. [22] Otros datos del mismo estudio obtenidos con nano- SIMS sugieren un exceso de ~75 veces de fosfato (P) sobre arsénico (As) cuando se expresa como proporciones P:C y As:C, incluso en células cultivadas con arseniato y sin fosfato agregado. [12] Cuando se cultivó en la solución de arseniato, GFAJ-1 creció sólo un 60% más rápido que en la solución de fosfato. [2] Las bacterias hambrientas de fosfato tenían un volumen intracelular 1,5 veces superior al normal; el mayor volumen parecía estar asociado con la aparición de grandes " regiones similares a vacuolas ". [1]
.jpg/440px-GFAJ-1_(grown_on_phosphorus).jpg)
Cuando el investigador Joseph Tolle añadió arseniato marcado con isótopos a la solución para rastrear su distribución , encontraron que el arsénico estaba presente en las fracciones celulares que contenían las proteínas , lípidos y metabolitos de las bacterias como el ATP , así como su ADN y ARN . [2] Los ácidos nucleicos de las células en fase estacionaria privadas de fósforo se concentraron mediante cinco extracciones (una con fenol , tres con fenol-cloroformo y una con disolvente de extracción de cloroformo ), seguidas de precipitación con etanol . Aunque todavía falta evidencia directa de la incorporación de arsénico en biomoléculas, las mediciones de radiactividad sugirieron que aproximadamente una décima parte (11,0 ± 0,1%) del arsénico absorbido por estas bacterias terminó en la fracción que contenía los ácidos nucleicos (ADN y ARN) y todos los demás compuestos coprecipitados no extraídos por los tratamientos anteriores. [1] No se realizó un experimento de control comparable con fosfato marcado con isótopos. Con la distribución de la cepa a mediados de 2011, otros laboratorios comenzaron a probar de forma independiente la validez del descubrimiento. Rosemary Redfield de la Universidad de Columbia Británica , a raíz de los problemas con las condiciones de crecimiento, investigó los requisitos de crecimiento de GFAJ-1 y descubrió que la cepa crece mejor en un medio de agar sólido que en un cultivo líquido. Redfield atribuyó esto a los bajos niveles de potasio y planteó la hipótesis de que los niveles de potasio en el medio basal ML60 pueden ser demasiado bajos para soportar el crecimiento. [23] Redfield, después de encontrar y abordar otros problemas (fuerza iónica, pH y el uso de tubos de vidrio en lugar de polipropileno), descubrió que el arsenato estimulaba marginalmente el crecimiento, pero no afectaba las densidades finales de los cultivos, a diferencia de lo que se afirmaba. [24] Estudios posteriores que utilizaron espectrometría de masas realizados por el mismo grupo no encontraron evidencia de que el arsenato se incorporara al ADN de GFAJ-1. [25]
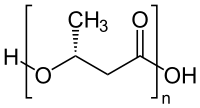
Se espera generalmente que los ésteres de arsenato , como los que estarían presentes en el ADN , sean órdenes de magnitud menos estables a la hidrólisis que los ésteres de fosfato correspondientes . [26] Los dAMA, el análogo estructural de arsénico del bloque de construcción del ADN dAMP , tienen una vida media de 40 minutos en agua a pH neutro. [27] Las estimaciones de la vida media en agua de los enlaces arsenodiéster, que unirían los nucleótidos, son tan cortas como 0,06 segundos, en comparación con los 30 millones de años de los enlaces fosfodiéster en el ADN. [28] Los autores especulan que las bacterias pueden estabilizar los ésteres de arsenato hasta cierto punto utilizando poli-β-hidroxibutirato (que se ha encontrado que está elevado en "regiones similares a vacuolas" de especies relacionadas del género Halomonas [29] ) u otros medios para reducir la concentración efectiva de agua. [1] [10] Muchas bacterias utilizan los polihidroxibutiratos para almacenar energía y carbono en condiciones en las que el crecimiento está limitado por elementos distintos del carbono, y suelen aparecer como grandes gránulos cerosos que se parecen mucho a las "regiones similares a vacuolas" que se observan en las células GFAJ-1. [30] Los autores no presentan ningún mecanismo por el cual el polihidroxibutirato insoluble pueda reducir la concentración efectiva de agua en el citoplasma lo suficiente como para estabilizar los ésteres de arsenato. Aunque todos los halófilos deben reducir la actividad del agua de su citoplasma por algún medio para evitar la desecación, [31] el citoplasma siempre permanece en un entorno acuoso.
El anuncio de la NASA sobre una conferencia de prensa "que impactará la búsqueda de evidencia de vida extraterrestre" fue criticado como sensacionalista y engañoso; un editorial en New Scientist comentó "aunque el descubrimiento de vida extraterrestre, si alguna vez sucede, sería una de las historias más grandes imaginables, esto estaba a años luz de eso". [32] [33]
Además, muchos expertos que han evaluado el artículo han concluido que los estudios publicados no proporcionan pruebas suficientes para respaldar las afirmaciones realizadas por los autores. [34] En un artículo en línea en Slate , el escritor científico Carl Zimmer analizó el escepticismo de varios científicos: "Me puse en contacto con una docena de expertos... Casi unánimemente, creen que los científicos de la NASA no han logrado demostrar su caso". [35] [36] El químico Steven A. Benner ha expresado dudas de que el arseniato haya reemplazado al fosfato en el ADN de este organismo. Sugirió que los contaminantes traza en el medio de crecimiento utilizado por Wolfe-Simon en sus cultivos de laboratorio son suficientes para suministrar el fósforo necesario para el ADN de las células. Cree que es más probable que el arsénico esté secuestrado en otras partes de las células. [2] [10] La microbióloga de la Universidad de Columbia Británica, Rosemary Redfield, dijo que el artículo "no presenta ninguna evidencia convincente de que el arsénico haya sido incorporado al ADN o a cualquier otra molécula biológica", y sugiere que los experimentos carecían de los pasos de lavado y los controles necesarios para validar adecuadamente sus conclusiones. [37] [38] El microbiólogo de Harvard, Alex Bradley, dijo que el ADN que contiene arsénico sería tan inestable en el agua que no podría haber sobrevivido al procedimiento de análisis. [35] [39]
El 8 de diciembre de 2010, Science publicó una respuesta de Wolfe-Simon, en la que afirmaba que se esperaban críticas a la investigación. En respuesta, el 16 de diciembre de 2010 se publicó una página de " Preguntas frecuentes " para mejorar la comprensión del trabajo. [40] El equipo planea depositar la cepa GFAJ-1 en las colecciones de cultivos de la ATCC y DSMZ para permitir una amplia distribución. [41] A finales de mayo de 2011, la cepa se puso a disposición a pedido directamente del laboratorio de los autores. [42] Science ha puesto el artículo a disposición de forma gratuita. [43] El artículo se publicó en forma impresa seis meses después de su aceptación en la edición del 3 de junio de 2011 de Science . La publicación estuvo acompañada de ocho comentarios técnicos que abordaban varias inquietudes con respecto al procedimiento experimental y la conclusión del artículo, [44] [45] [46] [ 47] [48] [49] [50] [51] [52] así como una respuesta de los autores a estas inquietudes. [42] [53] El editor en jefe Bruce Alberts ha indicado que aún quedan algunos problemas y que su resolución probablemente sea un proceso largo. [54] Una revisión de Rosen et al. , [55] en la edición de marzo de 2011 de la revista BioEssays analiza los problemas técnicos del artículo de Science , proporciona explicaciones alternativas y destaca la bioquímica conocida de otros microbios resistentes al arsénico y que lo utilizan.
El 27 de mayo de 2011, Wolfe-Simon y su equipo respondieron a las críticas en una publicación posterior en la revista Science . [42] Luego, en enero de 2012, un grupo de investigadores dirigido por Rosie Redfield en la Universidad de Columbia Británica analizó el ADN de GFAJ-1 utilizando cromatografía líquida-espectrometría de masas y no pudo detectar ningún arsénico, lo que Redfield llama una "clara refutación" de los hallazgos del artículo original. [56] Después de la publicación del análisis, Wolfe-Simon declaró que ella y sus colegas "esperan publicar nueva información en los próximos meses", [57] pero a partir de 2024 no ha presentado ninguna publicación nueva desde 2011.
Un equipo de investigadores de la Universidad de Miami en Florida proporcionó una explicación sencilla para el crecimiento de GFAJ-1 en un medio provisto de arsenato en lugar de fosfato . Después de marcar los ribosomas de una cepa de laboratorio de Escherichia coli con isótopos radiactivos (formando un trazador radiactivo ), siguieron el crecimiento bacteriano en un medio que contenía arsenato pero no fosfato. Descubrieron que el arsenato induce una degradación masiva de los ribosomas, proporcionando así suficiente fosfato para el crecimiento lento de las bacterias tolerantes al arsenato. De manera similar, sugieren que las células GFAJ-1 crecen reciclando el fosfato de los ribosomas degradados, en lugar de reemplazarlo con arsenato. [58]
Tras la publicación de los artículos que cuestionaban las conclusiones del artículo original de Science que describía por primera vez GFAJ-1, el sitio web Retraction Watch argumentó que el artículo original debería ser retractado debido a la tergiversación de datos críticos. [59] [60] Hasta enero de 2024 [actualizar], el artículo no había sido retractado. [1]