En química , la selectividad de unión se define con respecto a la unión de ligandos a un sustrato formando un complejo . La selectividad de unión describe cómo un ligando puede unirse más preferentemente a un receptor que a otro. Un coeficiente de selectividad es la constante de equilibrio para la reacción de desplazamiento por un ligando de otro ligando en un complejo con el sustrato. La selectividad de unión es de gran importancia en bioquímica [1] y en procesos de separación química .
El concepto de selectividad se utiliza para cuantificar el grado en que una sustancia química, A, se une a otras dos sustancias químicas, B y C. El caso más simple es cuando los complejos formados tienen estequiometría 1:1 . Entonces, las dos interacciones pueden caracterizarse por las constantes de equilibrio K AB y K AC . [nota 1]
Un coeficiente de selectividad se define como la relación entre las dos constantes de equilibrio.
Es fácil demostrar que la misma definición se aplica a complejos de diferente estequiometría, A p B q y A p C q . Cuanto mayor sea el coeficiente de selectividad, más desplazará el ligando C al ligando B del complejo formado con el sustrato A. Una interpretación alternativa es que cuanto mayor sea el coeficiente de selectividad, menor será la concentración de C necesaria para desplazar a B de AB. . Los coeficientes de selectividad se determinan experimentalmente midiendo las dos constantes de equilibrio, K AB y K AC .
En bioquímica el sustrato se conoce como receptor. Un receptor es una molécula de proteína , incrustada en la membrana plasmática o en el citoplasma de una célula, a la que se pueden unir uno o más tipos específicos de moléculas de señalización. Un ligando puede ser un péptido u otra molécula pequeña, como un neurotransmisor , una hormona , un fármaco o una toxina. La especificidad de un receptor está determinada por su geometría espacial y la forma en que se une al ligando mediante interacciones no covalentes , como los enlaces de hidrógeno o las fuerzas de Van der Waals . [2]
Si se puede aislar un receptor, se puede desarrollar un fármaco sintético para estimular el receptor, un agonista , o para bloquearlo, un antagonista . El fármaco cimetidina para la úlcera de estómago se desarrolló como antagonista H 2 mediante ingeniería química de la molécula para lograr la máxima especificidad en un tejido aislado que contiene el receptor. El uso posterior de relaciones cuantitativas estructura-actividad (QSAR) condujo al desarrollo de otros agentes como la ranitidina .
Es importante señalar que la "selectividad" cuando se hace referencia a un fármaco es relativa y no absoluta. Por ejemplo, en una dosis más alta, una molécula de fármaco específica también puede unirse a otros receptores además de los que se dice que son "selectivos".
La terapia de quelación es una forma de tratamiento médico en el que se utiliza un ligando quelante [nota 2] para eliminar selectivamente un metal del cuerpo. Cuando el metal existe como ion divalente, como en el caso del plomo , Pb 2+ o mercurio , Hg 2+, la selectividad frente al calcio , Ca 2+ y el magnesio , Mg 2+ , es esencial para que el tratamiento no elimine los metales esenciales. [3]
La selectividad está determinada por varios factores. En el caso de sobrecarga de hierro , que puede ocurrir en personas con β- talessemia que han recibido transfusiones de sangre , el ion metálico objetivo está en el estado de oxidación +3 y, por lo tanto, forma complejos más fuertes que los iones divalentes. También forma complejos más fuertes con ligandos donantes de oxígeno que con ligandos donantes de nitrógeno. deferoxamina , un sideróforo natural producido por el actinobacter Streptomyces pilosus y que se utilizó inicialmente como agente de terapia de quelación. Se han desarrollado sideróforos sintéticos como la deferiprona y el deferasirox , utilizando como punto de partida la estructura conocida de la deferoxamina. [4] [5] La quelación se produce con los dos átomos de oxígeno.
La enfermedad de Wilson es causada por un defecto en el metabolismo del cobre que resulta en la acumulación de cobre metálico en varios órganos del cuerpo. El ion objetivo en este caso es divalente, Cu 2+ . Este ion se clasifica como límite en el esquema de Ahrland, Chatt y Davies. [6] Esto significa que forma complejos aproximadamente igualmente fuertes con ligandos cuyos átomos donantes son N, O o F que con ligandos cuyos átomos donantes son P, S o Cl. La penicilamina , que contiene átomos donantes de nitrógeno y azufre, se utiliza ya que este tipo de ligando se une más fuertemente a los iones de cobre que a los iones de calcio y magnesio.
El tratamiento del envenenamiento por metales pesados como el plomo y el mercurio es más problemático porque los ligandos utilizados no tienen una alta especificidad en relación con el calcio. Por ejemplo, se puede administrar EDTA como una sal de calcio para reducir la eliminación de calcio del hueso junto con el metal pesado. Se han revisado los factores que determinan la selectividad del plomo frente al zinc, cadmio y calcio, [7]
En la cromatografía en columna, una mezcla de sustancias se disuelve en una fase móvil y se pasa a través de una fase estacionaria en una columna. Un factor de selectividad se define como la relación de coeficientes de distribución , que describen la distribución de equilibrio de un analito entre la fase estacionaria y la fase móvil. El factor de selectividad es igual al coeficiente de selectividad con el supuesto añadido de que la actividad de la fase estacionaria, el sustrato en este caso, es igual a 1, el supuesto estándar para una fase pura. [8] La resolución de una columna cromatográfica, R S, está relacionada con el factor de selectividad mediante:
donde α es el factor de selectividad, N es el número de placas teóricas k A y k B son los factores de retención de los dos analitos. Los factores de retención son proporcionales a los coeficientes de distribución. En la práctica se pueden separar sustancias con un factor de selectividad muy cercano a 1. Esto es particularmente cierto en la cromatografía gas-líquido, donde son posibles longitudes de columna de hasta 60 m, lo que proporciona un gran número de platos teóricos.
En la cromatografía de intercambio iónico, el coeficiente de selectividad se define de una manera ligeramente diferente [9]
La extracción con solventes [10] se utiliza para extraer elementos lantánidos individuales de las mezclas que se encuentran en la naturaleza en minerales como la monacita . En un proceso, los iones metálicos en solución acuosa se hacen formar complejos con tributilfosfato (TBP), que se extraen en un disolvente orgánico como el queroseno . La separación completa se logra mediante el uso de un método de intercambio a contracorriente . Varias células están dispuestas en cascada . Después del equilibrio, el componente acuoso de cada celda se transfiere a la celda anterior y el componente orgánico se transfiere a la siguiente celda, que inicialmente contiene solo agua. De esta manera, el ion metálico con el complejo más estable pasa por la cascada en la fase orgánica y el metal con el complejo menos estable sube por la cascada en la fase acuosa. [11]
Si la solubilidad en la fase orgánica no es un problema, un coeficiente de selectividad es igual a la relación de las constantes de estabilidad de los complejos TBP de dos iones metálicos. Para los elementos lantánidos adyacentes en la tabla periódica, esta proporción no es mucho mayor que 1, por lo que se necesitan muchas células en la cascada.
Un coeficiente de selectividad potenciométrica define la capacidad de un electrodo selectivo de iones para distinguir un ion particular de otros. El coeficiente de selectividad, KB ,C, se evalúa mediante la respuesta de fem del electrodo selectivo de iones en soluciones mixtas del ion primario, B, y del ion de interferencia, C (método de interferencia fija) o, menos deseablemente, en soluciones separadas de B y C (método de solución separada). [12] Por ejemplo, un electrodo de membrana selectivo para iones potasio utiliza el antibiótico macrocíclico natural valinomicina . En este caso, la cavidad en el anillo macrocíclico tiene el tamaño justo para encapsular el ion potasio, pero es demasiado grande para unir fuertemente el ion sodio, la interferencia más probable.
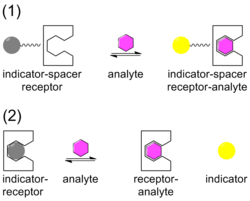
Se están desarrollando sensores químicos , [13] [14] para moléculas e iones objetivo específicos en los que el objetivo (huésped) forma un complejo con un sensor (anfitrión). El sensor está diseñado para ser una excelente combinación en términos de tamaño y forma del objetivo con el fin de proporcionar la máxima selectividad de vinculación. Un indicador está asociado con el sensor que sufre un cambio cuando el objetivo forma un complejo con el sensor. El cambio de indicador suele ser un cambio de color (de gris a amarillo en la ilustración) que se observa en absorbancia o, con mayor sensibilidad, en luminiscencia . El indicador puede estar unido al sensor mediante un espaciador, en la disposición ISR, o puede desplazarse del sensor, disposición IDA.