

En química , un radical , también conocido como radical libre , es un átomo , molécula o ion que tiene al menos un electrón de valencia desapareado . [1] [2] Con algunas excepciones, estos electrones desapareados hacen que los radicales sean altamente reactivos químicamente . Muchos radicales se dimerizan espontáneamente . La mayoría de los radicales orgánicos tienen vidas cortas.
Un ejemplo notable de radical es el radical hidroxilo (HO · ), una molécula que tiene un electrón desapareado en el átomo de oxígeno. Otros dos ejemplos son el triplete de oxígeno y el triplete de carbeno ( ꞉ CH
2) que tienen dos electrones desapareados.
Los radicales se pueden generar de varias maneras, pero los métodos típicos implican reacciones redox . Se sabe que la radiación ionizante , el calor, las descargas eléctricas y la electrólisis producen radicales. Los radicales son intermediarios en muchas reacciones químicas, más de lo que se desprende de las ecuaciones balanceadas.
Los radicales son importantes en la combustión , la química atmosférica , la polimerización , la química del plasma , la bioquímica y muchos otros procesos químicos. La mayoría de los productos naturales son generados por enzimas generadoras de radicales. En los organismos vivos, los radicales superóxido y óxido nítrico y sus productos de reacción regulan muchos procesos, como el control del tono vascular y, por tanto, de la presión arterial. También desempeñan un papel clave en el metabolismo intermediario de diversos compuestos biológicos. Estos radicales pueden incluso ser mensajeros en un proceso denominado señalización redox . Un radical puede quedar atrapado dentro de una jaula de disolvente o unirse de otro modo.
Los radicales se forman (1) a partir de moléculas con pares de espines o (2) a partir de otros radicales. Los radicales se forman a partir de moléculas con pares de espines mediante homólisis de enlaces débiles o transferencia de electrones, también conocida como reducción. Los radicales se forman a partir de otros radicales mediante reacciones de sustitución, adición y eliminación.
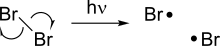
La homólisis genera dos nuevos radicales a partir de una molécula con pares de espines rompiendo un enlace covalente, dejando cada uno de los fragmentos con uno de los electrones del enlace. [3] Debido a que romper un enlace químico requiere energía, la homólisis se produce mediante la adición de calor o luz. La energía de disociación del enlace asociada con la homólisis depende de la estabilidad de un compuesto determinado, y algunos enlaces débiles pueden homolizarse a temperaturas relativamente más bajas.
Algunas reacciones de homólisis son particularmente importantes porque sirven como iniciador de otras reacciones radicales. Un ejemplo de ello es la homólisis de los halógenos, que se produce bajo la luz y sirve como fuerza impulsora para reacciones de halogenación radical.
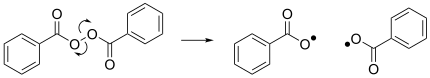
Otra reacción notable es la homólisis del peróxido de dibenzoilo, que da como resultado la formación de dos radicales benzoiloxi y actúa como iniciador de muchas reacciones radicalarias. [4]

Clásicamente los radicales se forman por reducciones de un electrón . Normalmente, los compuestos orgánicos reducidos en un electrón son inestables. La estabilidad se confiere al anión radical cuando la carga puede deslocalizarse . Los ejemplos incluyen naftenuros , antracenuros y cetilos de metales alcalinos .

La extracción de hidrógeno genera radicales. Para lograr esta reacción, el enlace CH del donante del átomo de H debe ser débil, lo que rara vez ocurre en compuestos orgánicos. Los enlaces CH alílicos y especialmente los doblemente alílicos son propensos a ser abstraídos por el O 2 . Esta reacción es la base de los aceites secantes , como los derivados del ácido linoleico .
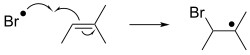
En las adiciones de radicales libres , un radical se agrega a un sustrato de pares de espines. Cuando se aplica a compuestos orgánicos, la reacción suele implicar la adición de un alqueno. Esta adición genera un nuevo radical, que puede agregarse a otro alqueno, etc. Este comportamiento sustenta la polimerización radical , tecnología que produce muchos plásticos . [5] [6]
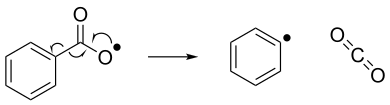
La eliminación de radicales puede verse como lo contrario de la adición de radicales. En la eliminación de radicales, un compuesto radical inestable se descompone en una molécula de espín emparejado y un nuevo compuesto radical. A continuación se muestra un ejemplo de una reacción de eliminación de radicales, donde un radical benzoiloxi se descompone en un radical fenilo y una molécula de dióxido de carbono. [7]
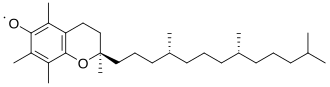
Aunque los radicales orgánicos son generalmente estables intrínsecamente (de forma aislada), en la práctica su existencia es sólo transitoria porque tienden a dimerizarse. Algunos son bastante longevos. Generalmente los radicales orgánicos se estabilizan por cualquiera o todos estos factores: presencia de electronegatividad, deslocalización e impedimento estérico. [8] El compuesto 2,2,6,6-tetrametilpiperidiniloxilo ilustra la combinación de los tres factores. Es un sólido disponible comercialmente que, además de ser magnético, se comporta como un compuesto orgánico normal.
Los radicales orgánicos son inherentemente deficientes en electrones, por lo que cuanto mayor es la electronegatividad del átomo en el que reside el electrón desapareado, menos estable es el radical. [9] Entre el carbono, el nitrógeno y el oxígeno, por ejemplo, el carbono es el más estable y el oxígeno el menos estable.
La electronegatividad también influye en la estabilidad de los átomos de carbono de diferentes hibridaciones. Un carácter s mayor se correlaciona con una electronegatividad más alta del átomo de carbono (debido a la proximidad de los orbitales s al núcleo), y cuanto mayor es la electronegatividad, menos estable es un radical. [9] Los carbonos con hibridación sp (50% de carácter s) forman los radicales menos estables en comparación con los carbonos con hibridación sp3 (25% de carácter s) que forman los radicales más estables.
La deslocalización de electrones a través de la estructura de un radical, también conocida como su capacidad para formar una o más estructuras de resonancia, permite que la deficiencia de electrones se distribuya entre varios átomos, minimizando la inestabilidad. La deslocalización generalmente ocurre en presencia de grupos donadores de electrones, como grupos hidroxilo (-OH), éteres (-OR), alquenos adyacentes y aminas (-NH 2 o -NR), o grupos aceptores de electrones, como C. =O o C≡N. [3]

Los efectos de deslocalización también pueden entenderse utilizando la teoría de los orbitales moleculares como lente, más específicamente, examinando la interacción intramolecular del electrón desapareado con el par de electrones de un grupo donante o el orbital π* vacío de un grupo aceptor de electrones en forma de un diagrama de orbitales moleculares. El HOMO de un radical está ocupado individualmente, por lo que el orbital se denomina acertadamente SOMO, o Orbital Molecular Individualmente Ocupado. Para un grupo donante de electrones, el SOMO interactúa con el par solitario de menor energía para formar un nuevo orbital enlazante lleno de menor energía y un nuevo SOMO lleno individualmente, de mayor energía que el original. Si bien la energía del electrón desapareado ha aumentado, la disminución de energía del par solitario que forma el nuevo orbital de enlace compensa el aumento de energía del nuevo SOMO, lo que resulta en una disminución neta de la energía de la molécula. Por tanto, los grupos donadores de electrones ayudan a estabilizar los radicales.

Con un grupo que, en cambio, es aceptor de electrones, el SOMO interactúa con el orbital π* vacío. No hay electrones que ocupen el orbital de mayor energía formado, mientras que se forma un nuevo SOMO que tiene menor energía. Esto da como resultado una menor energía y una mayor estabilidad de las especies radicales. Tanto los grupos donantes como los grupos retirados estabilizan a los radicales.
Otra forma de deslocalización conocida, aunque más débil, es la hiperconjugación . En la química radical, los radicales se estabilizan mediante hiperconjugación con grupos alquilo adyacentes. La donación de enlaces sigma (σ) C-H en los orbitales radicales parcialmente vacíos ayuda a diferenciar las estabilidades de los radicales en los carbonos terciario, secundario y primario. Los radicales de carbono terciario tienen tres enlaces σ CH que donan, los radicales secundarios solo dos y los radicales primarios solo uno. Por tanto, los radicales terciarios son los más estables y los radicales primarios los menos estables.
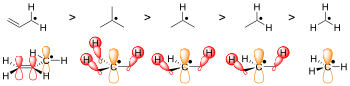

En pocas palabras, cuanto mayor es el impedimento estérico, más difícil es que se produzcan reacciones, y la forma radical se ve favorecida por defecto. Por ejemplo, compare la forma extraída de hidrógeno de N -hidroxipiperidina con la molécula TEMPO . [3] TEMPO, o (2,2,6,6-tetrametilpiperidin-1-il)oxilo, está demasiado estéricamente impedido por los grupos metilo adicionales para reaccionar, lo que lo hace lo suficientemente estable como para venderse comercialmente en su forma radical. La N -hidroxipiperidina, sin embargo, no tiene los cuatro grupos metilo que impidan la reacción de una molécula, por lo que la estructura es inestable. [3]
La estabilidad de muchos (o la mayoría) de los radicales orgánicos no está indicada por su aislabilidad sino que se manifiesta en su capacidad para funcionar como donantes de H • . Esta propiedad refleja un enlace debilitado con el hidrógeno, generalmente O-H pero a veces N-H o C-H. Este comportamiento es importante porque estos donantes de H • sirven como antioxidantes en biología y en el comercio. Es ilustrativo el α-tocoferol ( vitamina E ). El radical tocoferol en sí no es suficientemente estable para su aislamiento, pero la molécula original es un donador de átomos de hidrógeno muy eficaz. El enlace C-H está debilitado en los derivados de trifenilmetilo (tritilo).

Una gran variedad de radicales inorgánicos son estables y, de hecho, aislables. Los ejemplos incluyen la mayoría de los complejos de metales de transición de primera fila.
Con respecto a los radicales del grupo principal, el radical más abundante del universo es también la sustancia química más abundante del universo, H • . Sin embargo, la mayoría de los radicales del grupo principal no son aislables , a pesar de su estabilidad intrínseca. Los radicales hidrógeno, por ejemplo, se combinan rápidamente para formar H2 . El óxido nítrico (NO) es un ejemplo bien conocido de radical inorgánico aislable. La sal de Fremy (nitrosodisulfonato de potasio, (KSO 3 ) 2 NO) es un ejemplo relacionado. Se conocen muchos radicales tiazilo , a pesar del grado limitado de estabilización por resonancia π . [10] [11]
Muchos radicales pueden considerarse como productos de la rotura de enlaces covalentes por homólisis . Las energías de disociación del enlace homolítico , generalmente abreviadas como "Δ H °", son una medida de la fuerza del enlace. Dividir H 2 en 2 H • , por ejemplo, requiere un Δ H ° de +435 kJ/mol , mientras que dividir Cl 2 en dos Cl • requiere un Δ H ° de +243 kJ/mol. Para enlaces débiles, la homólisis se puede inducir térmicamente. Los enlaces fuertes requieren fotones de alta energía o incluso llamas para inducir la homólisis.
Los dirradicales son moléculas que contienen dos centros radicales. El dioxígeno (O 2 ) es un ejemplo importante de diradical estable. El oxígeno singlete , el estado no radical del dioxígeno de menor energía, es menos estable que el diradical debido a la regla de multiplicidad máxima de Hund . La estabilidad relativa del diradical de oxígeno se debe principalmente a la naturaleza de espín prohibido de la transición triplete-singlete necesaria para que capture electrones, es decir, " oxide ". El estado diradical del oxígeno también resulta en su carácter paramagnético, que se demuestra por su atracción por un imán externo. [12] Los dirradicales también pueden aparecer en complejos metal-oxo , lo que se presta para estudios de reacciones prohibidas de espín en la química de los metales de transición . [13] Los carbenos en su estado triplete pueden verse como dirradicales centrados en el mismo átomo, mientras que estos suelen ser carbenos persistentes altamente reactivos , siendo los carbenos N-heterocíclicos el ejemplo más común.
Los carbenos y nitrenos tripletes son dirradicales. Sus propiedades químicas son distintas de las propiedades de sus análogos singlete.

Una reacción radical familiar es la combustión . La molécula de oxígeno es un diradical estable , mejor representado por • O–O • . Como los espines de los electrones son paralelos, esta molécula es estable. Si bien el estado fundamental del oxígeno es este diradical de espín no apareado ( triplete ) no reactivo, está disponible un estado de espín apareado ( singlete ) extremadamente reactivo. Para que se produzca la combustión es necesario superar la barrera energética entre estos. Esta barrera puede superarse con el calor, lo que requiere altas temperaturas. La transición triplete-singlete también está " prohibida ". Esto presenta una barrera adicional a la reacción. También significa que el oxígeno molecular es relativamente poco reactivo a temperatura ambiente, excepto en presencia de un átomo catalítico pesado como el hierro o el cobre.
La combustión consta de varias reacciones en cadena radicales que el radical singlete puede iniciar. La inflamabilidad de un material determinado depende en gran medida de la concentración de radicales que deben obtenerse antes de que dominen las reacciones de iniciación y propagación que conduzcan a la combustión del material. Una vez consumido el material combustible, vuelven a dominar las reacciones de extinción y la llama se apaga. Como se indicó, la promoción de reacciones de propagación o terminación altera la inflamabilidad. Por ejemplo, debido a que el plomo mismo desactiva los radicales en la mezcla de gasolina y aire, alguna vez se agregó tetraetilo de plomo a la gasolina. Esto evita que la combustión se inicie de forma incontrolada o con residuos no quemados ( golpes del motor ) o un encendido prematuro ( preignición ).
Cuando se quema un hidrocarburo, intervienen una gran cantidad de radicales de oxígeno diferentes. Inicialmente se forma el radical hidroperoxilo (HOO • ). Luego estos reaccionan aún más para dar hidroperóxidos orgánicos que se descomponen en radicales hidroxilo (HO • ).
Muchas reacciones de polimerización son iniciadas por radicales. La polimerización implica la adición de un radical inicial a un no radical (generalmente un alqueno) para dar nuevos radicales. Este proceso es la base de la reacción en cadena radicalaria. El arte de la polimerización implica el método mediante el cual se introduce el radical iniciador. Por ejemplo, el metacrilato de metilo (MMA) se puede polimerizar para producir poli(metacrilato de metilo) (PMMA – plexiglás o metacrilato) mediante una serie repetida de pasos de adición de radicales :
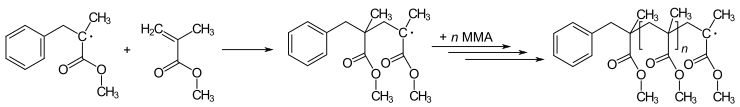
Los métodos más nuevos de polimerización radical se conocen como polimerización radical viva . Las variantes incluyen transferencia de cadena por adición-fragmentación reversible ( RAFT ) y polimerización por radicales por transferencia de átomos ( ATRP ).
Al ser un radical predominante, el O 2 reacciona con muchos compuestos orgánicos para generar radicales junto con el radical hidroperóxido . Los aceites secantes y las pinturas alquídicas se endurecen debido a la reticulación radical iniciada por el oxígeno de la atmósfera.
El radical más común en la atmósfera inferior es el dioxígeno molecular. La fotodisociación de las moléculas fuente produce otros radicales. En la atmósfera inferior, se producen radicales importantes mediante la fotodisociación del dióxido de nitrógeno en un átomo de oxígeno y el óxido nítrico (ver ecuación 1.1 a continuación), que desempeña un papel clave en la formación de smog , y la fotodisociación del ozono para dar el átomo de oxígeno excitado. O(1D) (ver la ecuación 1.2 a continuación). También se muestran las reacciones neta y de retorno ( ecuación 1.3 y ecuación 1.4 , respectivamente).
En la atmósfera superior, la fotodisociación de clorofluorocarbonos (CFC) normalmente no reactivos por la radiación ultravioleta solar es una fuente importante de radicales (ver ecuación 1 a continuación). Estas reacciones dan el radical cloro , Cl • , que cataliza la conversión de ozono en O 2 , facilitando así el agotamiento del ozono ( ecuación 2.2 – ecuación 2.4 a continuación).
Tales reacciones provocan el agotamiento de la capa de ozono , especialmente porque el radical cloro queda libre para participar en otra cadena de reacción; en consecuencia, se ha restringido el uso de clorofluorocarbonos como refrigerantes .

Los radicales juegan papeles importantes en biología. Muchos de ellos son necesarios para la vida, como la destrucción intracelular de bacterias por parte de células fagocíticas como los granulocitos y los macrófagos . Los radicales participan en los procesos de señalización celular , [15] conocidos como señalización redox . Por ejemplo, el ataque radical del ácido linoleico produce una serie de ácidos 13-hidroxioctadecadienoicos y ácidos 9-hidroxioctadecadienoicos , que pueden actuar para regular las respuestas inflamatorias y/o curativas de los tejidos localizados, la percepción del dolor y la proliferación de células malignas. Los ataques radicales al ácido araquidónico y al ácido docosahexaenoico producen una gama similar pero más amplia de productos de señalización. [dieciséis]
Los radicales también pueden estar implicados en la enfermedad de Parkinson , la sordera senil e inducida por fármacos , la esquizofrenia y el Alzheimer . [17] El síndrome clásico de los radicales libres, la hemocromatosis , enfermedad por almacenamiento de hierro , se asocia típicamente con una constelación de síntomas relacionados con los radicales libres que incluyen trastornos del movimiento, psicosis, anomalías pigmentarias de la melanina de la piel , sordera, artritis y diabetes mellitus. La teoría del envejecimiento de los radicales libres propone que los radicales son la base del propio proceso de envejecimiento . De manera similar, el proceso de mitohormesis sugiere que la exposición repetida a los radicales puede prolongar la vida.
Debido a que los radicales son necesarios para la vida, el cuerpo tiene una serie de mecanismos para minimizar el daño inducido por los radicales y reparar el daño que se produce, como las enzimas superóxido dismutasa , catalasa , glutatión peroxidasa y glutatión reductasa . Además, los antioxidantes juegan un papel clave en estos mecanismos de defensa. Suelen ser las tres vitaminas, vitamina A , vitamina C y vitamina E , y polifenoles antioxidantes . Además, existe buena evidencia que indica que la bilirrubina y el ácido úrico pueden actuar como antioxidantes para ayudar a neutralizar ciertos radicales. La bilirrubina proviene de la descomposición del contenido de los glóbulos rojos , mientras que el ácido úrico es un producto de descomposición de las purinas . Sin embargo, demasiada bilirrubina puede provocar ictericia , que eventualmente podría dañar el sistema nervioso central, mientras que demasiado ácido úrico causa gota . [18]
Las especies reactivas de oxígeno o ROS son especies como el superóxido , el peróxido de hidrógeno y el radical hidroxilo , comúnmente asociados con el daño celular. Las ROS se forman como un subproducto natural del metabolismo normal del oxígeno y desempeñan funciones importantes en la señalización celular. Dos importantes radicales centrados en oxígeno son el superóxido y el radical hidroxilo . Derivan del oxígeno molecular en condiciones reductoras. Sin embargo, debido a su reactividad, estos mismos radicales pueden participar en reacciones secundarias no deseadas que resultan en daño celular. Cantidades excesivas de estos radicales pueden provocar daño y muerte celular , lo que puede contribuir a muchas enfermedades como cáncer , derrame cerebral , infarto de miocardio , diabetes y trastornos importantes. [19] Se cree que muchas formas de cáncer son el resultado de reacciones entre los radicales y el ADN , lo que potencialmente resulta en mutaciones que pueden afectar negativamente el ciclo celular y potencialmente conducir a enfermedades malignas. [20] Algunos de los síntomas del envejecimiento , como la aterosclerosis , también se atribuyen a la oxidación del colesterol inducida por radicales a 7-cetocolesterol. [21] Además, los radicales contribuyen al daño hepático inducido por el alcohol , quizás más que el alcohol mismo. Los radicales producidos por el humo del cigarrillo están implicados en la inactivación de la alfa 1-antitripsina en el pulmón . Este proceso promueve el desarrollo de enfisema .
Se ha descubierto que la oxibenzona forma radicales con la luz solar y, por lo tanto, también puede estar asociada con daño celular. Esto solo ocurrió cuando se combinó con otros ingredientes que se encuentran comúnmente en los protectores solares, como el óxido de titanio y el metoxicinamato de octilo . [22]
Las ROS atacan el ácido graso poliinsaturado , el ácido linoleico , para formar una serie de productos de ácido 13-hidroxioctadecadienoico y ácido 9-hidroxioctadecadienoico que sirven como moléculas de señalización que pueden desencadenar respuestas que contrarresten la lesión tisular que causó su formación. Las ROS atacan a otros ácidos grasos poliinsaturados, por ejemplo, el ácido araquidónico y el ácido docosahexaenoico , para producir una serie similar de productos de señalización. [23]
Las especies reactivas de oxígeno también se utilizan en reacciones controladas que involucran dioxígeno singlete conocidas como reacciones de fotooxigenación tipo II después de la transferencia de energía de Dexter ( aniquilación triplete-triplete ) del dioxígeno triplete natural y el estado excitado triplete de un fotosensibilizador. Las transformaciones químicas típicas con esta especie de dioxígeno singlete implican, entre otras cosas, la conversión de residuos biológicos celulósicos en nuevos colorantes de polimetina . [24]

Hasta finales del siglo XX, la palabra "radical" se usaba en química para indicar cualquier grupo conectado de átomos, como un grupo metilo o un carboxilo , ya fuera parte de una molécula más grande o una molécula por sí sola. Un radical a menudo se conoce como grupo R. Entonces se necesitaba el calificativo "libre" para especificar el caso no consolidado. Tras recientes revisiones de nomenclatura, una parte de una molécula más grande ahora se denomina grupo funcional o sustituyente , y "radical" ahora implica "libre". Sin embargo, es posible que la nomenclatura antigua todavía aparezca en algunos libros.
El término radical ya estaba en uso cuando se desarrolló la ahora obsoleta teoría radical . Louis-Bernard Guyton de Morveau introdujo la frase "radical" en 1785 y la frase fue empleada por Antoine Lavoisier en 1789 en su Traité Élémentaire de Chimie . Luego se identificó un radical como la base raíz de ciertos ácidos (la palabra latina "radix" significa "raíz"). Históricamente, el término radical en la teoría radical también se usó para las partes unidas de la molécula, especialmente cuando permanecen sin cambios en las reacciones. Estos ahora se llaman grupos funcionales . Por ejemplo, se describió que el alcohol metílico estaba formado por un "radical" metilo y un "radical" hidroxilo. Tampoco lo son los radicales en el sentido químico moderno, ya que están permanentemente unidos entre sí y no tienen electrones reactivos desapareados; sin embargo, se pueden observar como radicales en espectrometría de masas cuando se rompen mediante irradiación con electrones energéticos.
En un contexto moderno, el primer radical orgánico (que contiene carbono) identificado fue el radical trifenilmetilo , (C 6 H 5 ) 3 C • . Esta especie fue descubierta por Moses Gomberg en 1900. En 1933, Morris S. Kharasch y Frank Mayo propusieron que los radicales libres eran responsables de la adición anti-Markovnikov de bromuro de hidrógeno al bromuro de alilo . [25] [26]
En la mayoría de los campos de la química, la definición histórica de radicales sostiene que las moléculas tienen un espín electrónico distinto de cero. Sin embargo, en campos como la espectroscopia y la astroquímica , la definición es ligeramente diferente. Gerhard Herzberg , que ganó el premio Nobel por su investigación sobre la estructura electrónica y la geometría de los radicales, sugirió una definición más flexible de radicales libres: "cualquier especie (átomo, molécula o ion) transitoria (químicamente inestable)". [27] El punto principal de su sugerencia es que hay muchas moléculas químicamente inestables que tienen espín cero, como C 2 , C 3 , CH 2 y así sucesivamente. Esta definición es más conveniente para discusiones sobre procesos químicos transitorios y astroquímica; por lo tanto, los investigadores en estos campos prefieren utilizar esta definición vaga. [28]
En las ecuaciones químicas, los radicales frecuentemente se indican con un punto colocado inmediatamente a la derecha del símbolo atómico o fórmula molecular de la siguiente manera:
Los mecanismos de reacción radicales utilizan flechas de una sola punta para representar el movimiento de electrones individuales:

La escisión homolítica del enlace roto se dibuja con una flecha en forma de "anzuelo" para distinguirla del movimiento habitual de dos electrones representado por una flecha rizada estándar. El segundo electrón del enlace que se rompe también se mueve para emparejarse con el electrón radical atacante.
Los radicales también participan en la adición y sustitución de radicales como intermediarios reactivos . Las reacciones en cadena que involucran radicales generalmente se pueden dividir en tres procesos distintos. Estos son iniciación , propagación y terminación .