En la ciencia de los materiales, el polimorfismo describe el fenómeno en el que un compuesto o elemento puede cristalizar en más de una estructura cristalina . La definición anterior ha evolucionado a lo largo de muchos años y todavía está en discusión hoy. [1] [2] [3] La discusión sobre las características definitorias del polimorfismo implica distinguir entre los tipos de transiciones y cambios estructurales que ocurren en el polimorfismo versus aquellos en otros fenómenos.
También es útil señalar que los materiales con dos fases polimórficas pueden denominarse dimórficos , los de tres fases polimórficas, trimórficos , etc. [4]
Las transiciones de fase (cambios de fase) que ayudan a describir el polimorfismo incluyen transiciones polimórficas, así como transiciones de fusión y vaporización. Según la IUPAC , una transición polimórfica es "una transición reversible de una fase cristalina sólida a una determinada temperatura y presión (el punto de inversión) a otra fase de la misma composición química con una estructura cristalina diferente". [5] Además, Walter McCrone describió las fases de la materia polimórfica como "diferentes en estructura cristalina pero idénticas en estado líquido o vapor". McCrone también define un polimorfo como "una fase cristalina de un compuesto determinado resultante de la posibilidad de al menos dos disposiciones diferentes de las moléculas de ese compuesto en estado sólido". [6] [7] Estos hechos definitorios implican que el polimorfismo implica cambios en las propiedades físicas pero no puede incluir cambios químicos. Algunas definiciones tempranas no hacen esta distinción.
La eliminación del cambio químico de aquellos cambios permisibles durante una transición polimórfica delinea el polimorfismo. Por ejemplo, la isomerización a menudo puede conducir a transiciones polimórficas. Sin embargo, la tautomerización (isomerización dinámica) conduce a un cambio químico, no al polimorfismo. [1] Además, la alotropía de elementos y el polimorfismo han estado vinculados históricamente. Sin embargo, los alótropos de un elemento no siempre son polimorfos. Un ejemplo común son los alótropos del carbono , que incluyen el grafito, el diamante y la londsdaleita. Si bien las tres formas son alótropos, el grafito no es un polimorfo del diamante y la londsdaleita. La razón es que el grafito es químicamente distinto y tiene enlaces hibridados sp 2 , mientras que el diamante y la londsdaleita son químicamente idénticos y ambos tienen enlaces hibridados sp 3 . El diamante y la londsdaleita difieren en sus estructuras cristalinas pero no difieren químicamente. [2] La isomerización y la alotropía son sólo dos de los fenómenos relacionados con el polimorfismo. Para obtener información adicional sobre cómo identificar el polimorfismo y distinguirlo de otros fenómenos, consulte la revisión de Brog et. Alabama. [2]
El polimorfismo es de importancia práctica para productos farmacéuticos , agroquímicos , pigmentos , colorantes , alimentos y explosivos .
Los primeros registros del descubrimiento del polimorfismo dan crédito a Eilhard Mitscerlich y Jöns Jacob Berzelius por sus estudios de fosfatos y arseniatos a principios del siglo XIX. Los estudios implicaron medir los ángulos interfaciales de los cristales para mostrar que sales químicamente idénticas podrían tener dos formas diferentes. Mitscerlich originalmente llamó a este descubrimiento isomorfismo. [8] Wilhelm Ostwald también utilizó la medición de la densidad del cristal y la expresó en la relación de Ostwald. [9]
El desarrollo del microscopio mejoró las observaciones del polimorfismo y ayudó a los estudios de Moritz Ludwig Frankenheim en la década de 1830. Pudo demostrar métodos para inducir cambios de fase cristalina y resumió formalmente sus hallazgos sobre la naturaleza del polimorfismo. Poco después, se empezó a utilizar el microscopio de luz polarizada, más sofisticado , que proporcionó una mejor visualización de las fases cristalinas, permitiendo a los cristalógrafos distinguir entre diferentes polimorfos. La platina caliente fue inventada y montada en un microscopio de luz polarizada por Otto Lehmann alrededor de 1877. Esta invención ayudó a los cristalógrafos a determinar los puntos de fusión y observar transiciones polimórficas. [8]
Si bien el uso de microscopios de etapa caliente continuó durante todo el siglo XX, los métodos térmicos también se utilizaron comúnmente para observar el flujo de calor que ocurre durante los cambios de fase, como la fusión y las transiciones polimórficas. Una de esas técnicas, la calorimetría diferencial de barrido (DSC), sigue utilizándose para determinar la entalpía de transiciones polimórficas. [8]
En el siglo XX, la cristalografía de rayos X se utilizó comúnmente para estudiar la estructura cristalina de los polimorfos. Para obtener mediciones de la celda unitaria del cristal se utilizan técnicas de difracción de rayos X de monocristal y de difracción de rayos X en polvo. Cada polimorfo de un compuesto tiene una estructura cristalina única. Como resultado, diferentes polimorfos producirán diferentes patrones de difracción de rayos X. [8]
Los métodos espectroscópicos vibratorios comenzaron a utilizarse para investigar el polimorfismo en la segunda mitad del siglo XX y se han vuelto más utilizados a medida que mejoraron las tecnologías ópticas, informáticas y de semiconductores. Estas técnicas incluyen espectroscopia infrarroja (IR) , espectroscopia de terahercios y espectroscopia Raman . Las espectroscopias IR y Raman de frecuencia media son sensibles a los cambios en los patrones de enlaces de hidrógeno . Posteriormente, estos cambios pueden estar relacionados con diferencias estructurales. Además, las espectroscopías Raman de terahercios y de baja frecuencia revelan modos de vibración resultantes de interacciones intermoleculares en sólidos cristalinos. Nuevamente, estos modos vibratorios están relacionados con la estructura cristalina y pueden usarse para descubrir diferencias en la estructura tridimensional entre polimorfos. [10]
La química computacional se puede utilizar en combinación con técnicas de espectroscopia vibratoria para comprender los orígenes de las vibraciones dentro de los cristales. [10] La combinación de técnicas proporciona información detallada sobre las estructuras cristalinas, similar a lo que se puede lograr con la cristalografía de rayos X. Además de utilizar métodos computacionales para mejorar la comprensión de los datos espectroscópicos, el último avance en la identificación de polimorfismo en cristales es el campo de la predicción de la estructura cristalina . Esta técnica utiliza la química computacional para modelar la formación de cristales y predecir la existencia de polimorfos específicos de un compuesto antes de que hayan sido observados experimentalmente por los científicos. [11] [12]
Muchos compuestos exhiben polimorfismo. Se ha afirmado que "cada compuesto tiene diferentes formas polimórficas y que, en general, el número de formas conocidas de un compuesto determinado es proporcional al tiempo y al dinero invertido en la investigación de ese compuesto". [13] [6] [14]
El fenómeno fue descubierto en 1832 por Friedrich Wöhler y Justus von Liebig . Observaron que las sedosas agujas de benzamida recién cristalizada se convertían lentamente en cristales rómbicos. [15] El análisis actual [16] identifica tres polimorfos de benzamida: el menos estable, formado por enfriamiento instantáneo, es la forma ortorrómbica II. A este tipo le sigue la forma monoclínica III (observada por Wöhler/Liebig). La forma más estable es la forma monoclínica I. Los mecanismos de enlace de hidrógeno son los mismos para las tres fases; sin embargo, difieren mucho en sus interacciones pi-pi.
En 2006 se descubrió un nuevo polimorfo del ácido maleico , 124 años después de que se estudiara la primera forma cristalina. [17] El ácido maleico se fabrica a escala industrial en la industria química. Forma sal que se encuentra en la medicina. El nuevo tipo de cristal se produce cuando un cocristal de cafeína y ácido maleico (2:1) se disuelve en cloroformo y cuando se deja que el disolvente se evapore lentamente. Mientras que la forma I tiene un grupo espacial monoclínico P 2 1 / c , la nueva forma tiene un grupo espacial Pc . Ambos polimorfos constan de láminas de moléculas conectadas mediante enlaces de hidrógeno de los grupos de ácido carboxílico : en la forma I, las láminas se alternan con respecto al momento dipolar neto , mientras que en la forma II, las láminas están orientadas en la misma dirección.
Después de 125 años de estudio, el 1,3,5-trinitrobenceno produjo un segundo polimorfo. La forma habitual tiene el grupo espacial Pbca , pero en 2004 se obtuvo un segundo polimorfo en el grupo espacial Pca 2 1 cuando el compuesto se cristalizó en presencia de un aditivo, trisindano. Este experimento muestra que los aditivos pueden inducir la aparición de formas polimórficas. [18]
La acridina se ha obtenido en ocho polimorfos [19] y el aripiprazol tiene nueve. [20] El récord del mayor número de polimorfos bien caracterizados lo ostenta un compuesto conocido como ROY . [21] [22] La glicina cristaliza como cristales monoclínicos y hexagonales . El polimorfismo en compuestos orgánicos es a menudo el resultado de un polimorfismo conformacional . [23]
El polimorfismo en óxidos metálicos binarios ha atraído mucha atención porque estos materiales tienen un valor económico significativo. Un conjunto de ejemplos famosos tiene la composición SiO 2 , que forma muchos polimorfos. Los más importantes incluyen: cuarzo α , cuarzo β , tridimita , cristobalita , moganita , coesita y stishovita . [24] [25]
Ejemplos clásicos de polimorfismo son el par de minerales calcita y aragonito , ambas formas de carbonato de calcio .
El β-HgS precipita como un sólido negro cuando las sales de Hg(II) se tratan con H2S . Con un suave calentamiento de la suspensión, el polimorfo negro se convierte en rojo. [27]
Según la regla de Ostwald , los polimorfos normalmente menos estables cristalizan antes que la forma estable. El concepto depende de la idea de que los polimorfos inestables se parecen más al estado en solución y, por lo tanto, tienen ventajas cinéticas. El caso fundacional de la benzamida fibrosa frente a la rómbica ilustra el caso. Otro ejemplo lo proporcionan dos polimorfos del dióxido de titanio . [26] Sin embargo, existen sistemas conocidos, como el metacetamol , donde sólo una velocidad de enfriamiento estrecha favorece la obtención de la forma II metaestable. [28]
Los polimorfos tienen estabilidades dispares. Algunos se convierten rápidamente a temperatura ambiente (o cualquier temperatura). La mayoría de los polimorfos de moléculas orgánicas sólo difieren en unos pocos kJ/mol en energía reticular. Aproximadamente el 50% de los pares de polimorfos conocidos difieren en menos de 2 kJ/mol y las diferencias de estabilidad de más de 10 kJ/mol son raras. [29] Es valioso mencionar que la estabilidad del polimorfo puede cambiar con la temperatura [30] [31] [32] o la presión. [33] [34] Es importante señalar que la estabilidad estructural y termodinámica son diferentes. La estabilidad termodinámica se puede estudiar mediante métodos experimentales o computacionales. [35] [36]
El polimorfismo se ve afectado por los detalles de la cristalización . El disolvente afecta en todos los aspectos a la naturaleza del polimorfo, incluida la concentración, otros componentes del disolvente, es decir, especies que inhiben o promueven ciertos patrones de crecimiento. [37] Un factor decisivo suele ser la temperatura del disolvente a partir del cual se lleva a cabo la cristalización . [38]
Los polimorfos metaestables no siempre se obtienen de forma reproducible, lo que lleva a casos de " polimorfos en desaparición ", con implicaciones generalmente negativas para la ley y los negocios. [13] [11] [39]
Los medicamentos reciben aprobación regulatoria y se les conceden patentes para un solo polimorfo.
En una disputa de patentes clásica , GlaxoSmithKline defendió su patente para el polimorfo de tipo II del ingrediente activo de Zantac frente a sus competidores, mientras que la del polimorfo de tipo I ya había expirado. [40]
El polimorfismo en los fármacos también puede tener implicaciones médicas directas, ya que las tasas de disolución dependen del polimorfismo. La pureza polimórfica de las muestras de fármacos se puede comprobar mediante técnicas como la difracción de rayos X en polvo, la espectroscopia IR/Raman y, en algunos casos, utilizando las diferencias en sus propiedades ópticas. [41]
Los casos conocidos hasta 2015 se analizan en un artículo de revisión de Bučar, Lancaster y Bernstein. [11]
Dibenzoxazepinas
Se aplicaron estudios multidisciplinarios que implicaron enfoques experimentales y computacionales a moléculas farmacéuticas para facilitar la comparación de sus estructuras de estado sólido. Específicamente, este estudio se ha centrado en explorar cómo los cambios en la estructura molecular afectan la conformación molecular, los motivos de empaquetamiento, las interacciones en las redes cristalinas resultantes y el grado de diversidad en estado sólido de estos compuestos. Los resultados resaltan el valor de los estudios de predicción de la estructura cristalina y los cálculos PIXEL en la interpretación del comportamiento observado del estado sólido y la cuantificación de las interacciones intermoleculares en las estructuras empaquetadas y la identificación de las interacciones estabilizadoras clave. Una evaluación experimental arrojó 4 formas físicas de clozapina en comparación con 60 formas físicas distintas de olanzapina . Los resultados de la detección experimental de clozapina son consistentes con su panorama de energía cristalina, lo que confirma que ninguna disposición de empaque alternativa es termodinámicamente competitiva con la estructura obtenida experimentalmente. Mientras que en el caso de la olanzapina , el panorama de la energía cristalina pone de relieve que la extensa selección experimental probablemente no haya encontrado todos los polimorfos posibles de la olanzapina , y se podría abordar una mayor diversidad de formas sólidas con una mejor comprensión del papel de la cinética en su cristalización. Los estudios de CSP pudieron ofrecer una explicación para la ausencia del dímero centrosimétrico en la clozapina anhidra . Los cálculos de PIXEL en todas las estructuras cristalinas de clozapina revelaron que, al igual que la olanzapina , la energía de interacción intermolecular en cada estructura también está dominada por Ed. A pesar de la similitud de la estructura molecular entre amoxapina y loxapina (moléculas del grupo 2), el empaquetamiento cristalino observado en los polimorfos de loxa difiere significativamente de la amoxapina . Un estudio experimental y computacional combinado demostró que el grupo metilo en la loxapina tiene una influencia significativa en el aumento de la gama de formas sólidas accesibles y favorece varias disposiciones de empaquetamiento alternativas. Los estudios de CSP han ayudado nuevamente a explicar la diversidad observada en estado sólido de loxapina y amoxapina. Los cálculos de PIXEL mostraron que en ausencia de enlaces H fuertes, los enlaces H débiles como C – H... O, C – H... N y las interacciones de dispersión desempeñan un papel clave en la estabilización de la red cristalina de ambas moléculas. El empaquetamiento eficiente de cristales de amoxapina parece contribuir a su comportamiento monomórfico en comparación con el empaquetamiento comparativamente menos eficiente de loxapina .moléculas en ambos polimorfos. La combinación de enfoques experimentales y computacionales ha proporcionado una comprensión más profunda de los factores que influyen en la estructura del estado sólido y la diversidad de estos compuestos. Las superficies de Hirshfeld que utilizan Crystal Explorer representan otra forma de explorar modos de empaquetamiento e interacciones intermoleculares en cristales moleculares. La influencia de los cambios en los sustituyentes pequeños sobre la forma y la distribución de los electrones también se puede investigar mapeando la densidad electrónica total sobre el potencial electrostático de las moléculas en la fase gaseosa. Esto permite una visualización y comparación sencillas de la forma general y de las regiones ricas y deficientes en electrones dentro de las moléculas. La forma de estas moléculas se puede investigar más a fondo para estudiar su influencia en la diversidad diversa del estado sólido. [42]
posaconazol
Las formulaciones originales de posaconazol comercializadas con licencia como Noxafil (R) se formularon utilizando la forma I de posaconazol . El descubrimiento de polimorfos de posaconazol aumentó rápidamente y dio lugar a muchas investigaciones en cristalografía de posaconazol . Se agregaron un solvato de metanol y un cocristal de 1,4-dioxano a la base de datos estructural de Cambridge (CSD). [43]
El fármaco antiviral ritonavir existe en dos polimorfos, que difieren mucho en eficacia. Estos problemas se resolvieron reformulando el medicamento en cápsulas de gel y tabletas, en lugar de las cápsulas originales. [44]
Sólo había un polimorfo Forma I probado de aspirina , aunque la existencia de otro polimorfo se debatió desde la década de 1960, y un informe de 1981 informó que cuando cristaliza en presencia de anhídrido de aspirina , el difractograma de la aspirina tiene picos adicionales débiles. Aunque en ese momento se descartó como una mera impureza, en retrospectiva era una aspirina de forma II . [11]
La forma II se informó en 2005, [45] [46] encontrada después de un intento de cocristalización de aspirina y levetiracetam en acetonitrilo caliente .
En la forma I, pares de moléculas de aspirina forman dímeros centrosimétricos a través de los grupos acetilo con los enlaces de hidrógeno (ácidos) del protón metilo al carbonilo . En la forma II, cada molécula de aspirina forma los mismos enlaces de hidrógeno, pero con dos moléculas vecinas en lugar de una. En cuanto a los enlaces de hidrógeno formados por los grupos ácido carboxílico , ambos polimorfos forman estructuras diméricas idénticas. Los polimorfos de la aspirina contienen secciones bidimensionales idénticas y, por lo tanto, se describen con mayor precisión como politipos. [47]
La aspirina de Forma II pura podría prepararse sembrando el lote con anhidrato de aspirina en un 15% en peso. [11]
El polvo de paracetamol tiene malas propiedades de compresión, lo que dificulta la fabricación de comprimidos. Se encontró un segundo polimorfo con propiedades de compresión más adecuadas. [48]
El acetato de cortisona existe en al menos cinco polimorfos diferentes, cuatro de los cuales son inestables en agua y cambian a una forma estable.
La carbamazepina , los estrógenos , la paroxetina , [49] y el cloranfenicol también muestran polimorfismo.
La pirazinamida tiene al menos 4 polimorfos. [50] Todos ellos se transforman a una forma α estable a temperatura ambiente tras el almacenamiento o tratamiento mecánico. [51] Estudios recientes demuestran que la forma α es termodinámicamente estable a temperatura ambiente. [30] [32]
Los politipos son un caso especial de polimorfos, donde múltiples estructuras cristalinas compactas difieren solo en una dimensión. Los politipos tienen planos compactos idénticos, pero difieren en la secuencia de apilamiento en la tercera dimensión perpendicular a estos planos. El carburo de silicio (SiC) tiene más de 170 politipos conocidos , aunque la mayoría son raros. Todos los politipos de SiC tienen prácticamente la misma densidad y energía libre de Gibbs . Los politipos de SiC más comunes se muestran en la Tabla 1.
Tabla 1 : Algunos politipos de SiC. [52]
Un segundo grupo de materiales con diferentes politipos son los dicalcogenuros de metales de transición , materiales estratificados como el disulfuro de molibdeno (MoS 2 ). Para estos materiales, los politipos tienen efectos más distintos sobre las propiedades del material, por ejemplo, para MoS 2 , el politipo 1T es de carácter metálico, mientras que la forma 2H es más semiconductora. [53] Otro ejemplo es el disulfuro de tantalio , donde se encuentran los politipos comunes 1T y 2H, pero también tipos más complejos de "coordinación mixta" como 4Hb y 6R, donde se mezclan las capas de geometría prismática trigonal y octaédrica. [54] Aquí, el politipo 1T exhibe una onda de densidad de carga , con una clara influencia en la conductividad en función de la temperatura, mientras que el politipo 2H exhibe superconductividad .
ZnS y CdI 2 también son politípicos. [55] Se ha sugerido que este tipo de polimorfismo se debe a la cinética en la que las dislocaciones de los tornillos reproducen rápidamente secuencias parcialmente desordenadas de forma periódica.
_and_monotropic_behaviour_(right)..jpg/440px-Energy-Temperature_diagrams_of_a_system_exhibiting_two_polymorphic_forms_with_enantiotropic_behaviour_(left)_and_monotropic_behaviour_(right)..jpg)
En términos de termodinámica , se reconocen dos tipos de comportamiento polimórfico. Para un sistema monotrópico, las gráficas de las energías libres de los distintos polimorfos frente a la temperatura no se cruzan antes de que todos los polimorfos se fundan. Como resultado, cualquier transición de un polimorfo a otro por debajo del punto de fusión será irreversible. Para un sistema enantiotrópico, una gráfica de la energía libre frente a la temperatura muestra un punto de cruce antes de los distintos puntos de fusión. [56] También puede ser posible convertir indistintamente entre los dos polimorfos mediante calentamiento o enfriamiento, o mediante contacto físico con un polimorfo de menor energía.
Un modelo simple de polimorfismo es modelar la energía libre de Gibbs de un cristal en forma de bola como . Aquí, el primer término es la energía superficial y el segundo término es la energía volumétrica. Ambos parámetros . La función sube a un máximo antes de caer, cruzando cero en . Para cristalizar, una bola de cristal supera con creces la barrera energética de la parte del paisaje energético. [57]
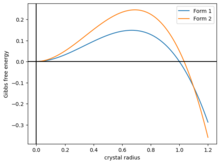
Ahora, supongamos que hay dos tipos de cristales, con diferentes energías y , y si tienen la misma forma que en la Figura 2, entonces las dos curvas se cruzan en algún punto . Entonces el sistema tiene tres fases:
Si el cristal crece lentamente, podría quedar atrapado cinéticamente en la forma 1.