La neurulación se refiere al proceso de plegamiento en los embriones de vertebrados , que incluye la transformación de la placa neural en el tubo neural . [1] El embrión en esta etapa se denomina neurula .
El proceso comienza cuando la notocorda induce la formación del sistema nervioso central (SNC) al enviar señales a la capa germinal del ectodermo que se encuentra por encima de ella para formar la placa neural gruesa y plana . La placa neural se pliega sobre sí misma para formar el tubo neural , que luego se diferenciará en la médula espinal y el cerebro , y finalmente formará el sistema nervioso central. [2] Las simulaciones por computadora descubrieron que el acuñamiento celular y la proliferación diferencial son suficientes para la neurulación de los mamíferos. [3]
Diferentes porciones del tubo neural se forman mediante dos procesos diferentes, llamados neurulación primaria y secundaria, en diferentes especies. [4]
El concepto de inducción se originó en el trabajo de Pandor en 1817. [5] Los primeros experimentos que probaron la inducción fueron atribuidos por Viktor Hamburger [6] a descubrimientos independientes de Hans Spemann de Alemania en 1901 [7] y Warren Lewis de los EE. UU. en 1904. [8] Fue Hans Spemann quien popularizó por primera vez el término "inducción neural primaria" en referencia a la primera diferenciación del ectodermo en tejido neural durante la neurulación. [9] [10] Se llamó "primario" porque se pensó que era el primer evento de inducción en la embriogénesis. El experimento ganador del premio Nobel fue realizado por su estudiante Hilda Mangold . [9] El ectodermo de la región del labio dorsal del blastoporo de un embrión de salamandra en desarrollo se trasplantó a otro embrión y este tejido "organizador" "indujo" la formación de un eje secundario completo cambiando el tejido circundante en el embrión original de tejido ectodérmico a neural. Por lo tanto, se denominó al tejido del embrión donante como inductor, ya que indujo el cambio. [9] Si bien el organizador es el labio dorsal del blastoporo, no se trata de un conjunto de células, sino de un grupo de células en constante cambio que migran sobre el labio dorsal del blastoporo formando células en botella constreñidas apicalmente. En cualquier momento dado durante la gastrulación habrá diferentes células que conformarán el organizador. [11]
Los trabajos posteriores sobre inductores realizados por científicos durante el siglo XX demostraron que no solo el labio dorsal del blastoporo podía actuar como inductor, sino también una gran cantidad de otros elementos aparentemente no relacionados. Esto comenzó cuando Johannes Holtfreter descubrió que el ectodermo hervido aún podía inducir . [12] Elementos tan diversos como el pH bajo, el AMP cíclico e incluso el polvo del piso podían actuar como inductores, lo que provocó una consternación considerable. [13] Incluso el tejido que no podía inducir cuando estaba vivo podía inducir cuando se hervía. [14] Otros elementos como la manteca de cerdo, la cera, las cáscaras de plátano y la sangre de rana coagulada no inducían. [15] Los biólogos moleculares del desarrollo emprendieron la búsqueda de una molécula inductora de base química y continuó creciendo una vasta literatura de elementos que demostraban tener capacidades inductoras. [16] [17] Más recientemente, la molécula inductora se ha atribuido a los genes y en 1995, hubo un llamado para que todos los genes involucrados en la inducción neuronal primaria y todas sus interacciones se catalogaran en un esfuerzo por determinar "la naturaleza molecular del organizador de Spemann". [18] También se han invocado otras proteínas y factores de crecimiento como inductores, incluidos factores de crecimiento solubles como la proteína morfogenética ósea y un requisito de "señales inhibidoras" como noggin y folistatina .
Incluso antes de que se popularizara el término inducción, varios autores, comenzando por Hans Driesch en 1894, [19] sugirieron que la inducción neuronal primaria podría ser de naturaleza mecánica. En 1985, GW Brodland y R. Gordon propusieron un modelo basado en la mecanoquímica para la inducción neuronal primaria . [20] Se ha demostrado que una onda física real de contracción se origina en la ubicación precisa del organizador de Spemann que luego atraviesa el presunto epitelio neuronal [21] y en 2006 se propuso un modelo de trabajo completo de cómo se producen las inducciones neuronales primarias. [22] [23] Durante mucho tiempo ha habido una renuencia general en el campo a considerar la posibilidad de que la inducción neuronal primaria pueda iniciarse por efectos mecánicos. [24] Aún queda por encontrar una explicación completa para la inducción neuronal primaria.
A medida que avanza la neurulación después de la inducción, las células de la placa neural se vuelven columnares altas y pueden identificarse a través de la microscopía como diferentes del ectodermo epitelial presunto circundante ( endodermo epiblástico en amniotas). Las células se mueven lateralmente y se alejan del eje central y cambian a una forma de pirámide truncada. Esta forma de pirámide se logra a través de la tubulina y la actina en la porción apical de la célula que se contrae a medida que se mueven. La variación en las formas de las células está parcialmente determinada por la ubicación del núcleo dentro de la célula, lo que provoca abultamiento en áreas de las células que obligan a cambiar la altura y la forma de la célula. Este proceso se conoce como constricción apical . [25] [26] El resultado es un aplanamiento de la placa neural diferenciadora que es particularmente obvio en las salamandras cuando la gástrula previamente redonda se convierte en una bola redondeada con una parte superior plana. [27] Ver placa neural .
El proceso por el cual la placa neural plana se pliega para formar el tubo neural cilíndrico se denomina neurulación primaria . Como resultado de los cambios en la forma celular, la placa neural forma el punto de articulación medial (PMM). La epidermis en expansión ejerce presión sobre el PAM y hace que la placa neural se pliegue, lo que da lugar a pliegues neurales y a la creación del surco neural . Los pliegues neurales forman puntos de articulación dorsolaterales (PDL) y la presión sobre esta articulación hace que los pliegues neurales se junten y se fusionen en la línea media. La fusión requiere la regulación de las moléculas de adhesión celular. La placa neural cambia de la expresión de E-cadherina a la expresión de N-cadherina y N-CAM para reconocerse entre sí como el mismo tejido y cerrar el tubo. Este cambio en la expresión detiene la unión del tubo neural a la epidermis.
La notocorda desempeña un papel fundamental en el desarrollo del tubo neural. Antes de la neurulación, durante la migración de las células del endodermo epiblástico hacia el endodermo hipoblástico, el proceso notocordal se abre en un arco denominado placa notocordal y se adhiere al neuroepitelio suprayacente de la placa neural. La placa notocordal actúa entonces como un ancla para la placa neural y empuja los dos bordes de la placa hacia arriba mientras mantiene anclada la sección media. Algunas de las células notocordales se incorporan a la placa neural de la sección central para formar posteriormente la placa del suelo del tubo neural. La placa notocordal se separa y forma la notocorda sólida. [4]
El plegado del tubo neural para formar un tubo real no ocurre de una sola vez. En cambio, comienza aproximadamente a nivel del cuarto somita en la etapa de Carnegie 9 (alrededor del día embrionario 20 en humanos ). Los bordes laterales de la placa neural se tocan en la línea media y se unen. Esto continúa tanto cranealmente (hacia la cabeza) como caudalmente (hacia la cola). Las aberturas que se forman en las regiones craneal y caudal se denominan neuroporos craneales y caudales . En los embriones humanos , el neuroporo craneal se cierra aproximadamente el día 24 y el neuroporo caudal el día 28. [28] La falla del cierre del neuroporo craneal (superior) y caudal (inferior) da como resultado afecciones llamadas anencefalia y espina bífida , respectivamente. Además, la falla del cierre del tubo neural a lo largo del cuerpo da como resultado una afección llamada raquisquisis . [29]
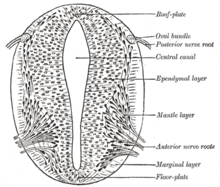
Según el modelo de la bandera francesa, en el que las etapas del desarrollo están dirigidas por gradientes de productos genéticos, varios genes se consideran importantes para inducir patrones en la placa neural abierta, especialmente para el desarrollo de placodas neurogénicas . Estas placodas se hacen evidentes por primera vez histológicamente en la placa neural abierta. Después de que la señalización de Sonic Hedgehog (SHH) de la notocorda induce su formación, la placa del suelo del tubo neural incipiente también secreta SHH. Después del cierre, el tubo neural forma una placa basal o del suelo y una placa del techo o alar en respuesta a los efectos combinados de SHH y factores que incluyen BMP4 secretados por la placa del techo. La placa basal forma la mayor parte de la porción ventral del sistema nervioso, incluida la porción motora de la médula espinal y el tronco encefálico; la placa alar forma las porciones dorsales, dedicadas principalmente al procesamiento sensorial. [30]
La epidermis dorsal expresa BMP4 y BMP7 . La placa del techo del tubo neural responde a esas señales expresando más BMP4 y otras señales del factor de crecimiento transformante beta (TGF-β) para formar un gradiente dorsal/ventral en el tubo neural. La notocorda expresa SHH. La placa del suelo responde a SHH produciendo su propia SHH y formando un gradiente. Estos gradientes permiten la expresión diferencial de factores de transcripción. [30]
El cierre del tubo neural no se entiende del todo. El cierre del tubo neural varía según la especie. En los mamíferos, el cierre se produce al encontrarse en múltiples puntos que luego se cierran hacia arriba y hacia abajo. En las aves, el cierre del tubo neural comienza en un punto del mesencéfalo y se mueve hacia delante y hacia atrás. [31] [32]
La neurulación primaria se transforma en neurulación secundaria cuando el neuroporo caudal experimenta el cierre final. La cavidad de la médula espinal se extiende hacia el cordón neural. [33] En la neurulación secundaria, el ectodermo neural y algunas células del endodermo forman el cordón medular . El cordón medular se condensa, se separa y luego forma cavidades. [34] Estas cavidades luego se fusionan para formar un solo tubo. La neurulación secundaria ocurre en la sección posterior de la mayoría de los animales, pero se expresa mejor en las aves. Los tubos de la neurulación primaria y secundaria finalmente se conectan alrededor de la sexta semana de desarrollo. [35]
En los seres humanos, los mecanismos de neurulación secundaria desempeñan un papel importante debido a su impacto en la formación adecuada de la médula espinal posterior. Los errores en cualquier punto del proceso pueden generar problemas. Por ejemplo, la retención de la médula espinal se produce debido a una detención parcial o completa de la neurulación secundaria que crea una porción no funcional en el extremo vestigial. [36]
La porción anterior del tubo neural forma las tres partes principales del cerebro: el prosencéfalo ( prosencéfalo ), el mesencéfalo ( mesencéfalo ) y el rombencéfalo ( rombencéfalo ). [37] Estas estructuras aparecen inicialmente justo después del cierre del tubo neural como protuberancias llamadas vesículas cerebrales en un patrón especificado por los genes de patrón anteroposterior, incluidos los genes Hox , otros factores de transcripción como los genes Emx, Otx y Pax, y factores de señalización secretados como los factores de crecimiento de fibroblastos (FGF) y Wnts . [38] Estas vesículas cerebrales se dividen aún más en subregiones. El prosencéfalo da lugar al telencéfalo y al diencéfalo , y el rombencéfalo genera el metencéfalo y el mielencéfalo . El rombencéfalo, que es la parte evolutivamente más antigua del cerebro cordado , también se divide en diferentes segmentos llamados rombómeros . Los rombómeros generan muchos de los circuitos neuronales más esenciales necesarios para la vida, incluidos los que controlan la respiración y la frecuencia cardíaca, y producen la mayoría de los nervios craneales . [37] Las células de la cresta neural forman ganglios por encima de cada rombómero. El tubo neural temprano está compuesto principalmente por el neuroepitelio germinal , más tarde llamado zona ventricular , que contiene células madre neuronales primarias llamadas células gliales radiales y sirve como la principal fuente de neuronas producidas durante el desarrollo del cerebro a través del proceso de neurogénesis . [39] [40]
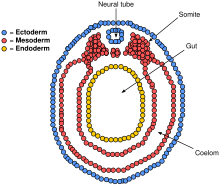
El mesodermo paraxial que rodea la notocorda por los lados se desarrollará en los somitas (futuros músculos y huesos, y contribuye a la formación de las extremidades del vertebrado ). [41]
Las masas de tejido llamadas cresta neural , que se encuentran en los bordes de las placas laterales del tubo neural plegable, se separan del tubo neural y migran para convertirse en una variedad de células diferentes pero importantes. [ cita requerida ]
Las células de la cresta neural migrarán a través del embrión y darán lugar a varias poblaciones celulares, incluidas las células pigmentarias y las células del sistema nervioso periférico. [ cita requerida ]
La falla de la neurulación, especialmente la falla del cierre del tubo neural, se encuentra entre los defectos congénitos más comunes y discapacitantes en los seres humanos, y ocurre aproximadamente en 1 de cada 500 nacidos vivos. [42] La falla del extremo rostral del tubo neural para cerrarse resulta en anencefalia , o falta de desarrollo cerebral, y es más a menudo fatal. [43] La falla del extremo caudal del tubo neural para cerrarse causa una condición conocida como espina bífida , en la cual la médula espinal no se cierra. [44]