En farmacología , los moduladores alostéricos positivos del receptor GABA A , también conocidos como GABAquinas o potenciadores del receptor GABA A , [1] son moléculas moduladoras alostéricas positivas (PAM) que aumentan la actividad de la proteína del receptor GABA A en el sistema nervioso central de los vertebrados .
El GABA es un importante neurotransmisor inhibidor del sistema nervioso central. Al unirse, hace que el receptor GABA A abra su canal de cloruro para permitir que los iones de cloruro entren en la neurona , lo que hace que la célula se hiperpolarice y tenga menos probabilidades de activarse . Los PAM de GABA A aumentan el efecto del GABA al hacer que el canal se abra con mayor frecuencia o durante períodos más prolongados. Sin embargo, no tienen efecto si no hay GABA u otro agonista presente.
A diferencia de los agonistas del receptor GABA A , los PAM del GABA A no se unen al mismo sitio activo que la molécula neurotransmisora ácido γ-aminobutírico (GABA) : afectan al receptor uniéndose a un sitio diferente de la proteína. Esto se denomina modulación alostérica .
En psicofarmacología , los PAM del receptor GABA A utilizados como fármacos tienen principalmente efectos sedantes y ansiolíticos . Entre los ejemplos de PAM del GABA A se incluyen el etanol , las benzodiazepinas como el diazepam (Valium) y el alprazolam (Xanax) , los fármacos Z como el zolpidem (Ambien) y los fármacos barbitúricos .
Los receptores GABA A han sido históricamente un objetivo de la investigación de tratamientos farmacológicos. Los primeros compuestos fueron compuestos iónicos, como el bromuro .
En 1903 se sintetizó y comercializó el primer derivado psicoactivo del ácido barbitúrico para el tratamiento de los dolores de cabeza. En el transcurso de 30 años se desarrollaron muchos otros barbitúricos que se utilizaron como sedantes , somníferos y anestésicos generales . Aunque los barbitúricos cayeron en desuso, siguen sirviendo como anestésicos de acción corta y fármacos antiepilépticos .
Las benzodiazepinas se descubrieron en 1955 y reemplazaron en gran medida a los barbitúricos debido a su mayor índice terapéutico . [2] Al principio, las benzodiazepinas se consideraban tranquilizantes menores seguros y eficaces, pero luego fueron criticadas por sus efectos adictivos . Varias benzodiazepinas eficaces ofrecen opciones en cuanto a forma de dosificación , duración de acción, interacción metabólica y seguridad.
Las benzodiazepinas funcionan uniéndose al sitio de acción de las benzodiazepinas en la mayoría de los receptores GABA A , pero no en todos . La modulación del GABA A por los agonistas del sitio de acción de las benzodiazepinas es autolimitante. La conductancia del canal no es mayor en presencia de benzodiazepinas y GABA que la conductancia en presencia de concentraciones altas de GABA únicamente. Además, en ausencia de GABA, la presencia de benzodiazepinas por sí sola no abre el canal de cloruro. [3]
Ciertos metabolitos de la progesterona y la desoxicorticosterona son moduladores alostéricos positivos potentes y selectivos del receptor de ácido γ-aminobutírico tipo A (GABA A ). [4] Hans Selye demostró en 1940 que ciertos esteroides pregnano podían causar tanto anestesia como sedación , [5] pero 40 años después surgió el mecanismo molecular para explicar su efecto depresor. En una preparación de cortes de cerebro de rata, el anestésico esteroide sintético alfaxalona (5α-pregnan-3α-ol-11,20 diona) mejoró tanto la inhibición evocada por estímulos como los efectos del muscimol aplicado exógenamente , que es un agonista selectivo del GABA A. [6]
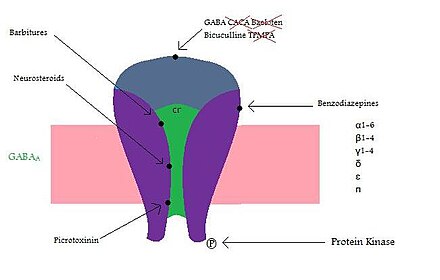
Los receptores GABA A están formados por subunidades que forman un complejo receptor. Los humanos tenemos 19 subunidades receptoras y se clasifican en α (1–6), β (1–3), γ (1–3), δ, ε, π, θ y ρ (1−3). La función del receptor es diferente según cómo se construya el complejo pentamérico . El complejo más común que incluye alrededor del 40% de los receptores GABA A es la combinación α1β2γ2. La expresión de las subunidades puede ser muy diferente según la región cerebral. [7] La combinación de las subunidades influye en cómo actúa el receptor. Por ejemplo, si las subunidades α1 y β2 se expresan juntas tienen alta sensibilidad al GABA, pero baja conductancia del canal . Pero si el γ2 se expresa con α1 y β2 la sensibilidad es baja y la conductancia del canal es alta. [8] La subunidad γ2 debe estar presente para que la benzodiazepina se una con alta afinidad. Se sabe poco sobre la ubicación de los diferentes complejos en el cerebro, lo que complica el descubrimiento de fármacos. [7] Por ejemplo, no se conoce el sitio de unión de los neuroesteroides en el receptor GABA A [9] y los barbitúricos se unen a una subunidad beta que es distinta del sitio de unión de la benzodiazepina.
Los sitios de acción precisos de los barbitúricos aún no se han definido. Los dominios transmembrana segundo y tercero de la subunidad β parecen ser críticos; la unión puede involucrar un bolsillo formado por la subunidad β metionina 286 así como por la subunidad α metionina 236. [13]
Los barbitúricos se introdujeron como hipnóticos para los pacientes con esquizofrenia . Inducían un estado de sueño profundo y prolongado, pero no se utilizaron durante mucho tiempo debido a sus efectos secundarios adversos. [2]
El fenobarbital fue el primer fármaco verdaderamente eficaz contra la epilepsia. Se descubrió por accidente cuando se administró a pacientes epilépticos para ayudarlos a dormir. Los efectos secundarios positivos fueron propiedades anticonvulsivas que redujeron el número y la intensidad de las convulsiones. [2]
El pentobarbital se utiliza como hipnótico cuando no se requiere analgesia . A menudo se utiliza en imágenes de TC cuando se necesita sedación. Es eficaz, seguro y el tiempo de recuperación es corto. [14] En 2013, los barbitúricos fenobarbital y butabarbital todavía se utilizan como sedantes en ciertos casos, así como para antagonizar los efectos de fármacos como la efedrina y la teofilina . El fenobarbital se utiliza en casos de síndromes de abstinencia de fármacos. Se utiliza como tratamiento normal y de emergencia en algunos casos de epilepsia. [2]

Acción sináptica de las benzodiazepinas: los receptores GABA A ubicados en las sinapsis se activan cuando se exponen a altas concentraciones de GABA. Las benzodiazepinas mejoran la afinidad del receptor por el GABA al aumentar la descomposición de las corrientes postsinápticas inhibitorias en miniatura espontáneas (mIPSC). [15] [16]
Las acciones sedantes de las benzodiazepinas limitan su utilidad como agentes analgésicos y, por lo tanto, generalmente no se las considera apropiadas. Esta limitación se puede evitar mediante la administración intratecal . Los receptores GABA A en la sustancia gris periacueductal son pronociceptivos en los sitios supraespinales , mientras que el GABA A que se encuentra en la médula espinal es antihiperalgésico. Los receptores GABA A espinales que contienen α2 y α3 son responsables de la acción antihiperalgésica del diazepam intratecal . Esto se demostró cuando la acción antihiperalgésica se redujo cuando se administró en ratones α2 y α3 en el dolor inflamatorio y en el dolor neuropático. Además, los estudios en ratones α5 mostraron que el receptor GABA A espinal que contiene α5 tiene un papel menor en el dolor inflamatorio. Un agonista alostérico positivo selectivo α2, α3 y/o α5, como L-838,417 por ejemplo, podría ser útil como fármaco analgésico contra el dolor inflamatorio o neuropático . [3] Estudios posteriores en modelos animales de dolor neuropático han demostrado que estabilizar el cotransportador de cloruro de potasio 2 ( KCC2 ) en las membranas neuronales no solo podría potenciar la analgesia inducida por L-838,417 sino también rescatar su potencial analgésico en dosis altas, revelando una nueva estrategia para la analgesia en el dolor patológico, mediante la combinación de la focalización de los subtipos apropiados del receptor GABA A (es decir, α 2 , α 3 ) y la restauración de la homeostasis del Cl − . [17]
Las benzodiazepinas se utilizan como tratamiento de apoyo en pacientes con esquizofrenia . [3]
Se ha propuesto una hipótesis GABAérgica para la depresión que coloca al sistema GABA en un papel central en la fisiopatología de la depresión . Estudios clínicos han demostrado que el alprazolam y el adinazolam tienen actividades antidepresivas en pacientes con trastorno depresivo mayor. Lamentablemente, no se sabe qué subtipo de receptor es responsable de las actividades antidepresivas.
Estudios realizados en ratones deficientes en y2 han demostrado que presentan un aumento de la ansiedad y síntomas similares a los depresivos en pruebas basadas en la desesperación. Los ratones también presentaron un aumento de la concentración de corticosterona , que es un síntoma de la depresión mayor en humanos. La subunidad y2 está asociada con las subunidades α1-α6, que son todas subunidades α conocidas, por lo que estos estudios no muestran cuáles de las subunidades α están relacionadas con los síntomas similares a los depresivos. Otros estudios realizados con ratones deficientes en α2 han mostrado un aumento de la ansiedad y síntomas similares a los depresivos en pruebas de alimentación basadas en conflictos. El hecho de que la ansiedad y la depresión a menudo estén vinculadas parece indicar que la subunidad α2 podría ser un objetivo válido para un antidepresivo GABA A. [3]
Los estudios preclínicos han demostrado que las benzodiazepinas pueden ser eficaces para reducir el efecto de los accidentes cerebrovasculares hasta tres días después de la administración del fármaco. [3]
Los neuroesteroides pueden actuar como moduladores alostéricos de los receptores de neurotransmisores, como los receptores GABA A , [18] [19] [20] [21] NMDA , [22] y sigma . [23] El neuroesteroide progesterona (PROG) que activa los receptores de progesterona expresados en células gliales periféricas y centrales. [24] [25] [26] [27] Además, se ha conjeturado que los esteroides pregnano reducidos en el anillo A 3α-hidroxi alopregnanolona y tetrahidrodesoxicorticosterona aumentan las corrientes de cloruro mediadas por GABA mientras que el sulfato de pregnenolona y el sulfato de deshidroepiandrosterona (DHEA) por otro lado muestran propiedades antagónicas en los receptores GABA A .
El ácido barbitúrico es el compuesto original de los fármacos barbitúricos, aunque el ácido barbitúrico en sí no es farmacológicamente activo. Los barbitúricos fueron sintetizados en 1864 por Adolf von Baeyer combinando urea y ácido malónico (Figura 5). Posteriormente, el químico francés Edouard Grimaux desarrolló y perfeccionó un proceso de síntesis en 1879, lo que hizo posible el posterior desarrollo generalizado de los derivados barbitúricos. [28] El ácido malónico fue reemplazado posteriormente por el malonato de dietilo , ya que el uso del éster evita la necesidad de lidiar con la acidez del ácido carboxílico y su carboxilato no reactivo (véase la figura 6). El ácido barbitúrico puede formar una gran variedad de fármacos barbitúricos mediante la reacción de condensación de Knoevenagel . [29]

La estructura en la que se basa la primera benzodiazepina fue descubierta por Leo H. Sternbach . Pensó que el compuesto tenía una estructura de heptoxdiazina (Figura 7), pero más tarde se determinó que era un quinazolina-3-óxido. A partir de ese compuesto se sintetizaron posibles fármacos candidatos y se analizaron en busca de actividad. Uno de estos compuestos era activo, el clordiazepóxido . Se comercializó en 1960 y se convirtió en la primera benzodiazepina. [30]
Los neuroesteroides se sintetizan en el sistema nervioso central (SNC) y el sistema nervioso periférico (SNP) a partir del colesterol y los precursores esteroides que se importan de fuentes periféricas. Estas fuentes incluyen derivados de 3β-hidroxi-Δ5, como la pregnenolona (PREG) y la dehidroepiandrosterona (DHEA), sus sulfatos y metabolitos reducidos como el derivado tetrahidro de la progesterona 3α-hidroxi-5α-pregnano-20-ona (3α,5α-THPROG). Después de la síntesis local o del metabolismo de los esteroides suprarrenales o gonadales, muchos neuroesteroides se acumulan en el cerebro. [31] [32]
Los barbitúricos tienen usos especiales y se organizan en 4 clases: de acción ultracorta, corta, intermedia y prolongada. Los SAR empíricos de los barbitúricos se basan en miles de compuestos probados (en animales). Han demostrado que R y R´ pueden no ser H en la posición 5 (ver figura 8). Además, la posición 5 confiere propiedades sedantes-hipnóticas. [14] Generalmente, la ramificación de alquilo en la posición 5 significa menos solubilidad en lípidos y menos actividad. La insaturación muestra menos actividad en la posición 5 y los anillos alicíclicos y aromáticos muestran menos potencia. Los sustituyentes polares (-NH 2 , -OH, -COOH) disminuirán la solubilidad en lípidos pero también eliminarán la actividad. R´´ en la posición 1 es generalmente H, pero CH 3 en esa posición produce menos solubilidad en lípidos y duración. El intercambio de S por un átomo de O en la posición 2 produce tiobarbitúricos, que son más solubles en lípidos que los oxibarbitúricos. En general, cuanto más liposoluble sea el barbitúrico, más rápido será su inicio de acción, más corta su duración y mayor el grado de actividad hipnótica. Los barbitúricos mostraron algunos problemas hidrolíticos en relación con la formulación de formas farmacéuticas líquidas. La dificultad es la degradación catalizada por -OH de los anillos de ureida , pero eso se puede solucionar si el pH es 6 en la formulación. La forma S(-) del barbitúrico ha mostrado una mayor actividad depresora, mientras que los isómeros R(+) tienen un efecto excitador. [33]
Según una investigación realizada por Maddalena et al., utilizando redes neuronales artificiales , la posición 7 tiene el mayor efecto sobre la afinidad del receptor . Cuando el grupo activo en la posición 7 se hace más lipofílico y la carga electrónica aumenta, la afinidad del receptor aumenta. En el mismo estudio, se encontró que la posición 2' era la segunda más importante en afectar la afinidad, pero el grupo en esa posición debe ser electrofílico para tener un efecto. Las posiciones 3, 6' y 8 son de menor importancia. [34] Los cambios a 6, 8, 9 o 4' disminuyen la actividad. Si el grupo en la posición 1 se cambia a N-alquilo, haloalquilo, alquinilo y ciclo pequeño o aminoalquilo, la actividad aumenta. La hidroxilación de la posición 3 puede causar una conjugación rápida y disminuir la duración y la potencia, lo que puede ser clínicamente útil. [34]

A mediados de la década de 1980, se demostró que los esteroides neuroactivos 3α,5α-tetrahidroprogesterona o alopregnanolona (3α,5α-THP) y 3α,5α- tetrahidrodesoxicorticosterona (3α,5α-THDOC) modulaban la excitabilidad neuronal a través de su interacción con los receptores GABA A. Los esteroides 3α,5α-THP y 3α,5α-THDOC pudieron mejorar la corriente de Cl − generada por GABA . [18] Además, estos esteroides podrían mejorar la unión del muscimol y las benzodiazepinas a los receptores GABA A. [35] Los estudios de estructura-actividad (SAR) mostraron que el grupo 3alfa-OH es esencial para las acciones anestésicas de estos esteroides, [36] también tienen un grupo aceptor de enlaces de hidrógeno ubicado de manera óptima en la cara β del esteroide en la posición C-17. Los cuatro anillos de esteroides forman un marco rígido para posicionar estos grupos de hidrógeno en el espacio tridimensional. [37] Los análogos 5 y 6 (Figura 10) son moduladores débiles de la función del receptor GABA A porque las cadenas laterales flexibles en estos análogos no tienen las conformaciones requeridas para una alta actividad biológica. [38]