
Una aleación es una mezcla de elementos químicos de los cuales en la mayoría de los casos al menos uno es un elemento metálico , aunque también se utiliza a veces para mezclas de elementos; en este documento solo se describen aleaciones metálicas . La mayoría de las aleaciones son metálicas y muestran buena conductividad eléctrica , ductilidad , opacidad y brillo , y pueden tener propiedades que difieren de las de los elementos puros, como mayor resistencia o dureza. En algunos casos, una aleación puede reducir el costo total del material al tiempo que conserva propiedades importantes. En otros casos, la mezcla imparte propiedades sinérgicas como resistencia a la corrosión o resistencia mecánica.
En una aleación, los átomos están unidos por enlaces metálicos en lugar de por enlaces covalentes que se encuentran típicamente en los compuestos químicos. [1] Los constituyentes de la aleación generalmente se miden por porcentaje de masa para aplicaciones prácticas y en fracción atómica para estudios de ciencias básicas. Las aleaciones generalmente se clasifican como aleaciones sustitucionales o intersticiales , dependiendo de la disposición atómica que forma la aleación. Pueden clasificarse además como homogéneas (que consisten en una sola fase), o heterogéneas (que consisten en dos o más fases) o intermetálicas . Una aleación puede ser una solución sólida de elementos metálicos (una sola fase, donde todos los granos metálicos (cristales) son de la misma composición) o una mezcla de fases metálicas (dos o más soluciones, que forman una microestructura de diferentes cristales dentro del metal).
Entre los ejemplos de aleaciones se incluyen el oro rojo ( oro y cobre ), el oro blanco (oro y plata ), la plata esterlina (plata y cobre), el acero o el acero al silicio ( hierro con carbono no metálico o silicio respectivamente), la soldadura , el latón , el peltre , el duraluminio , el bronce y las amalgamas .
Las aleaciones se utilizan en una amplia variedad de aplicaciones, desde las aleaciones de acero, utilizadas en todo, desde edificios hasta automóviles y herramientas quirúrgicas, hasta las exóticas aleaciones de titanio utilizadas en la industria aeroespacial, hasta las aleaciones de berilio y cobre para herramientas antichispas.

Una aleación es una mezcla de elementos químicos que forma una sustancia impura (mezcla) que conserva las características de un metal. Una aleación se distingue de un metal impuro en que, con una aleación, los elementos añadidos están bien controlados para producir propiedades deseables, mientras que los metales impuros como el hierro forjado están menos controlados, pero a menudo se consideran útiles. Las aleaciones se hacen mezclando dos o más elementos, al menos uno de los cuales es un metal. Esto suele llamarse metal primario o metal base, y el nombre de este metal también puede ser el nombre de la aleación. Los demás componentes pueden ser o no metales, pero, cuando se mezclan con la base fundida, serán solubles y se disolverán en la mezcla. Las propiedades mecánicas de las aleaciones a menudo serán bastante diferentes de las de sus componentes individuales. Un metal que normalmente es muy blando ( maleable ), como el aluminio , se puede alterar al alearlo con otro metal blando, como el cobre . Aunque ambos metales son muy blandos y dúctiles , la aleación de aluminio resultante tendrá una resistencia mucho mayor . Al añadir una pequeña cantidad de carbono no metálico al hierro, se cambia su gran ductilidad por la mayor resistencia de una aleación llamada acero. Debido a su altísima resistencia, pero aún así su considerable tenacidad , y a su capacidad de ser alterado en gran medida por el tratamiento térmico , el acero es una de las aleaciones más útiles y comunes en el uso moderno. Al añadir cromo al acero, se puede mejorar su resistencia a la corrosión , creando acero inoxidable , mientras que al añadir silicio se alteran sus características eléctricas, produciendo acero al silicio .

Al igual que el aceite y el agua, un metal fundido no siempre se puede mezclar con otro elemento. Por ejemplo, el hierro puro es casi completamente insoluble con el cobre. Incluso cuando los constituyentes son solubles, cada uno normalmente tendrá un punto de saturación , más allá del cual no se puede añadir más del constituyente. El hierro, por ejemplo, puede contener un máximo de 6,67% de carbono. Aunque los elementos de una aleación normalmente deben ser solubles en estado líquido , pueden no serlo siempre en estado sólido . Si los metales permanecen solubles cuando están sólidos, la aleación forma una solución sólida , convirtiéndose en una estructura homogénea que consiste en cristales idénticos, llamada fase . Si a medida que la mezcla se enfría los constituyentes se vuelven insolubles, pueden separarse para formar dos o más tipos diferentes de cristales, creando una microestructura heterogénea de diferentes fases, algunas con más de un constituyente que del otro. Sin embargo, en otras aleaciones, los elementos insolubles pueden no separarse hasta después de que se produzca la cristalización. Si se enfrían muy rápidamente, primero cristalizan como una fase homogénea, pero están sobresaturados con los constituyentes secundarios. A medida que pasa el tiempo, los átomos de estas aleaciones sobresaturadas pueden separarse de la red cristalina, volviéndose más estables y formando una segunda fase que sirve para reforzar los cristales internamente.

Algunas aleaciones, como el electrum (una aleación de plata y oro) , se producen de forma natural. Los meteoritos a veces están hechos de aleaciones naturales de hierro y níquel , pero no son nativas de la Tierra. Una de las primeras aleaciones hechas por los humanos fue el bronce, que es una mezcla de los metales estaño y cobre. El bronce era una aleación extremadamente útil para los antiguos, porque es mucho más fuerte y más duro que cualquiera de sus componentes. El acero era otra aleación común. Sin embargo, en la antigüedad, solo podía crearse como un subproducto accidental del calentamiento del mineral de hierro en incendios ( fundición ) durante la fabricación de hierro. Otras aleaciones antiguas incluyen peltre , latón y arrabio . En la era moderna, el acero se puede crear en muchas formas. El acero al carbono se puede hacer variando solo el contenido de carbono, produciendo aleaciones blandas como el acero dulce o aleaciones duras como el acero para resortes . Los aceros aleados se pueden hacer agregando otros elementos, como cromo , molibdeno , vanadio o níquel , lo que da como resultado aleaciones como el acero de alta velocidad o el acero para herramientas . Generalmente, se utilizan pequeñas cantidades de manganeso en la mayoría de los aceros modernos debido a su capacidad para eliminar impurezas no deseadas, como fósforo , azufre y oxígeno , que pueden tener efectos perjudiciales en la aleación. Sin embargo, la mayoría de las aleaciones no se crearon hasta la década de 1900, como varias aleaciones de aluminio, titanio , níquel y magnesio . Algunas superaleaciones modernas , como incoloy , inconel y hastelloy , pueden estar compuestas por una multitud de elementos diferentes.
Una aleación es técnicamente un metal impuro, pero cuando se hace referencia a aleaciones, el término impurezas generalmente denota elementos indeseables. Dichas impurezas se introducen a partir de los metales base y los elementos de aleación, pero se eliminan durante el procesamiento. Por ejemplo, el azufre es una impureza común en el acero. El azufre se combina fácilmente con el hierro para formar sulfuro de hierro , que es muy frágil y crea puntos débiles en el acero. [2] El litio , el sodio y el calcio son impurezas comunes en las aleaciones de aluminio, que pueden tener efectos adversos en la integridad estructural de las piezas fundidas. Por el contrario, los metales puros que contienen impurezas no deseadas a menudo se denominan "metales impuros" y no suelen denominarse aleaciones. El oxígeno, presente en el aire, se combina fácilmente con la mayoría de los metales para formar óxidos metálicos ; especialmente a las temperaturas más altas que se encuentran durante la aleación. A menudo se tiene mucho cuidado durante el proceso de aleación para eliminar el exceso de impurezas, utilizando fundentes , aditivos químicos u otros métodos de metalurgia extractiva . [3]
La aleación de un metal se realiza combinándolo con uno o más elementos. El proceso de aleación más común y más antiguo se realiza calentando el metal base más allá de su punto de fusión y luego disolviendo los solutos en el líquido fundido, lo que puede ser posible incluso si el punto de fusión del soluto es mucho mayor que el de la base. Por ejemplo, en su estado líquido, el titanio es un disolvente muy fuerte capaz de disolver la mayoría de los metales y elementos. Además, absorbe fácilmente gases como el oxígeno y se quema en presencia de nitrógeno. Esto aumenta la posibilidad de contaminación de cualquier superficie en contacto, por lo que debe fundirse en un crisol de cobre especial enfriado con agua y calentado por inducción al vacío . [4] Sin embargo, algunos metales y solutos, como el hierro y el carbono, tienen puntos de fusión muy altos y era imposible que los pueblos antiguos los fundieran. Así, la aleación (en particular, la aleación intersticial) también puede realizarse con uno o más constituyentes en estado gaseoso, como los que se encuentran en un alto horno para fabricar arrabio (líquido-gas), nitruración , carbonitruración u otras formas de endurecimiento superficial (sólido-gas), o el proceso de cementación utilizado para fabricar acero blíster (sólido-gas). También puede realizarse con uno, más o todos los constituyentes en estado sólido, como los que se encuentran en los métodos antiguos de soldadura por patrones (sólido-sólido), acero de corte (sólido-sólido) o producción de acero al crisol (sólido-líquido), mezclando los elementos mediante difusión en estado sólido .
Al añadir otro elemento a un metal, las diferencias en el tamaño de los átomos crean tensiones internas en la red de los cristales metálicos; tensiones que a menudo mejoran sus propiedades. Por ejemplo, la combinación de carbono con hierro produce acero, que es más fuerte que el hierro, su elemento principal. La conductividad eléctrica y térmica de las aleaciones suele ser inferior a la de los metales puros. Las propiedades físicas, como la densidad , la reactividad y el módulo de Young de una aleación pueden no diferir mucho de las de su elemento base, pero las propiedades de ingeniería como la resistencia a la tracción , [5] la ductilidad y la resistencia al corte pueden ser sustancialmente diferentes de las de los materiales constituyentes. Esto a veces es el resultado de los tamaños de los átomos de la aleación, porque los átomos más grandes ejercen una fuerza de compresión sobre los átomos vecinos y los átomos más pequeños ejercen una fuerza de tracción sobre sus vecinos, lo que ayuda a la aleación a resistir la deformación. A veces, las aleaciones pueden presentar marcadas diferencias en el comportamiento incluso cuando están presentes pequeñas cantidades de un elemento. Por ejemplo, las impurezas en aleaciones ferromagnéticas semiconductoras dan lugar a propiedades diferentes, como predijeron por primera vez White, Hogan, Suhl, Tian Abrie y Nakamura. [6] [7]
A diferencia de los metales puros, la mayoría de las aleaciones no tienen un único punto de fusión , sino un intervalo de fusión durante el cual el material es una mezcla de fases sólidas y líquidas (un lodo). La temperatura a la que comienza la fusión se denomina solidus , y la temperatura cuando la fusión se completa se denomina liquidus . Para muchas aleaciones existe una proporción particular de aleación (en algunos casos más de una), llamada mezcla eutéctica o composición peritéctica, que le da a la aleación un punto de fusión único y bajo, y no hay transición de lodo líquido/sólido.

Los elementos de aleación se añaden a un metal base para inducir dureza , tenacidad , ductilidad u otras propiedades deseadas. La mayoría de los metales y aleaciones se pueden endurecer mediante la creación de defectos en su estructura cristalina. Estos defectos se crean durante la deformación plástica mediante martilleo, doblado, extrusión, etc., y son permanentes a menos que el metal se recristalice . De lo contrario, algunas aleaciones también pueden tener sus propiedades alteradas por el tratamiento térmico . Casi todos los metales se pueden ablandar mediante recocido , que recristaliza la aleación y repara los defectos, pero no tantos se pueden endurecer mediante calentamiento y enfriamiento controlados. Muchas aleaciones de aluminio, cobre, magnesio , titanio y níquel se pueden fortalecer hasta cierto punto mediante algún método de tratamiento térmico, pero pocas responden a esto en el mismo grado que el acero. [8]
El hierro, metal base de la aleación hierro-carbono conocida como acero, sufre un cambio en la disposición ( alotropía ) de los átomos de su matriz cristalina a una determinada temperatura (normalmente entre 820 °C (1.500 °F) y 870 °C (1.600 °F), dependiendo del contenido de carbono). Esto permite que los átomos de carbono más pequeños entren en los intersticios del cristal de hierro. Cuando ocurre esta difusión , se dice que los átomos de carbono están en solución en el hierro, formando una fase cristalina única, homogénea y particular llamada austenita . Si el acero se enfría lentamente, el carbono puede difundirse fuera del hierro y gradualmente volverá a su alótropo de baja temperatura. Durante el enfriamiento lento, los átomos de carbono ya no serán tan solubles con el hierro y se verán obligados a precipitarse fuera de la solución, nucleándose en una forma más concentrada de carburo de hierro (Fe3C ) en los espacios entre los cristales de hierro puro. El acero se vuelve entonces heterogéneo, ya que está formado por dos fases, la fase de hierro-carbono llamada cementita (o carburo ), y la ferrita de hierro puro . Este tratamiento térmico produce un acero que es bastante blando. Sin embargo, si el acero se enfría rápidamente, los átomos de carbono no tendrán tiempo de difundirse y precipitarse como carburo, sino que quedarán atrapados dentro de los cristales de hierro. Cuando se enfría rápidamente, se produce una transformación sin difusión (martensita) , en la que los átomos de carbono quedan atrapados en la solución. Esto hace que los cristales de hierro se deformen a medida que la estructura cristalina intenta cambiar a su estado de baja temperatura, dejando esos cristales muy duros pero mucho menos dúctiles (más frágiles).
Si bien la alta resistencia del acero se logra cuando se evita la difusión y la precipitación (formación de martensita), la mayoría de las aleaciones tratables térmicamente son aleaciones de endurecimiento por precipitación , que dependen de la difusión de los elementos de aleación para lograr su resistencia. Cuando se calientan para formar una solución y luego se enfrían rápidamente, estas aleaciones se vuelven mucho más blandas de lo normal, durante la transformación sin difusión, pero luego se endurecen a medida que envejecen. Los solutos en estas aleaciones se precipitarán con el tiempo, formando fases intermetálicas , que son difíciles de distinguir del metal base. A diferencia del acero, en el que la solución sólida se separa en diferentes fases cristalinas (carburo y ferrita), las aleaciones de endurecimiento por precipitación forman diferentes fases dentro del mismo cristal. Estas aleaciones intermetálicas parecen homogéneas en la estructura cristalina, pero tienden a comportarse de manera heterogénea, volviéndose duras y algo quebradizas. [8]
En 1906, Alfred Wilm descubrió las aleaciones endurecibles por precipitación . Las aleaciones endurecibles por precipitación, como ciertas aleaciones de aluminio, titanio y cobre, son aleaciones tratables por calor que se ablandan cuando se templan (se enfrían rápidamente) y luego se endurecen con el tiempo. Wilm había estado buscando una forma de endurecer las aleaciones de aluminio para su uso en casquillos de ametralladoras. Sabiendo que las aleaciones de aluminio y cobre eran tratables por calor hasta cierto punto, Wilm intentó templar una aleación ternaria de aluminio, cobre y la adición de magnesio, pero inicialmente se sintió decepcionado con los resultados. Sin embargo, cuando Wilm volvió a probarla al día siguiente, descubrió que la aleación aumentaba en dureza cuando se dejaba envejecer a temperatura ambiente y superó con creces sus expectativas. Aunque no se proporcionó una explicación para el fenómeno hasta 1919, el duraluminio fue una de las primeras aleaciones de "endurecimiento por envejecimiento" utilizadas, convirtiéndose en el material de construcción principal para los primeros zepelines , y pronto fue seguido por muchos otros. [9] Debido a que a menudo presentan una combinación de alta resistencia y bajo peso, estas aleaciones se volvieron ampliamente utilizadas en muchas formas de industria, incluida la construcción de aviones modernos . [10]
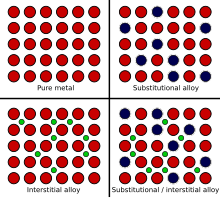
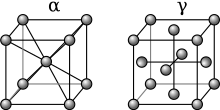
Cuando un metal fundido se mezcla con otra sustancia, hay dos mecanismos que pueden provocar la formación de una aleación, denominados intercambio atómico y mecanismo intersticial . El tamaño relativo de cada elemento de la mezcla desempeña un papel fundamental a la hora de determinar qué mecanismo se producirá. Cuando los átomos son relativamente similares en tamaño, suele producirse el método de intercambio atómico, en el que algunos de los átomos que componen los cristales metálicos se sustituyen por átomos del otro constituyente. Esto se denomina aleación sustitutiva . Entre los ejemplos de aleaciones sustitutivas se incluyen el bronce y el latón, en los que algunos de los átomos de cobre se sustituyen por átomos de estaño o de cinc respectivamente.
En el caso del mecanismo intersticial, un átomo suele ser mucho más pequeño que el otro y no puede sustituir con éxito al otro tipo de átomo en los cristales del metal base. En cambio, los átomos más pequeños quedan atrapados en los sitios intersticiales entre los átomos de la matriz cristalina. Esto se conoce como aleación intersticial . El acero es un ejemplo de aleación intersticial, porque los átomos de carbono muy pequeños encajan en los intersticios de la matriz de hierro.
El acero inoxidable es un ejemplo de una combinación de aleaciones intersticiales y sustitucionales, porque los átomos de carbono encajan en los intersticios, pero algunos de los átomos de hierro son sustituidos por átomos de níquel y cromo. [8]

El uso de aleaciones por parte de los humanos comenzó con el uso del hierro meteórico , una aleación natural de níquel y hierro. Es el componente principal de los meteoritos de hierro . Como no se utilizaron procesos metalúrgicos para separar el hierro del níquel, la aleación se utilizó tal como estaba. [11] El hierro meteórico se podía forjar a partir de un calor rojo para fabricar objetos como herramientas, armas y clavos. En muchas culturas se le daba forma martillándolo en frío para convertirlo en cuchillos y puntas de flecha. A menudo se usaban como yunques. El hierro meteórico era muy raro y valioso, y difícil de trabajar para los pueblos antiguos . [12]


El hierro se encuentra generalmente como mineral de hierro en la Tierra, a excepción de un depósito de hierro nativo en Groenlandia , que fue utilizado por los inuit . [13] Sin embargo, el cobre nativo se encontró en todo el mundo, junto con la plata, el oro y el platino , que también se usaron para hacer herramientas, joyas y otros objetos desde el Neolítico. El cobre era el más duro de estos metales y el más ampliamente distribuido. Se convirtió en uno de los metales más importantes para los antiguos. Hace unos 10.000 años en las tierras altas de Anatolia (Turquía), los humanos aprendieron a fundir metales como el cobre y el estaño a partir del mineral . Alrededor de 2500 a. C., la gente comenzó a alear los dos metales para formar bronce, que era mucho más duro que sus ingredientes. Sin embargo, el estaño era raro, ya que se encontraba principalmente en Gran Bretaña. En Oriente Medio, la gente comenzó a alear cobre con zinc para formar latón. [14] Las civilizaciones antiguas tomaron en cuenta la mezcla y las diversas propiedades que producía, como dureza , tenacidad y punto de fusión, bajo diversas condiciones de temperatura y endurecimiento por trabajo , desarrollando gran parte de la información contenida en los diagramas de fases de aleación modernos . [15] Por ejemplo, las puntas de flecha de la dinastía china Qin (alrededor del 200 a. C.) a menudo se construían con una cabeza de bronce duro, pero una espiga de bronce más blanda, combinando las aleaciones para evitar tanto el embotamiento como la rotura durante el uso. [16]
El mercurio se ha fundido a partir del cinabrio durante miles de años. El mercurio disuelve muchos metales, como el oro, la plata y el estaño, para formar amalgamas (una aleación en forma de pasta blanda o líquida a temperatura ambiente). Las amalgamas se han utilizado desde el año 200 a. C. en China para dorar objetos como armaduras y espejos con metales preciosos. Los antiguos romanos solían utilizar amalgamas de mercurio y estaño para dorar sus armaduras. La amalgama se aplicaba como una pasta y luego se calentaba hasta que el mercurio se vaporizaba, dejando atrás el oro, la plata o el estaño. [17] El mercurio se utilizaba a menudo en la minería, para extraer metales preciosos como el oro y la plata de sus minerales. [18]

Muchas civilizaciones antiguas aleaban metales con fines puramente estéticos. En el antiguo Egipto y Micenas , el oro se solía alear con cobre para producir oro rojo, o con hierro para producir un brillante oro burdeos. A menudo se encontraba oro aleado con plata u otros metales para producir varios tipos de oro de colores . Estos metales también se usaban para reforzarse entre sí, con fines más prácticos. A menudo se añadía cobre a la plata para hacer plata esterlina , aumentando su resistencia para su uso en platos, platería y otros artículos prácticos. Muy a menudo, los metales preciosos se aleaban con sustancias menos valiosas como un medio para engañar a los compradores. [19] Alrededor del 250 a. C., el rey de Siracusa encargó a Arquímedes que encontrara una forma de comprobar la pureza del oro de una corona, lo que provocó el famoso grito de "¡Eureka!" en los baños públicos tras el descubrimiento del principio de Arquímedes . [20]
El término peltre cubre una variedad de aleaciones que consisten principalmente en estaño. Como metal puro, el estaño es demasiado blando para usarse en la mayoría de los propósitos prácticos. Sin embargo, durante la Edad del Bronce , el estaño era un metal raro en muchas partes de Europa y el Mediterráneo, por lo que a menudo se valoraba más que el oro. Para hacer joyas, cubiertos u otros objetos de estaño, los trabajadores generalmente lo aleaban con otros metales para aumentar la resistencia y la dureza. Estos metales eran típicamente plomo , antimonio , bismuto o cobre. Estos solutos a veces se agregaban individualmente en cantidades variables, o se agregaban juntos, creando una amplia variedad de objetos, que iban desde artículos prácticos como platos, herramientas quirúrgicas, candelabros o embudos, hasta artículos decorativos como aretes y pinzas para el cabello.
Los primeros ejemplos de peltre proceden del antiguo Egipto, alrededor del año 1450 a. C. Su uso se extendió por toda Europa, desde Francia hasta Noruega y Gran Bretaña (donde se extraía la mayor parte del estaño antiguo) y Oriente Próximo. [21] La aleación también se utilizó en China y el Lejano Oriente, llegando a Japón alrededor del año 800 d. C., donde se utilizó para fabricar objetos como vasijas ceremoniales, botes de té o cálices utilizados en los santuarios sintoístas . [22]
La primera fundición conocida de hierro comenzó en Anatolia , alrededor de 1800 a. C., llamada proceso bloomery , que producía hierro forjado muy blando pero dúctil . Hacia el 800 a. C., la tecnología de fabricación de hierro se había extendido a Europa, llegando a Japón alrededor del 700 d. C. El arrabio , una aleación muy dura pero quebradiza de hierro y carbono, se producía en China ya en el 1200 a. C., pero no llegó a Europa hasta la Edad Media. El arrabio tiene un punto de fusión más bajo que el hierro y se utilizaba para fabricar hierro fundido . Sin embargo, estos metales encontraron poco uso práctico hasta la introducción del acero al crisol alrededor del 300 a. C. Estos aceros eran de mala calidad, y la introducción de la soldadura por patrones , alrededor del siglo I d. C., buscó equilibrar las propiedades extremas de las aleaciones laminándolas, para crear un metal más resistente. Alrededor del año 700 d. C., los japoneses comenzaron a doblar acero desoxidado y hierro fundido en capas alternas para aumentar la resistencia de sus espadas, utilizando fundentes de arcilla para eliminar la escoria y las impurezas. Este método de fabricación de espadas japonés produjo una de las aleaciones de acero más puras del mundo antiguo. [15]
Aunque el uso del hierro empezó a generalizarse alrededor del año 1200 a. C., principalmente debido a las interrupciones en las rutas comerciales del estaño, el metal era mucho más blando que el bronce. Sin embargo, siempre se obtenían cantidades muy pequeñas de acero (una aleación de hierro y alrededor de un 1 % de carbono) como subproducto del proceso de desoxidación. La capacidad de modificar la dureza del acero mediante tratamiento térmico se conocía desde el año 1100 a. C. y este raro material era valorado para la fabricación de herramientas y armas. Como los antiguos no podían producir temperaturas lo suficientemente altas como para fundir completamente el hierro, la producción de acero en cantidades decentes no se produjo hasta la introducción del acero blíster durante la Edad Media. Este método introducía carbono calentando el hierro forjado en carbón durante largos períodos de tiempo, pero la absorción de carbono de esta manera es extremadamente lenta, por lo que la penetración no era muy profunda, por lo que la aleación no era homogénea. En 1740, Benjamin Huntsman comenzó a fundir acero blíster en un crisol para igualar el contenido de carbono, creando el primer proceso para la producción en masa de acero para herramientas . El proceso de Huntsman se utilizó para la fabricación de acero para herramientas hasta principios del siglo XX. [23]
La introducción del alto horno en Europa en la Edad Media significó que la gente podía producir arrabio en volúmenes mucho mayores que el hierro forjado. Debido a que el arrabio se podía fundir, la gente comenzó a desarrollar procesos para reducir el carbono en el arrabio líquido para crear acero. El pudling se había utilizado en China desde el siglo I y se introdujo en Europa durante el siglo XVIII, donde el arrabio fundido se agitaba mientras se exponía al aire, para eliminar el carbono por oxidación . En 1858, Henry Bessemer desarrolló un proceso de fabricación de acero soplando aire caliente a través del arrabio líquido para reducir el contenido de carbono. El proceso Bessemer condujo a la primera fabricación de acero a gran escala. [23]
El acero es una aleación de hierro y carbono, pero el término acero de aleación generalmente solo se refiere a aceros que contienen otros elementos, como vanadio , molibdeno o cobalto , en cantidades suficientes para alterar las propiedades del acero base. Desde la antigüedad, cuando el acero se usaba principalmente para herramientas y armas, los métodos de producción y trabajo del metal a menudo eran secretos celosamente guardados. Incluso mucho después de la Era de la Ilustración , la industria del acero era muy competitiva y los fabricantes hacían grandes esfuerzos para mantener sus procesos confidenciales, resistiéndose a cualquier intento de analizar científicamente el material por temor a que revelara sus métodos. Por ejemplo, se sabía que los habitantes de Sheffield , un centro de producción de acero en Inglaterra, impedían rutinariamente la entrada a la ciudad de visitantes y turistas para disuadir el espionaje industrial . Por lo tanto, casi no existía información metalúrgica sobre el acero hasta 1860. Debido a esta falta de comprensión, el acero no se consideró generalmente una aleación hasta las décadas entre 1930 y 1970 (principalmente debido al trabajo de científicos como William Chandler Roberts-Austen , Adolf Martens y Edgar Bain ), por lo que "acero de aleación" se convirtió en el término popular para las aleaciones de acero ternarias y cuaternarias. [24] [25]
Después de que Benjamin Huntsman desarrollara su acero de crisol en 1740, comenzó a experimentar con la adición de elementos como el manganeso (en forma de un arrabio con alto contenido de manganeso llamado spiegeleisen ), que ayudó a eliminar impurezas como el fósforo y el oxígeno; un proceso adoptado por Bessemer y que todavía se utiliza en los aceros modernos (aunque en concentraciones lo suficientemente bajas como para seguir considerándose acero al carbono). [26] Después, muchas personas comenzaron a experimentar con varias aleaciones de acero sin mucho éxito. Sin embargo, en 1882, Robert Hadfield , pionero en la metalurgia del acero, se interesó y produjo una aleación de acero que contenía alrededor del 12% de manganeso. Llamado mangalloy , exhibió una dureza y tenacidad extremas, convirtiéndose en el primer acero de aleación comercialmente viable. [27] Posteriormente, creó el acero al silicio, iniciando la búsqueda de otras posibles aleaciones de acero. [28]
Robert Forester Mushet descubrió que añadiendo tungsteno al acero se podía producir un borde muy duro que resistiría la pérdida de dureza a altas temperaturas. El "acero especial de R. Mushet" (RMS) se convirtió en el primer acero de alta velocidad . [29] El acero de Mushet fue rápidamente reemplazado por el acero de carburo de tungsteno , desarrollado por Taylor y White en 1900, en el que duplicaron el contenido de tungsteno y añadieron pequeñas cantidades de cromo y vanadio, produciendo un acero superior para su uso en tornos y herramientas de mecanizado. En 1903, los hermanos Wright utilizaron un acero al cromo-níquel para fabricar el cigüeñal de su motor de avión, mientras que en 1908 Henry Ford empezó a utilizar aceros al vanadio para piezas como cigüeñales y válvulas en su Ford Modelo T , debido a su mayor resistencia y resistencia a las altas temperaturas. [30] En 1912, la fábrica de hierro Krupp en Alemania desarrolló un acero resistente a la oxidación añadiendo un 21% de cromo y un 7% de níquel, produciendo el primer acero inoxidable. [31]
Debido a su alta reactividad, la mayoría de los metales no fueron descubiertos hasta el siglo XIX. En 1807, Humphry Davy propuso un método para extraer aluminio de la bauxita mediante un arco eléctrico . Aunque sus intentos no tuvieron éxito, en 1855 llegaron al mercado las primeras ventas de aluminio puro. Sin embargo, como la metalurgia extractiva estaba todavía en sus inicios, la mayoría de los procesos de extracción de aluminio producían aleaciones no deseadas contaminadas con otros elementos que se encontraban en el mineral; el más abundante de los cuales era el cobre. Estas aleaciones de aluminio y cobre (en aquel momento denominadas "bronce de aluminio") precedieron al aluminio puro, ofreciendo mayor resistencia y dureza que el metal blando y puro, y se descubrió que eran tratables térmicamente en un grado leve. [32] Sin embargo, debido a su suavidad y limitada templabilidad, estas aleaciones encontraron poco uso práctico y fueron más bien una novedad hasta que los hermanos Wright utilizaron una aleación de aluminio para construir el primer motor de avión en 1903. [30] Durante el período entre 1865 y 1910, se descubrieron procesos para extraer muchos otros metales, como cromo, vanadio, tungsteno, iridio , cobalto y molibdeno, y se desarrollaron varias aleaciones. [33]
Antes de 1910, la investigación consistía principalmente en experimentos de particulares en sus propios laboratorios. Sin embargo, a medida que las industrias aeronáutica y automotriz comenzaron a crecer, la investigación en aleaciones se convirtió en un esfuerzo industrial en los años posteriores a 1910, ya que se desarrollaron nuevas aleaciones de magnesio para pistones y ruedas de automóviles, y metal de fundición para palancas y perillas, y se pusieron en uso aleaciones de aluminio desarrolladas para fuselajes y revestimientos de aeronaves . [30] La Doehler Die Casting Co. de Toledo, Ohio, era conocida por la producción de Brastil , una aleación de bronce resistente a la corrosión y de alta resistencia a la tracción. [34] [35]