

Un opiáceo es una sustancia alcaloide derivada del opio (o paja de adormidera ). [1] Se diferencia del término similar opioide en que este último se utiliza para designar todas las sustancias, tanto naturales como sintéticas, que se unen a los receptores opioides en el cerebro (incluidos los antagonistas). [2] Los opiáceos son compuestos alcaloides que se encuentran naturalmente en la planta de adormidera Papaver somniferum . [3] Los compuestos psicoactivos que se encuentran en la planta del opio incluyen morfina , codeína y tebaína (la figura a continuación es incorrecta, la tebaína es "3,6-Dimetoxi-"). Los opiáceos se han utilizado durante mucho tiempo para una variedad de afecciones médicas, con evidencia de comercio de opiáceos y uso para aliviar el dolor ya en el siglo VIII d. C. [4] La mayoría de los opiáceos se consideran drogas con un potencial de abuso moderado a alto y están incluidos en varias "Listas de Control de Sustancias" bajo la Ley Uniforme de Sustancias Controladas de los Estados Unidos de América.
En 2014, entre 13 y 20 millones de personas consumieron opioides de forma recreativa (entre el 0,3% y el 0,4% de la población mundial de entre 15 y 65 años). [5] Según los CDC, de esta población, hubo 47.000 muertes, con un total de 500.000 muertes entre 2000 y 2014. [6] En 2016, la Organización Mundial de la Salud informó que 27 millones de personas sufren trastorno por consumo de opioides . También informaron que en 2015, 450.000 personas murieron como resultado del consumo de drogas, y entre un tercio y la mitad de esa cifra se atribuyó a los opioides. [7]
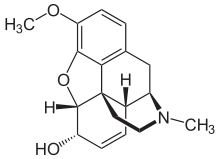
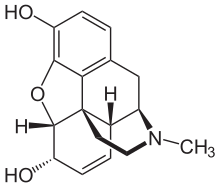
Los opiáceos pertenecen al gran grupo biosintético de los alcaloides bencilisoquinoleínicos y se denominan así porque son alcaloides naturales que se encuentran en la adormidera. Los principales opiáceos psicoactivos son la morfina , la codeína y la tebaína . La papaverina , la noscapina y aproximadamente otros 24 alcaloides también están presentes en el opio, pero tienen poco o ningún efecto sobre el sistema nervioso central humano . Los alcaloides que no tienen efecto sobre el sistema nervioso central no siempre se consideraron opiáceos, pero la tendencia actual es referirse a todos los alcaloides derivados del opio o la paja de adormidera como tales. En raras ocasiones se detectan cantidades muy pequeñas de hidrocodona e hidromorfona en los ensayos de opio; parece ser producida por la planta en circunstancias y por procesos que no se comprenden en este momento. [ cita requerida ] Dihidrocodeína , oximorfol , oxicodona , oximorfona , metopón. Es posible que también se encuentren otros derivados de la morfina y/o la hidromorfona en cantidades mínimas en el opio. [ cita requerida ]
A pesar de que la morfina es el opioide de mayor importancia médica, se consumen mayores cantidades de codeína con fines médicos, la mayor parte de ella sintetizada a partir de la morfina. La codeína tiene una biodisponibilidad oral mayor y más predecible . La codeína no se metaboliza de manera confiable en su forma activa, la morfina, por el CYP2D6 debido a la considerable cantidad de polimorfismo. Muchas personas carecen de un metabolismo apreciable de la morfina y no experimentan efectos terapéuticos (aunque aún pueden tener náuseas/vómitos o estreñimiento). Una población significativa son metabolizadores rápidos o ultrarrápidos y pueden desarrollar rápidamente una toxicidad fatal incluso con la pequeña cantidad presente en la leche materna o con unas pocas dosis. Se cree ampliamente que la codeína tiene menos potencial de abuso que la morfina, a pesar de que se abusa ampliamente. Su potencial de abuso está limitado en gran medida por su perfil de efectos adversos. [8] El uso de codeína en muchos países está disminuyendo debido a su amplio rango de metabolismo, los frecuentes efectos adversos en dosis terapéuticas (dosis de 30 a 60 mg) y en la mayoría de las personas su eficacia analgésica es comparable a una dosis terapéutica de acetaminofeno.

Los efectos del síndrome de abstinencia de opiáceos están asociados con el cese abrupto o la reducción del consumo prolongado de opiáceos.
La manifestación de la dependencia y el abuso de opiáceos depende de diversos factores, incluidas las propiedades farmacocinéticas del opiáceo y la predisposición del usuario a la adicción. [9]
Si bien es posible sintetizar completamente opioides a partir de naftoquinona (síntesis de Gates) u otros materiales de partida orgánicos simples, se trata de procesos tediosos y poco económicos. Por lo tanto, la mayoría de los analgésicos de tipo opiáceo que se utilizan hoy en día se extraen de Papaver somniferum o se sintetizan a partir de esos opiáceos, especialmente la tebaína . [10]
En 2015, los investigadores informaron que se había logrado biosíntesis exitosa de tebaína e hidrocodona utilizando levadura modificada genéticamente . Una vez que se haya escalado para uso comercial, el proceso reduciría el tiempo de producción de un año a varios días y podría reducir los costos en un 90 %. [11] [12]
La codeína es un profármaco que se convierte en morfina y actúa sobre los receptores μ -opiáceos. Se convierte en morfina mediante el metabolismo de las enzimas CYP2D6 . Las personas que tienen una actividad menor de CYP2D6 pueden no metabolizar la codeína en absoluto y no experimentarán sus efectos analgésicos. Por el contrario, las personas con una actividad rápida o ultrarrápida de CYP2D6 pueden metabolizar el fármaco demasiado rápido y experimentar efectos secundarios relacionados con la dosis, como sedación y depresión respiratoria mortal. [13]
El fentanilo es un opioide sintético de tipo piperidínico, estructuralmente similar a las arilpiperidinas. Es un potente agonista de los receptores μ , entre 80 y 100 veces más potente que la morfina, y tiene un inicio de acción rápido con una duración de acción más corta que la de la morfina debido a la redistribución desde el SNC hasta el tejido graso. Cuando se utiliza como fármaco continuo (p. ej., parches transdérmicos, uso a largo plazo de fentanilo intravenoso en pacientes de la UCI), su semivida de eliminación y la duración del efecto son más largas que las de la morfina. Se metaboliza en el hígado por las enzimas CYP3A4 al compuesto norfentanilo. [14]
La heroína, el nombre común de la diacetilmorfina , es el primero de varios opioides semisintéticos derivados de la morfina, un componente del opio natural. [16] Se forma por la acetilación de la morfina para aumentar la solubilidad en lípidos. [17] La heroína (diacetilmorfina) es un profármaco de la morfina ; es metabolizada por el hígado en morfina después de la administración. Uno de los principales metabolitos de la heroína, la 6-monoacetilmorfina (6-MAM), también es un profármaco de la morfina.
La hidromorfona se deriva de la morfina y puede utilizarse como alternativa a esta última. Tiene un metabolismo de primer paso elevado cuando se administra por vía oral y se glucuroniza principalmente en el hígado para formar hidromorfona-3-glucurónido (H3G). El 75 % de la hidromorfona se excreta por vía renal y el 7 % restante se excreta como opiáceo original. [14]
La meperidina es un opiáceo sintético, parte de la clase de las arilpiperidinas. Es un potente agonista de los receptores μ con una décima parte de la potencia de la morfina. Históricamente, se ha utilizado para tratar los escalofríos y tiene una vida media de tres a cuatro horas. Se metaboliza en el hígado a los metabolitos activos de normeperidina, ácido normepiridínico y ácido medperidínico. La normeperidina puede acumularse hasta alcanzar niveles tóxicos en pacientes con insuficiencia renal con dosis repetidas y puede causar excitación del sistema nervioso central y convulsiones. [14]
La metadona tiene una biodisponibilidad y una vida media más altas en comparación con la morfina. [18] Se metaboliza a un producto inactivo por N-desmetilación por las enzimas CYP3A4 en el hígado. Tiene una alta variabilidad de persona a persona debido a los diferentes niveles de CYP3A4 en los individuos. [19] Está aprobado para el tratamiento del dolor moderado a severo, así como la dependencia de opioides. [20] Debido a su alto riesgo de interacciones farmacológicas, toxicidad hepática y variabilidad del paciente, los pacientes deben ser monitoreados de cerca en las clínicas de metadona . [21] Además, existe un mayor riesgo de mortalidad en pacientes que son tratados con metadona en comparación con otros opioides, que se cree que se debe a la prolongación del intervalo QTc y a las arritmias cardíacas.
La nicomorfina (Vilan, dinicotinato de morfina), la diamorfina (heroína, diacetato de morfina), la dipropanoilmorfina (dipropionato de morfina), la desomorfina (Permonid, dihidrodesoximorfina), la metildesorfina , la acetilpropionilmorfina , la dibenzoilmorfina , la diacetildihidromorfina y varias otras también se derivan de la morfina. [22]
La morfina se metaboliza en el hígado a morfina-3-glucurónido (M3G) y morfina-6-glucurónido (M6G), y se excreta por los riñones. También puede atravesar la barrera hematoencefálica hacia el líquido cefalorraquídeo. La M6G tiene una potente actividad analgésica, se une a los receptores opioides y es un contribuyente principal al beneficio terapéutico de la morfina. [23] La M3G no actúa como analgésico, tiene una baja afinidad por los receptores opioides y posiblemente pueda antagonizar los efectos terapéuticos de la morfina y la M6G. Además, las dosis altas de morfina, y por lo tanto de M3G, se asocian con efectos secundarios neurotóxicos como hiperalgesia , alodinia y mioclono . [24]
La oximorfona es un congénere de la morfina. Se metaboliza a 6-hidroxi-oximorfona y oximorfona-3-glucurónido, y el 40% se excreta como metabolitos. La 6-hidroxi-oximorfina es activa y existe en una proporción de 1:1 con el fármaco original. Se desconoce la actividad de la oximorfona-3-glucurónido. [14]
Los opiáceos con actividad opioide se utilizan principalmente para el tratamiento del dolor con la premisa de que habrá beneficios tanto para el dolor como para la función que superarán los riesgos para el paciente. [25] Otra indicación es el alivio sintomático de la falta de aire , tanto en el contexto agudo (por ejemplo, edema pulmonar ) como en pacientes terminales. [26] [27]
A pesar de la escasa evidencia, a menudo contradictoria, y de los estudios que a veces no muestran ningún beneficio, los opioides como la codeína, la hidrocodona y la hidromorfona se han utilizado tradicionalmente para el tratamiento de la tos viral aguda (también conocida como "bronquitis aguda"), la tos debida a la exacerbación de la EPOC, la tos posviral crónica, la tos idiopática crónica y la tos por otras causas. Dado el potencial de abuso, los frecuentes efectos secundarios gastrointestinales y varios estudios que no muestran ningún beneficio discernible, las recomendaciones están en contra del uso de opioides para la tos en niños. A pesar de su uso generalizado, la ciencia que respalda el uso de opioides para la tos en adultos es más notable por el pequeño tamaño de la muestra, el diseño deficiente del estudio y los resultados no concluyentes que sugieren que puede haber una pequeña reducción en la cantidad de tos cuando se mide con precisión. La evidencia real de resultados orientados al paciente (por ejemplo, si los pacientes se sienten mejor que cuando se les da un placebo) es difícil de alcanzar, y el uso de la codeína como el "estándar de oro" con el que se pueden comparar otros medicamentos ha sido puesto en duda (ya que demostrar que un medicamento es tan bueno como, o al menos no peor que, un medicamento sin beneficio y solo con efectos secundarios nocivos y un potencial de abuso deja mucho que desear). [ cita requerida ]
Las conversiones de dosis de opioides pueden ser necesarias cuando se cambian los medicamentos, dada la diferente farmacodinámica entre los opioides. Generalmente, la morfina parenteral (IV o IM) se utiliza como el estándar para la conversión entre opiáceos para lograr efectos analgésicos equivalentes. Estas diferencias en los equivalentes de morfina pueden diferir entre las formulaciones del mismo medicamento, y ciertamente entre la administración oral y la inyección. [28] El cálculo de la dosis diaria total utilizando equivalentes en miligramos de morfina se utiliza para identificar a los pacientes con riesgo de sobredosis. [29]
Los efectos secundarios comunes asociados con el uso de opioides incluyen: sedación , náuseas , mareos, vómitos, estreñimiento , dependencia física, tolerancia y depresión respiratoria potencialmente fatal . De estos, los más comunes son el estreñimiento y las náuseas. No se desarrolla tolerancia al estreñimiento. [30] Es por eso que los ablandadores de heces o laxantes (polietilenglicol, docusato y sen) a menudo se recetan junto con los opioides. [31]
Mientras que la sobredosis, ya sea intencional, accidental o debido a la rápida conversión 2D6 de codeína (o tramadol, un opioide no opiáceo que, como la codeína, tiene poco efecto intrínseco sobre los receptores μ, sino que actúa como profármaco con un metabolito activo que es un agonista μ .
Los efectos secundarios menos comunes incluyen: vaciamiento gástrico retardado, hiperalgesia , disfunción inmunológica y hormonal (el hipogonadismo se observa a menudo en hombres que toman opioides crónicos, pero no siempre es clínicamente evidente), rigidez muscular y mioclono . [32]
El uso de opiáceos para el dolor está ampliamente aceptado en el sistema de salud. Sin embargo, el tratamiento a largo plazo para el dolor crónico es controvertido, ya que existe un alto riesgo de adicción asociado con su uso, lo que lleva al abuso y la desviación a otros incluso cuando se toman adecuadamente. [33] Las personas adictas a los opiáceos priorizarán la adquisición de estas drogas sobre otras actividades en sus vidas, lo que repercute negativamente en sus relaciones profesionales y personales. Además, no hay muchos estudios bien diseñados que evalúen la seguridad y eficacia generales. Muchos estudios pequeños que utilizan dosis pequeñas (a menudo la mitad de la dosis recomendada) no han demostrado mucho efecto, pero no se puede confiar en que brinden mucha información sobre la práctica más común de la terapia escalonada y la escalada lenta de la dosis.
El uso crónico de opioides conduce previsiblemente a la tolerancia , y puede hacerlo con bastante rapidez (días o semanas). Esto ocurre incluso con dosis consideradas modestas (p. ej., ≥25 mg de oxicodona al día). Esto puede hacer que el paciente necesite dosis más altas y/o más frecuentes del fármaco para obtener efectos eufóricos, aunque puede que no sea un factor en los efectos analgésicos, ya que la tolerancia a una dosis de opioide no parece estar relacionada con la pérdida de eficacia. [34] La tolerancia se asocia con la regulación positiva de los receptores μ (y posiblemente otros).
Los efectos adversos dependientes de la concentración pueden variar según los polimorfismos genéticos del usuario, que pueden alterar el metabolismo del fármaco. El citocromo P450 (especialmente CYP2D6 , pero también CYP3A4 ) es responsable del metabolismo de varios opiáceos a metabolitos activos y las variaciones en la actividad de CYP450 conducen a niveles séricos variables del fármaco. [35]
El dolor es una experiencia sensorial y emocional desagradable asociada con un daño tisular real o potencial. Es una función defensiva esencial en la que el dolor funciona como una alarma para evitar o limitar el daño tisular. Su neurobiología es compleja e implica la estimulación de varios tipos diferentes de nervios. Los opioides actúan sobre los receptores opioides que están acoplados a los receptores acoplados a la proteína G inhibidora (GPCR). Estos receptores se dividen en tres clases: receptores μ (mu) , δ (delta) y κ (kappa) . [36]
Más del 70% de los receptores opioides son receptores μ, ubicados predominantemente en las terminales centrales de los nociceptores en el asta dorsal de la médula espinal. El 30% restante de los receptores opioides se ubican postsinápticamente en las dendritas de las neuronas espinotalámicas de segundo orden y las interneuronas. [36]
Cuando un opiáceo se une como agonista al GPCR, se produce una cascada de señalización que da como resultado la inhibición de la adenilato ciclasa y los canales de iones de calcio con la estimulación de los canales de iones de potasio. El efecto neto de estos cambios es una reducción del AMPc intracelular y la hiperpolarización de la célula neuronal, lo que reduce la liberación de neurotransmisores. [37] A través de esta vía, cuando los opiáceos se unen al receptor mu y lo activan, hay una disminución de la transmisión de la señalización del dolor. Esta vía está dirigida a las propiedades analgésicas por las que se conocen y se utilizan los opiáceos. Otras funciones clínicamente importantes del mu son su participación en las funciones respiratorias y cardiovasculares, el peristaltismo gastrointestinal , la alimentación y el estado de ánimo. [38] Estas otras vías son importantes porque explican los efectos secundarios del uso de opiáceos, como la depresión respiratoria a dosis altas, el estreñimiento con el uso crónico y las propiedades adictivas. [32]
Las personas con las siguientes afecciones no deberían utilizar opioides: [39]
Los siguientes son factores de riesgo para el abuso de prescripción de opiáceos: [40]
Estadísticamente, los pacientes de mediana edad con antecedentes de consumo de sustancias y comorbilidades psiquiátricas presentan mayores riesgos de mortalidad, como el suicidio.
La dependencia iatrogénica fisiológica y psicológica de los medicamentos puede afectar a personas de cualquier origen. Algunos médicos son más liberales con la prescripción de opiáceos y sus pacientes se vuelven dependientes de ellos simplemente por seguir las órdenes de su médico. [41]
es el término más antiguo que se utiliza clásicamente en farmacología para designar una droga derivada del opio. Se ha utilizado en el pasado para referirse a drogas con efectos similares al opio, pero ese uso es anticuado. Opioide, un término más moderno, se utiliza para designar todas las sustancias, tanto naturales como sintéticas, que se unen a los receptores opioides (incluidos los antagonistas).
{{cite journal}}: CS1 maint: multiple names: authors list (link)