La taquicardia ventricular polimórfica catecolaminérgica ( CPVT ) es un trastorno genético hereditario que predispone a los afectados a ritmos cardíacos anormales o arritmias potencialmente mortales . Las arritmias observadas en la TVPC ocurren típicamente durante el ejercicio o en momentos de estrés emocional, y clásicamente toman la forma de taquicardia ventricular bidireccional o fibrilación ventricular . Los afectados pueden ser asintomáticos, pero también pueden sufrir desmayos o incluso muerte súbita cardíaca .
La TVPC es causada por mutaciones genéticas que afectan a las proteínas que regulan las concentraciones de calcio dentro de las células del músculo cardíaco . El gen más comúnmente identificado es el RYR2 , que codifica una proteína incluida en un canal iónico conocido como receptor de rianodina ; este canal libera calcio del depósito interno de calcio de una célula, el retículo sarcoplásmico , durante cada latido del corazón.
La TVPC a menudo se diagnostica a partir de un ECG registrado durante una prueba de tolerancia al ejercicio , pero también se puede diagnosticar con una prueba genética . La afección se trata con medicamentos que incluyen bloqueadores de los receptores betaadrenérgicos o flecainida , o con procedimientos quirúrgicos que incluyen denervación simpática e implantación de un desfibrilador . Se cree que afecta a una de cada diez mil personas y se estima que causa el 15% de todas las muertes cardíacas súbitas inexplicables en los jóvenes. La condición se definió por primera vez en 1978, [5] y la genética subyacente se describió en 2001. [6]
Aunque las personas con TVPC pueden no experimentar ningún síntoma, los síntomas más comúnmente reportados son desmayos o pérdida repentina del conocimiento, lo que se conoce como síncope . [1] Estos apagones a menudo ocurren durante el ejercicio o como respuesta al estrés emocional, situaciones en las que se liberan dentro del cuerpo mensajeros químicos conocidos como catecolaminas , como la adrenalina . Los desmayos pueden malinterpretarse como causados por simples desmayos o epilepsia , lo que a menudo provoca retrasos en el diagnóstico correcto. [7] En un tercio de los afectados, la primera manifestación de la enfermedad puede ser un paro cardíaco, que puede provocar una muerte súbita. [8] Esto puede ocurrir en niños muy pequeños, presentándose como síndrome de muerte súbita del lactante o "muerte súbita". [1] Aproximadamente el 30% de las personas con TVPC tendrán un familiar que haya experimentado desmayos, convulsiones o muerte súbita en respuesta al ejercicio o al estrés. [7]
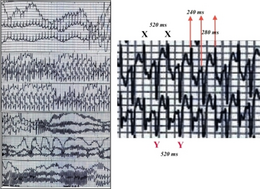
En personas con TVPC, la liberación de catecolaminas puede provocar un ritmo cardíaco anormal o arritmia conocida como taquicardia ventricular . [4] La taquicardia ventricular puede adoptar una forma característica conocida como taquicardia ventricular bidireccional. Esta forma de taquicardia ventricular ocurre con relativa poca frecuencia, pero si se observa sugiere un diagnóstico subyacente de TVPC o la afección relacionada, síndrome de Andersen-Tawil . [8] [9] Estas arritmias ventriculares en algunos casos terminan por sí solas, provocando un apagón del cual la persona luego se recupera. Sin embargo, si el ritmo cardíaco anormal continúa, puede degenerar en una arritmia más peligrosa conocida como fibrilación ventricular que causa un paro cardíaco y, si no se trata, la muerte súbita. [10]
Por lo general, hay muy pocos signos anormales en el examen clínico de personas con TVPC. Sin embargo, las personas con TVPC pueden desarrollar una alteración del ritmo cardíaco menos grave llamada fibrilación auricular , que puede detectarse en el examen como un pulso irregular. [8] Además, aproximadamente el 20% de las personas con TVPC tienen una frecuencia cardíaca en reposo lenta conocida como bradicardia sinusal . [4]
Las arritmias que experimentan las personas con TVPC son causadas por anomalías en la forma en que las células del músculo cardíaco controlan sus niveles de calcio . [11] El calcio interactúa con las fibras proteicas o miofibrillas dentro de la célula que permiten que la célula se contraiga, y la concentración de calcio dentro de cada célula debe regularse estrictamente. Durante cada latido del corazón, la concentración de calcio debe aumentar para permitir que el músculo se contraiga y luego disminuir para permitir que el músculo se relaje, proceso que se logra mediante el uso de un almacén dentro de la célula conocido como retículo sarcoplásmico . [12]

Al inicio de cada latido del corazón, el retículo sarcoplásmico libera calcio a través de canales especializados conocidos como receptores de rianodina . [12] Los receptores de rianodina se abren cuando aumenta la concentración de calcio cerca del canal. Esto sucede cuando, en respuesta a una señal eléctrica de la membrana celular llamada potencial de acción , una pequeña cantidad de calcio fluye a través de la membrana celular hacia la célula a través de canales de calcio tipo L , muchos de los cuales están ubicados en bolsas especializadas de la membrana. llamados túbulos T diseñados para acercar estos canales iónicos superficiales al retículo sarcoplásmico. [13]
El aumento en la concentración de calcio activa los receptores de rianodina en el retículo sarcoplásmico para liberar una bocanada de calcio conocida como chispa de calcio . Cada chispa desencadena la liberación de más chispas de los receptores de rianodina vecinos para crear un aumento organizado de calcio en toda la célula conocido como transitorio de calcio. Al final de cada latido del corazón, el calcio es bombeado de regreso por una proteína llamada SERCA junto con su proteína reguladora fosfolambán . Luego, el calcio se mantiene dentro del retículo sarcoplásmico mediante una proteína llamada calsecuestrina . [12]
Se puede lograr un ajuste fino de este proceso fosforilando estas proteínas. Por ejemplo, durante el ejercicio, las catecolaminas activan los adrenoceptores beta en la superficie celular, que activan la proteína quinasa A para fosforilar el canal de calcio tipo L, aumentando el flujo de calcio hacia la célula. Al mismo tiempo, la fosforilación de la proteína reguladora fosfolambán hace que se extraiga más calcio hacia el retículo sarcoplásmico. El efecto general de esto es generar un transitorio de calcio más grande con cada latido, lo que lleva a una contracción más fuerte. [13]
Las alteraciones de las proteínas implicadas en el acoplamiento excitación-contracción pueden alterar este proceso cuidadosamente regulado. En las personas con TVPC, la regulación normalmente estricta del calcio puede alterarse y provocar arritmias. [11] Si bien el calcio generalmente se libera desde el retículo sarcoplásmico en respuesta a un potencial de acción, las chispas de calcio también pueden ocurrir espontáneamente. En un corazón sano, una chispa espontánea de calcio es generalmente un evento aislado y no va más allá, pero si los receptores de rianodina o las proteínas que los regulan son anormales, estas chispas pueden desencadenar liberaciones de receptores de rianodina vecinos que se propagan por toda la célula como una onda de calcio. . [11] Es mucho más probable que estas ondas de calcio ocurran cuando las células del músculo cardíaco son estimuladas por catecolaminas como la adrenalina, que aumentan la concentración de calcio dentro del retículo sarcoplásmico y sensibilizan los receptores de rianodina. [14] La onda incontrolada de calcio puede ser expulsada a través de la membrana celular a través del intercambiador de sodio-calcio , provocando una corriente eléctrica conocida como posdespolarización retardada . Las posdespolarizaciones, si son lo suficientemente grandes, pueden desencadenar potenciales de acción adicionales, contracciones ventriculares prematuras o arritmias sostenidas. [15]
La TVPC puede ser causada por mutaciones en varios genes, todos los cuales son responsables de regular las concentraciones de calcio dentro de las células del músculo cardíaco. La mutación genética más comúnmente identificada en la TVPC es una mutación en el gen RYR2 que codifica el receptor cardíaco de rianodina, responsable de liberar calcio del retículo sarcoplásmico. [16] También se han identificado mutaciones asociadas con CPVT en el gen CASQ2 que codifica la calsequestrina, [17] una proteína que se une al calcio dentro del retículo sarcoplásmico. Otros genes asociados con formas más raras y atípicas de CPVT [16] incluyen TECRL que codifica la proteína similar a la Trans-2,3-enoil-CoA reductasa , CALM1 , CALM2 y CALM3 , todos codificando calmodulina, y TRDN que codifica triadina. [18]
Las mutaciones genéticas identificadas con mayor frecuencia en personas con TVPC ocurren en el gen RYR2 que codifica el receptor cardíaco de rianodina. [11] Las mutaciones en este gen conducen a una forma autosómica dominante de CPVT típica conocida como CPVT1. [16] Si bien el efecto preciso difiere entre mutaciones específicas en este gen, muchas mutaciones RYR2 hacen que el receptor de rianodina se abra en respuesta a concentraciones más bajas de calcio; el umbral para la liberación de calcio es más bajo. [11] Como resultado, el retículo sarcoplásmico libera calcio espontáneamente a través de estos receptores de rianodina anormales cuando aumenta la concentración de calcio dentro del retículo sarcoplásmico, un proceso conocido como liberación de calcio inducida por sobrecarga de almacenamiento. [10] El contenido de calcio del retículo sarcoplásmico aumenta en respuesta a la estimulación de las catecolaminas, lo que explica por qué las arritmias en personas con TVPC ocurren en momentos en que los niveles de catecolaminas están elevados. Algunos sugieren que el aumento de la sensibilidad al calcio se produce sólo cuando el receptor de rianodina es fosforilado por la proteína quinasa A, mientras que otros sugieren que el aumento de la sensibilidad también se produce en condiciones de reposo. [11]
Se han propuesto dos teorías sobre el mecanismo subyacente por el cual las mutaciones en RYR2 promueven la liberación de calcio inducida por sobrecarga de almacenamiento: descompresión de dominio y desunión de FKBP12.6 . [10] El descompresión del dominio se refiere a la separación de dos regiones importantes del receptor de rianodina, el extremo N y el dominio central. A través de este mecanismo, una mutación podría desestabilizar el estado cerrado del receptor de rianodina y aumentar su sensibilidad al calcio. [10] Un segundo mecanismo potencial implica la proteína reguladora FKBP12.6, una proteína que se une al receptor de rianodina y lo estabiliza. La unión de FKBP12.6 al receptor de rianodina está regulada por fosforilación. La fosforilación por la proteína quinasa A conduce a la disociación de FKBP12.6, lo que hace que el receptor de rianodina sea más sensible al calcio citosólico. Las mutaciones de RYR2 pueden interferir con la unión de FKB12.6 al receptor de rianodina y, por tanto, aumentar la sensibilidad al calcio. Es probable que FKBP12.6 desempeñe un papel en algunas mutaciones de CPVT pero no en otras. [10]
Las mutaciones de RYR2 responsables de la TVPC se encuentran principalmente en cuatro dominios principales del gen. [10] Las mutaciones que afectan a los dominios III y IV del gen (correspondientes a la región N-terminal de la proteína y al conector citosólico respectivamente) ocurren en el 46% de los casos. Se observan mutaciones con menos frecuencia que afectan a los dominios I y II, los cuales codifican secciones de la región N-terminal de la proteína. [10] Las mutaciones de RYR2 asociadas con la TVPC que ocurren fuera de estos cuatro dominios son muy raras y son responsables de tan solo el 10 % de los casos notificados. Las mutaciones de RYR2 suelen ser mutaciones sin sentido , como sustituciones de un solo nucleótido que provocan que un aminoácido sea reemplazado por otro, aunque se han descrito sustituciones y duplicaciones dentro del marco. No se han informado mutaciones sin sentido más dañinas en asociación con la TVPC, potencialmente porque estas variantes pueden conducir a diferentes enfermedades cardíacas como las miocardiopatías . [10]
Las mutaciones en el gen CASQ2 están asociadas con una forma autosómica recesiva de CPVT típica conocida como CPVT2. [16] Este gen codifica la calsequestrina, la principal proteína de unión al calcio y tampón de calcio dentro del retículo sarcoplásmico. [19] [20] Las mutaciones en CASQ2 representan solo del 3 al 5% de los casos de TVPC. [16] Se han identificado catorce mutaciones en CASQ2 en asociación con la TVPC. Dos de ellas son mutaciones sin sentido que hacen que la proteína sea anormalmente corta, y dos son mutaciones por deleción, mientras que diez son mutaciones sin sentido que sustituyen un aminoácido por otro en la cadena que forma la proteína. [11]
Las mutaciones en CASQ2 provocan una disminución de la capacidad amortiguadora de calcio del retículo sarcoplásmico. Esto significa que los cambios abruptos en el calcio total sarcoplásmico se amortiguarán menos y, por lo tanto, se traducirán en cambios mayores en el calcio libre. Los picos más altos de calcio libre tienen un mayor potencial para causar la liberación de calcio inducida por la sobrecarga almacenada desde el retículo sarcoplásmico, lo que lleva a posdespolarizaciones. [10]
Además de su función como tampón de calcio, la calsequestrina también regula la liberación de calcio del retículo sarcoplásmico mediante la modulación directa de los receptores de rianodina. Cuando la concentración de calcio es baja, los monómeros de calsequestrina forman un complejo con las proteínas triadina y junctina , que inhiben los receptores de rianodina. [19] Sin embargo, en altas concentraciones de calcio, la calsequestrina forma polímeros que se disocian del complejo del canal del receptor de rianodina, eliminando la respuesta inhibidora y aumentando la sensibilidad del receptor de rianodina para liberar calcio espontáneamente. [10]
La disminución de CASQ2 también se asocia con niveles elevados de calreticulina , una proteína que, entre otras funciones, regula la recaptación de calcio en el retículo sarcoplásmico por parte de SERCA. [21] En ausencia de CASQ2, los niveles de calreticulina aumentan y proporcionan cierta unión compensatoria de calcio dentro del retículo sarcoplásmico. Es posible que la calreticulina contribuya a la generación de arritmias observadas en asociación con mutaciones CASQ2. [21]
.jpg/440px-ECG000032_(CardioNetworks_ECGpedia).jpg)
La TVPC puede ser difícil de diagnosticar ya que la estructura del corazón parece normal en aquellos afectados por la afección cuando se evalúa mediante un ecocardiograma , una resonancia magnética cardíaca o una tomografía computarizada cardíaca , mientras que la función eléctrica del corazón también parece normal en reposo cuando se evalúa mediante un ECG estándar de 12 derivaciones . [1] [2] Sin embargo, en respuesta al ejercicio o a las catecolaminas como la adrenalina , se pueden observar ritmos cardíacos anormales como taquicardia ventricular bidireccional o latidos ectópicos ventriculares polimórficos frecuentes. [22]
El ECG de 12 derivaciones en reposo es una prueba útil para diferenciar la TVPC de otras enfermedades eléctricas del corazón que pueden causar ritmos cardíacos anormales similares. A diferencia de afecciones como el síndrome de QT largo y el síndrome de Brugada , el ECG de 12 derivaciones en reposo en personas con TVPC es generalmente normal. [8] Sin embargo, aproximadamente el 20% de los afectados tienen una frecuencia cardíaca lenta en reposo o bradicardia sinusal . [8]

La prueba de ejercicio , comúnmente realizada en una cinta rodante o en una bicicleta estática , puede ayudar a diagnosticar la TVPC. Durante la prueba, las personas con TVPC a menudo experimentan latidos ectópicos, que pueden progresar a taquicardia ventricular bidireccional y luego polimórfica a medida que aumenta la intensidad del ejercicio. [23] Es posible que algunas de las personas sospechosas de tener TVPC, como los niños pequeños, no puedan realizar una prueba de tolerancia al ejercicio. En estos casos, las formas alternativas de prueba incluyen la prueba de provocación de adrenalina, durante la cual se infunde adrenalina en una vena en dosis que aumentan gradualmente bajo estrecha supervisión y monitorización del ECG. [22] Además, se puede realizar una monitorización ECG Holter o a largo plazo , aunque es menos probable que esta forma de prueba detecte una arritmia. Los estudios electrofisiológicos invasivos no proporcionan información útil para ayudar a diagnosticar la TVPC o evaluar el riesgo de arritmias potencialmente mortales. [2] [22]
La TVPC también se puede diagnosticar mediante la identificación de una mutación que causa la enfermedad en un gen asociado con la TVPC mediante pruebas genéticas . [2] [22] Esta técnica puede ser la única manera de identificar la afección en alguien sospechoso de tener TVPC que ha fallecido y, en este caso, puede conocerse como autopsia molecular . [24]
Los tratamientos para la TVPC tienen como objetivo prevenir la aparición de ritmos cardíacos anormales letales y restaurar rápidamente un ritmo normal si ocurren. Como las arritmias en la TVPC generalmente ocurren en momentos en que el corazón está expuesto a altos niveles de adrenalina u otros mensajeros químicos similares (catecolaminas), muchos tratamientos para la TVPC tienen como objetivo reducir los niveles de catecolaminas a los que el corazón está expuesto o bloquear sus efectos sobre el sistema nervioso central. corazón. [8]
El tratamiento de primera línea para las personas con TVPC implica consejos sobre el estilo de vida. Esto incluye evitar deportes competitivos, ejercicios muy extenuantes y entornos muy estresantes, ya que en estos entornos pueden producirse altos niveles de adrenalina, lo que puede provocar arritmias. [2]
Varios medicamentos pueden ser útiles para las personas con TVPC. Los pilares del tratamiento son los betabloqueantes , que bloquean los efectos de la adrenalina y otras catecolaminas en el corazón, reduciendo la posibilidad de que se desarrollen ritmos cardíacos anormales. [2] De todos los betabloqueantes, se ha demostrado que el nadolol es el más eficaz para tratar la TVPC. [25] Este medicamento reduce la frecuencia cardíaca en mayor medida que otros betabloqueantes y solo debe tomarse una vez al día, lo que reduce el riesgo de omitir dosis. El nadolol puede ser difícil de obtener y no está disponible en todos los países, y un betabloqueante alternativo adecuado para su uso en la TVPC puede ser el propranolol , que sin embargo tiene un régimen de dosificación más complejo. [25] Datos publicados recientemente sugieren que el uso de betabloqueantes selectivos , como atenolol , bisoprolol o metoprolol , se asocia con tasas muy altas de fracaso del tratamiento. [25]
La flecainida es un fármaco antiarrítmico de clase 1c que se recomienda para personas con TVPC que experimentan ritmos cardíacos anormales a pesar de tomar un betabloqueante. [2] La flecainida reduce el riesgo de arritmias en personas con TVPC, pero sigue siendo incierto cómo la flecainida logra esto. Algunos han sugerido que la flecainida interactúa directamente con el receptor cardíaco de rianodina, que con frecuencia es anormal en personas con TVPC, mientras que otros sugieren que los efectos antiarrítmicos de la flecainida dependen completamente de sus efectos bloqueantes de los canales de sodio . [26]
El verapamilo es un antagonista de los canales de calcio que, cuando se combina con un bloqueador beta, puede reducir el riesgo de arritmias en pacientes con TVPC. [27] La propafenona es otro antiarrítmico que puede reducir el riesgo de arritmias, potencialmente a través de efectos directos sobre el receptor de rianodina. [26]
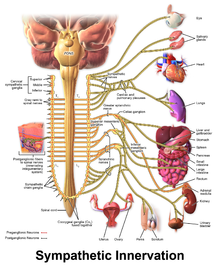
Algunas personas con TVPC continúan experimentando arritmias potencialmente mortales a pesar del tratamiento farmacéutico. En este caso, se puede utilizar un procedimiento quirúrgico para afectar los nervios que irrigan el corazón y que se comunican mediante catecolaminas. [2] Un conjunto de nervios conocido como sistema nervioso simpático irriga el corazón y otros órganos. Estos nervios, cuando se activan, estimulan al corazón a latir más fuerte y más rápido. [28] El sistema nervioso simpático utiliza noradrenalina , una catecolamina, como mensajero químico o neurotransmisor , que puede promover arritmias en personas con TVPC. [2]
Para evitar esto, se puede dañar intencionalmente una región del sistema nervioso simpático en una operación conocida como denervación simpática cardíaca o simpatectomía. [29] Si bien el sistema nervioso simpático alimenta el corazón desde ambos lados, a menudo solo los nervios del lado izquierdo son el objetivo durante la simpatectomía, aunque puede ser necesaria la destrucción de los nervios de ambos lados. [29] A través de este proceso, la simpatectomía es eficaz para disminuir, pero no eliminar, el riesgo de sufrir más arritmias potencialmente mortales. [4]

Si bien los medicamentos y la simpatectomía tienen como objetivo prevenir que se produzcan ritmos cardíacos anormales en primer lugar, se puede usar un desfibrilador implantable (DAI) para tratar arritmias que los medicamentos no han logrado prevenir y restaurar un ritmo cardíaco normal. [2] Estos dispositivos, generalmente implantados debajo de la piel en la parte frontal del pecho debajo del hombro, pueden monitorear continuamente el corazón para detectar ritmos cardíacos anormales. Si se detecta una arritmia potencialmente mortal, el dispositivo puede administrar una pequeña descarga eléctrica para detener el ritmo anormal y reiniciar el corazón. [1]
Los desfibriladores implantables a menudo se recomiendan para personas con TVPC que han experimentado desmayos, arritmias ventriculares o paro cardíaco a pesar de tomar la medicación adecuada. [2] Estos dispositivos salvan vidas, ya que se ha demostrado que su uso confiere un beneficio de supervivencia significativo en pacientes con TVPC. [25] Se ha sugerido que el aumento resultante de adrenalina causado por el dolor de una descarga eléctrica del dispositivo podría, en teoría, provocar un ciclo de arritmias y descargas recurrentes conocido como tormenta eléctrica, [4] y, por lo tanto, se recomienda encarecidamente que aquellos con un DAI implantado para CPVT tomen un bloqueador beta para amortiguar los efectos de la adrenalina. [4]
Una proporción significativa de personas con TVPC experimentarán un ritmo cardíaco anormal potencialmente mortal, con estimaciones de este riesgo que oscilan entre el 13 y el 20 % en el transcurso de 7 a 8 años. [3] Es más probable que se produzcan arritmias potencialmente mortales si la TVPC se ha diagnosticado en la infancia, si una persona con TVPC no toma betabloqueantes y si se producen arritmias en las pruebas de esfuerzo a pesar de tomar betabloqueantes. [2]
Durante el tratamiento con nadolol , el betabloqueante preferido para el tratamiento de la TVPC, se ha estimado que las tasas de eventos son del 0,8% por año. En pacientes tratados con betabloqueantes, las arritmias potencialmente mortales son más probables si una persona ya había sobrevivido a un paro cardíaco , tuvo un síncope o es portador de mutaciones que causan enfermedades que afectan la porción terminal altamente conservada del gen RYR2 , [25] llamada el dominio C-terminal (aminoácidos 4889–4969). [30]
Se estima que la CPVT afecta a 1 de cada 10.000 personas. [4] Los síntomas de la TVPC generalmente se observan por primera vez en la primera o segunda década de la vida, [25] y más del 60 % de las personas afectadas experimentan su primer episodio de síncope o paro cardíaco a los 20 años. [1] Síncope durante el ejercicio o Las emociones fuertes deben considerarse una señal de alerta, [25] ya que es una característica de la enfermedad. Por último, un pequeño número de pacientes puede presentarse más adelante en la vida, y las pruebas genéticas en estos pacientes con frecuencia no logran identificar un gen causante. [4]
En 1960, el cardiólogo noruego Knut Berg publicó un informe sobre tres hermanas que sufrían desmayos durante el ejercicio o estrés emocional en lo que ahora se reconoce como la primera descripción de CPVT. [8] La taquicardia ventricular bidireccional asociada con esta afección se describió en 1975. [1] El término "taquicardia ventricular polimórfica catecolaminérgica" se utilizó por primera vez en 1978. [5] En 1999, se localizó la primera mutación genética que causó la TVPC identificada al cromosoma 1q42-q43, [31] que se descubrió que era una variante en el gen RYR2 en 2001. [6] Las investigaciones en curso tienen como objetivo identificar mejores tratamientos para la TVPC, aumentar la comprensión de los mecanismos de la arritmia e identificar otros genes. causando la condición. [32]