QPNC-PAGE , o electroforesis en gel de poliacrilamida continua nativa preparativa cuantitativa , es una técnica de electroforesis bioanalítica , unidimensional , de alta resolución y alta precisión aplicada en bioquímica y química bioinorgánica para separar cuantitativamente proteínas por punto isoeléctrico y por elución continua de una columna de gel . [1]
Los biólogos utilizan esta variante híbrida de electroforesis en gel analítica nativa y electroforesis en gel de poliacrilamida preparativa para resolver concentraciones bajas de macromoléculas con alta recuperación, por ejemplo, en metaloproteínas activas o nativas en muestras biológicas o en proteínas que contienen cofactores metálicos plegadas de manera correcta e incorrecta en mezclas complejas de proteínas . [2]
Las proteínas desempeñan varias funciones en los organismos vivos , incluidas las reacciones catalíticas y el transporte de moléculas o iones dentro de las células , los órganos o el cuerpo entero . La comprensión de los procesos en los organismos humanos, que son impulsados principalmente por reacciones bioquímicas e interacciones proteína-proteína , depende en gran medida de la capacidad de aislar proteínas activas en muestras biológicas para un examen más detallado de la estructura química y la función fisiológica . Esta información esencial puede suponer una indicación importante del estado de salud de un paciente. [3]
Como alrededor del 30-40% de todas las proteínas conocidas contienen uno o más cofactores de iones metálicos (p. ej., ceruloplasmina , ferritina , proteína precursora beta amiloide , metaloproteinasa de matriz o metalochaperonas ), especialmente las metaloproteínas nativas y desnaturalizadas deben aislarse, identificarse y cuantificarse después de una biopsia líquida . Muchos de estos cofactores (p. ej., hierro , cobre o zinc ) desempeñan un papel clave en procesos catalíticos enzimáticos vitales o estabilizan las moléculas de proteínas globulares . [4] Por lo tanto, la electroforesis en gel de alta precisión y las técnicas de separación comparables son muy relevantes como paso inicial del análisis de especiación de proteínas y metales traza , posteriormente, seguido de métodos modernos de espectrometría de masas y resonancia magnética para cuantificar e identificar las proteínas solubles de interés. [5]

En la electroforesis en gel, las proteínas normalmente se separan por carga , tamaño o forma . [7] El objetivo del enfoque isoeléctrico (IEF), por ejemplo, es separar las proteínas según su punto isoeléctrico (pI), es decir, según su carga a diferentes valores de pH . [8] Aquí, se logra un mecanismo similar en una cámara de electroforesis disponible comercialmente para separar biomoléculas cargadas , por ejemplo, superóxido dismutasa (SOD) [9] o alérgenos , [10] en condiciones de pH constante y diferentes velocidades de migración dependiendo de diferentes puntos isoeléctricos de zwitteriones . Las proteínas separadas (metálicas) eluyen secuencialmente, comenzando con el pI más bajo (pI > 2–4) y terminando con el pI más alto (pI < 10,0) de las moléculas de proteína disueltas que se van a analizar. [11]
Debido a las propiedades específicas del gel preparado y la solución tampón de electroforesis , que es básica y contiene Tris - HCl y NaN 3 , [6] la mayoría de las proteínas de un sistema biológico (por ejemplo, Helicobacter pylori [12] ) están cargadas negativamente en la solución y migrarán del cátodo al ánodo debido al campo eléctrico . En general, la ecuación de reacción (1) muestra que el grupo lateral carboxilo de un aminoácido proteinogénico está cargado negativamente, la ecuación (2) que los grupos laterales amino son eléctricamente neutros en estas condiciones:
(1) R-COOH + OH − → R-COO − + H 2 O
(2) R-NH3 + + OH− → R - NH2 + H2O
En el ánodo, los iones de hidrógeno generados electroquímicamente reaccionan con las moléculas de Tris para formar iones de Tris monovalentes (3). Los iones de Tris con carga positiva migran a través del gel hasta el cátodo, donde neutralizan los iones de hidróxido para formar moléculas de Tris y agua (4):
(3) (HOCH 2 ) 3 CNH 2 + H + → [(HOCH 2 ) 3 CNH 3 ] +
(4) [(HOCH 2 ) 3 CNH 3 ] + + OH − → (HOCH 2 ) 3 CNH 2 + H 2 O
Por lo tanto, el mecanismo de amortiguación basado en Tris provoca un pH constante en el sistema de amortiguación continuo con una alta capacidad de amortiguación . [13]
A 25 °C, el tampón Tris tiene un rango de pH efectivo entre 7,5 y 9,0. En las condiciones que se indican aquí (que abordan la concentración de los componentes del tampón, el mecanismo de tamponamiento, el pH y la temperatura), el pH efectivo varía en el rango de aproximadamente 10,0 a 10,5. Todos los sistemas de tampón nativos tienen baja conductividad y un rango de pH de 3,8 a 10,2. Por lo tanto, los sistemas de tampón nativos continuos se utilizan para separar las proteínas según su pI. [14]
Aunque el valor de pH (10,00) del tampón de electroforesis no corresponde a un valor de pH fisiológico dentro de una célula o tipo de tejido , las bandas de proteína en forma de anillo separadas se eluyen continuamente en una solución tampón fisiológica (pH 8,00) y se aíslan en diferentes fracciones . [6] Siempre que no se pueda demostrar una desnaturalización irreversible mediante un procedimiento independiente, la mayoría de las moléculas de proteína son estables en solución acuosa , a valores de pH de 3 a 10 si la temperatura es inferior a 50 °C. [15] Como el calor Joule y la temperatura generados durante la electroforesis pueden superar los 50 °C, [16] y, por lo tanto, tener un impacto negativo en la estabilidad y el comportamiento de migración de las proteínas en el gel, el sistema de separación, que consiste en la cámara de electroforesis, el colector de fracciones y otros dispositivos, se enfría en un refrigerador a 4 °C, reduciendo así en gran medida el riesgo de corrientes de convección de calor. [17] El sobrecalentamiento del gel se evita mediante un circuito de enfriamiento interno de la columna de gel como parte integrada de la cámara de electroforesis y mediante la generación de una energía constante mediante la fuente de alimentación. [18]
Las mejores condiciones de polimerización para geles de acrilamida se obtienen a 25-30 °C [19] y la polimerización parece terminar después de 20-30 min de reacción aunque se detectan monómeros residuales (10-30%) después de este tiempo. [20] La copolimerización del monómero de acrilamida (AA)/ reticulante N,N'-Metilenobisacrilamida (Bis-AA) iniciada por reacciones de persulfato de amonio (APS)/ tetrametiletilendiamina (TEMED), es más eficiente a pH alcalino de la solución de acrilamida. De este modo, se crean y reticulan cadenas de acrilamida a la vez. Debido a las propiedades del tampón de electroforesis, la polimerización en gel se lleva a cabo a pH 10,00 asegurando un uso eficiente de TEMED y APS como catalizadores de la reacción de polimerización y, al mismo tiempo, suprimiendo una hidrólisis competitiva de la red de polímero de acrilamida producida . Las redes de polímeros son cadenas de polímeros unidas tridimensionalmente . De lo contrario, las proteínas podrían modificarse mediante la reacción con monómeros no polimerizados de acrilamida, formando productos de aducción de acrilamida covalente que pueden dar lugar a múltiples bandas. [21]
Además, el tiempo de polimerización de un gel puede afectar directamente los tiempos de elución pico de las metaloproteínas separadas en el electroferograma debido a la compresión y dilatación de los geles y sus poros si los tiempos de incubación de la mezcla de reacción (solución de gel) utilizada para preparar un gel no están optimizados. Para asegurar la máxima reproducibilidad en el tamaño de poro del gel y obtener un gel de poro grande completamente polimerizado y no restrictivo para una corrida de PAGE, el gel de poliacrilamida se polimeriza durante un período de tiempo de 69 horas a temperatura ambiente (RT) en una columna de gel ubicada en el soporte de colada. [18] El calor exotérmico generado por los procesos de polimerización se disipa constantemente mientras que la temperatura puede aumentar rápidamente a más de 75 °C en los primeros minutos, después de lo cual cae lentamente. [22] Después de 69 horas, el gel ha alcanzado la temperatura ambiente y está en su estado de energía más bajo , ya que las reacciones químicas básicas y la gelificación están completas. [18] La gelificación significa que el disolvente (agua) se inmoviliza dentro de la red de polímero por medio de enlaces de hidrógeno y también fuerzas de van der Waals . Como resultado, el gel preparado es homogéneo (en términos de distribución homogénea de enlaces cruzados en toda la muestra de gel [23] ), inherentemente estable y libre de monómeros o radicales . Los geles de poliacrilamida frescos son además hidrófilos , eléctricamente neutros y no se unen a las proteínas. [24] Los efectos de tamizado debido a la compresión inducida por la gravedad del gel se pueden excluir por las mismas razones. Por lo tanto, en un medio sin propiedades de tamizado molecular se puede esperar una alta resolución. [25]
Antes de iniciar una corrida electroforética, el gel preparado con 4% T (contenido total de polímero (T)), 2.67% C (concentración de reticulante (C)) se pre-corre para equilibrarlo . [6] Es esencialmente no tamizado y óptimo para la electroforesis de proteínas mayores o iguales a 200 k u . Las proteínas migran en él más o menos sobre la base de su libre movilidad. [26] Por estas razones, las interacciones del gel con las biomoléculas son despreciablemente bajas y, por lo tanto, las proteínas se separan de manera limpia y predecible en un tiempo de polimerización de 69 h. Las metaloproteínas separadas , incluidas las biomoléculas que van desde aproximadamente < 1 ku a más de 30 ku (por ejemplo, chaperonas metálicas , priones , proteínas de transporte de metales , amiloides , metaloenzimas , metalopéptidos , metalotioneína , fitoquelatinas ) no se disocian en apoproteínas y cofactores metálicos. [27]
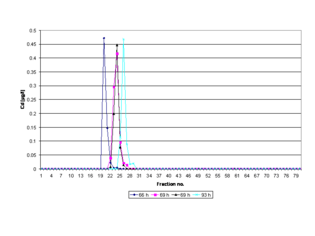
Las estructuras bioactivas (conformación o forma nativa o 3D) de las moléculas de proteína aisladas no sufren ningún cambio conformacional significativo . Por lo tanto, las proteínas que contienen cofactores metálicos activos se pueden aislar de forma reproducible en las mismas fracciones después de una ejecución de PAGE. [11] Un pico cambiante en el electroferograma respectivo indica que el tiempo estandarizado de polimerización en gel (69 h, RT) no se implementa en un experimento de PAGE . Una desviación menor del tiempo de polimerización estandarizado (< 69 h) representa una polimerización incompleta y, por lo tanto, una inestabilidad inherente debido al ablandamiento del gel durante la reticulación de polímeros a medida que el material alcanza el equilibrio de hinchamiento, [28] mientras que exceder este límite de tiempo (> 69 h) es un indicador de envejecimiento del gel. [29] El fenómeno del envejecimiento del gel está estrechamente relacionado con la disminución de la viscosidad a largo plazo de las soluciones acuosas de poliacrilamida [30] y el aumento del hinchamiento de los hidrogeles. [31]
En condiciones estándar, se han recuperado metaloproteínas con diferentes rangos de masa molecular y puntos isoeléctricos en forma biológicamente activa con un rendimiento cuantitativo de más del 95%. [18] Mediante SDS-PAGE preparativo, se pueden recuperar proteínas estándar ( citocromo c , aldolasa , ovoalbúmina y albúmina de suero bovino ) con masas moleculares de 14-66 ku con un rendimiento promedio de aproximadamente el 73,6%. [32] La isotacoforesis preparativa (ITP) se aplica para aislar proteínas que contienen paladio con masas moleculares de 362 ku (recuperación: 67%) y 158 ku (recuperación: 97%). [33]
Las concentraciones fisiológicas ( rango de ppb ) de Fe, Cu, Zn, Ni , Mo , Pd, Co , Mn , Pt , Cr , Cd y otros cofactores metálicos se pueden identificar y cuantificar absolutamente en una alícuota de una fracción mediante espectrometría de masas de plasma acoplado inductivamente (ICP-MS) [34] o fluorescencia de rayos X de reflexión total (TXRF), [35] por ejemplo. En el caso de ICP-MS, la información estructural de las metalobiomoléculas asociadas se pierde irreversiblemente debido a la ionización de la muestra con plasma . [36] [37] Otro método de detección de alta sensibilidad establecido para la determinación de oligoelementos en muestras biológicas es la espectrometría de absorción atómica en horno de grafito (GF-AAS). [38] Debido a la alta pureza y concentración optimizada de las metaloproteínas separadas , por ejemplo, productos farmacéuticos terapéuticos recombinantes hechos a partir de plantas como la chaperona de cobre para la superóxido dismutasa (CCS) de plantas medicinales , en unas pocas fracciones PAGE específicas, las estructuras relacionadas de estos analitos bioactivos se pueden dilucidar cuantitativamente mediante el uso de espectroscopia de RMN en solución en condiciones no desnaturalizantes. [39]
Las proteínas metálicas mal plegadas, por ejemplo, CCS o Cu-Zn-superóxido dismutasa (SOD1) presentes en el cerebro , la sangre u otras muestras clínicas, son indicativas de enfermedades neurodegenerativas como la enfermedad de Alzheimer (EA) o la esclerosis lateral amiotrófica (ELA). [40] Las moléculas activas de CCS o SOD contribuyen al control homeostático intracelular de especies de iones metálicos esenciales (por ejemplo, Cu 1+/2+ , Zn 2+ , Fe 2+/3+ , Mn 2+ , Ni 3+ ) en organismos y, por lo tanto, estas biomoléculas pueden equilibrar los procesos prooxidativos y antioxidantes en el citoplasma . [41] De lo contrario, los iones metálicos de transición libres o débilmente unidos participan en reacciones similares a Fenton en las que se forman radicales hidroxilo perjudiciales , que sin restricciones serían destructivos para las proteínas. [42] La pérdida de CCS activa aumenta la producción de amiloide-β en las neuronas , lo que, a su vez, es un sello patológico importante de la EA. [43] Por lo tanto, se propone que la chaperona de cobre para la superóxido dismutasa sea uno de los biomarcadores más prometedores de la toxicidad del Cu en estas enfermedades. [44] La CCS debe analizarse principalmente en sangre porque un metanálisis de datos séricos mostró que los pacientes con EA tienen niveles más altos de Cu sérico que los controles sanos . [45]
QPNC-PAGE, originalmente 'PNC-PAGE', [46] fue inventado y desarrollado en Alemania a fines de la década de 1990 y estuvo significativamente influenciado por el trabajo pionero de David E. Garfin. [47]
{{cite web}}: CS1 maint: nombres múltiples: lista de autores ( enlace ) CS1 maint: nombres numéricos: lista de autores ( enlace )