El hidróxido es un anión diatómico con fórmula química OH − . Consiste en un átomo de oxígeno e hidrógeno unidos por un enlace covalente simple y lleva una carga eléctrica negativa . Es un componente importante pero generalmente menor del agua . Funciona como base , ligando , nucleófilo y catalizador . El ion hidróxido forma sales , algunas de las cuales se disocian en solución acuosa, liberando iones hidróxido solvatados. El hidróxido de sodio es un producto químico de varios millones de toneladas por año . El compuesto eléctricamente neutro correspondiente HO • es el radical hidroxilo . El grupo –OH de átomos unido covalentemente correspondiente es el grupo hidroxi . Tanto el ion hidróxido como el grupo hidroxi son nucleófilos y pueden actuar como catalizadores en química orgánica .
Muchas sustancias inorgánicas que llevan la palabra hidróxido en sus nombres no son compuestos iónicos del ion hidróxido, sino compuestos covalentes que contienen grupos hidroxi .
El ion hidróxido se produce naturalmente a partir del agua mediante la reacción de autoionización : [1]
La constante de equilibrio para esta reacción, definida como
tiene un valor cercano a 10 −14 a 25 °C, por lo que la concentración de iones hidróxido en agua pura es cercana a 10 −7 mol∙dm −3 , para satisfacer la restricción de carga igual. El pH de una solución es igual al cologaritmo decimal de la concentración de cationes hidrógeno ; [nota 2] el pH del agua pura es cercano a 7 a temperatura ambiente. La concentración de iones hidróxido se puede expresar en términos de pOH , que es cercano a (14 − pH), [nota 3] por lo que el pOH del agua pura también es cercano a 7. La adición de una base al agua reducirá la concentración de cationes hidrógeno y, por lo tanto, aumentará la concentración de iones hidróxido (disminuirá el pH, aumentará el pOH) incluso si la base en sí no contiene hidróxido. Por ejemplo, las soluciones de amoníaco tienen un pH mayor que 7 debido a la reacción NH 3 + H + ⇌ NH+
4, lo que disminuye la concentración de cationes hidrógeno, lo que aumenta la concentración de iones hidróxido. El pOH se puede mantener en un valor casi constante con varias soluciones tampón .

En una solución acuosa [3] el ion hidróxido es una base en el sentido de Brønsted-Lowry , ya que puede aceptar un protón [nota 4] de un ácido de Brønsted-Lowry para formar una molécula de agua. También puede actuar como una base de Lewis donando un par de electrones a un ácido de Lewis. En solución acuosa, tanto los iones de hidrógeno como los de hidróxido están fuertemente solvatados, con enlaces de hidrógeno entre los átomos de oxígeno e hidrógeno. De hecho, el ion bihidróxido H
3Oh−
2Se ha caracterizado en estado sólido. Este compuesto es centrosimétrico y tiene un enlace de hidrógeno muy corto (114,5 pm ) que es similar a la longitud del ion bifluoruro HF−
2(114 pm). [2] En solución acuosa, el ion hidróxido forma fuertes enlaces de hidrógeno con las moléculas de agua. Una consecuencia de esto es que las soluciones concentradas de hidróxido de sodio tienen una alta viscosidad debido a la formación de una red extendida de enlaces de hidrógeno como en las soluciones de fluoruro de hidrógeno .
En solución, expuesto al aire, el ion hidróxido reacciona rápidamente con el dióxido de carbono atmosférico , actuando como un ácido, para formar, inicialmente, el ion bicarbonato .
La constante de equilibrio para esta reacción se puede especificar como una reacción con dióxido de carbono disuelto o como una reacción con dióxido de carbono gaseoso (consulte Ácido carbónico para conocer los valores y los detalles). A pH neutro o ácido, la reacción es lenta, pero está catalizada por la enzima anhidrasa carbónica , que crea iones hidróxido en el sitio activo.
Las soluciones que contienen iones hidróxido atacan el vidrio . En este caso, los silicatos del vidrio actúan como ácidos. Los hidróxidos básicos, ya sean sólidos o en solución, se almacenan en recipientes de plástico herméticos .
El ion hidróxido puede funcionar como un ligando donante de pares de electrones típico , formando complejos como tetrahidroxoaluminato/tetrahidroxidoaluminato [ Al(OH) 4 ] − . También se encuentra a menudo en complejos de ligando mixto del tipo [ML x (OH) y ] z + , donde L es un ligando. El ion hidróxido a menudo sirve como un ligando puente , donando un par de electrones a cada uno de los átomos que se están puenteando. Como lo ilustra [Pb 2 (OH)] 3+ , los hidróxidos metálicos a menudo se escriben en un formato simplificado. Incluso puede actuar como un donante de 3 pares de electrones, como en el tetrámero [PtMe 3 (OH)] 4 . [4]
Cuando se unen a un centro metálico que atrae fuertemente electrones, los ligandos de hidróxido tienden a ionizarse en ligandos de óxido. Por ejemplo, el ion bicromato [HCrO 4 ] − se disocia de acuerdo con
con un p K a de aproximadamente 5,9. [5]
Los espectros infrarrojos de compuestos que contienen el grupo funcional OH tienen fuertes bandas de absorción en la región centrada alrededor de 3500 cm −1 . [6] La alta frecuencia de vibración molecular es una consecuencia de la pequeña masa del átomo de hidrógeno en comparación con la masa del átomo de oxígeno, y esto hace que la detección de grupos hidroxilo por espectroscopia infrarroja sea relativamente fácil. Una banda debido a un grupo OH tiende a ser nítida. Sin embargo, el ancho de banda aumenta cuando el grupo OH está involucrado en el enlace de hidrógeno. Una molécula de agua tiene un modo de flexión HOH a aproximadamente 1600 cm −1 , por lo que la ausencia de esta banda se puede utilizar para distinguir un grupo OH de una molécula de agua.
Cuando el grupo OH está unido a un ion metálico en un complejo de coordinación , se puede observar un modo de flexión M−OH. Por ejemplo, en [Sn(OH) 6 ] 2− ocurre a 1065 cm −1 . El modo de flexión para un hidróxido puente tiende a estar a una frecuencia más baja como en [( bipiridina )Cu(OH) 2 Cu( bipiridina )] 2+ (955 cm −1 ). [7] Las vibraciones de estiramiento M−OH ocurren por debajo de aproximadamente 600 cm −1 . Por ejemplo, el ion tetraédrico [Zn(OH) 4 ] 2− tiene bandas a 470 cm −1 ( Raman -activo, polarizado) y 420 cm −1 (infrarrojo). El mismo ion tiene una vibración de flexión (HO)–Zn–(OH) a 300 cm −1 . [8]
Las soluciones de hidróxido de sodio , también conocidas como lejía y soda cáustica, se utilizan en la fabricación de pulpa y papel , textiles , agua potable , jabones y detergentes , y como limpiador de desagües . La producción mundial en 2004 fue de aproximadamente 60 millones de toneladas . [9] El principal método de fabricación es el proceso cloro-álcali .
Las soluciones que contienen el ion hidróxido se generan cuando se disuelve una sal de un ácido débil en agua. El carbonato de sodio se utiliza como álcali, por ejemplo, en virtud de la reacción de hidrólisis .
Aunque la concentración base de las soluciones de carbonato de sodio es menor que la de una solución concentrada de hidróxido de sodio, tiene la ventaja de ser un sólido. También se fabrica a gran escala (42 millones de toneladas en 2005) mediante el proceso Solvay . [10] Un ejemplo del uso del carbonato de sodio como álcali es cuando la sosa de lavado (otro nombre para el carbonato de sodio) actúa sobre ésteres insolubles, como los triglicéridos , comúnmente conocidos como grasas, para hidrolizarlos y hacerlos solubles.
La bauxita , un hidróxido básico de aluminio , es el principal mineral a partir del cual se fabrica el metal. [11] De manera similar, la goethita (α-FeO(OH)) y la lepidocrocita (γ-FeO(OH)), hidróxidos básicos de hierro , se encuentran entre los principales minerales utilizados para la fabricación de hierro metálico. [12]
Además de NaOH y KOH, que tienen aplicaciones a gran escala, los hidróxidos de otros metales alcalinos también son útiles. El hidróxido de litio es una base fuerte, con un p K b de −0,36. [13] El hidróxido de litio se utiliza en sistemas de purificación de gases respirables para naves espaciales , submarinos y rebreathers para eliminar el dióxido de carbono del gas exhalado. [14]
El hidróxido de litio se prefiere al de sodio debido a su menor masa. El hidróxido de sodio , el hidróxido de potasio y los hidróxidos de otros metales alcalinos también son bases fuertes . [15]


El hidróxido de berilio Be(OH) 2 es anfótero . [16] El hidróxido en sí es insoluble en agua, con un producto de solubilidad log K * sp de −11,7. La adición de ácido produce productos de hidrólisis solubles , incluido el ion trimérico [Be 3 (OH) 3 (H 2 O) 6 ] 3+ , que tiene grupos OH que forman puentes entre pares de iones de berilio y forman un anillo de 6 miembros. [17] A pH muy bajo, se forma el ion de agua [Be(H 2 O) 4 ] 2+ . La adición de hidróxido a Be(OH) 2 produce el anión tetrahidroxoberilato o tetrahidroxiberilato soluble , [Be(OH) 4 ] 2− .
La solubilidad en agua de los demás hidróxidos de este grupo aumenta con el aumento del número atómico . [18] El hidróxido de magnesio Mg(OH) 2 es una base fuerte (hasta el límite de su solubilidad, que es muy baja en agua pura), al igual que los hidróxidos de los alcalinotérreos más pesados: hidróxido de calcio , hidróxido de estroncio e hidróxido de bario . Una solución o suspensión de hidróxido de calcio se conoce como agua de cal y se puede utilizar para probar el ácido débil dióxido de carbono. La reacción Ca(OH) 2 + CO 2 ⇌ Ca 2+ + HCO−
3+ OH − ilustra la basicidad del hidróxido de calcio. La cal sodada , que es una mezcla de bases fuertes NaOH y KOH con Ca(OH) 2 , se utiliza como absorbente de CO 2 .
El hidróxido de boro más simple, B(OH) 3 , conocido como ácido bórico , es un ácido. A diferencia de los hidróxidos de los álcalis y de los hidróxidos alcalinotérreos, no se disocia en solución acuosa. En cambio, reacciona con las moléculas de agua actuando como un ácido de Lewis, liberando protones.
Se conocen diversos oxianiones de boro que, en forma protonada, contienen grupos hidróxido. [19]
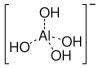
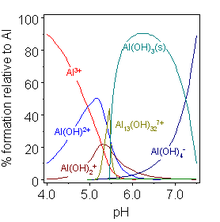
El hidróxido de aluminio Al(OH) 3 es anfótero y se disuelve en solución alcalina. [16]
En el proceso Bayer [20] para la producción de óxido de aluminio puro a partir de minerales de bauxita , este equilibrio se manipula mediante un control cuidadoso de la temperatura y la concentración de álcali. En la primera fase, el aluminio se disuelve en una solución alcalina caliente como Al(OH)−
4, pero otros hidróxidos habitualmente presentes en el mineral, como los hidróxidos de hierro, no se disuelven porque no son anfóteros. Tras la eliminación de los insolubles, el llamado lodo rojo , se hace precipitar el hidróxido de aluminio puro reduciendo la temperatura y añadiendo agua al extracto, que, al diluir el álcali, baja el pH de la solución. El hidróxido de aluminio básico AlO(OH), que puede estar presente en la bauxita, también es anfótero.
En soluciones ligeramente ácidas, los complejos hidroxo/hidroxi formados por aluminio son algo diferentes de los del boro, lo que refleja el mayor tamaño de Al(III) frente a B(III). La concentración de la especie [Al 13 (OH) 32 ] 7+ depende en gran medida de la concentración total de aluminio. Se encuentran otros complejos hidroxo en compuestos cristalinos. Quizás el más importante sea el hidróxido básico AlO(OH), un material polimérico conocido por los nombres de las formas minerales boehmita o diáspora , dependiendo de la estructura cristalina. El hidróxido de galio , [16] el hidróxido de indio y el hidróxido de talio(III) también son anfóteros. El hidróxido de talio(I) es una base fuerte. [21]
El carbono no forma hidróxidos simples. El compuesto hipotético C(OH) 4 ( ácido ortocarbónico o metanetetrol) es inestable en solución acuosa: [22]
El dióxido de carbono también se conoce como anhídrido carbónico, lo que significa que se forma por deshidratación del ácido carbónico H 2 CO 3 (OC(OH) 2 ). [23]
Ácido silícico es el nombre dado a una variedad de compuestos con una fórmula genérica [SiO x (OH) 4−2 x ] n . [24] [25] El ácido ortosilícico se ha identificado en solución acuosa muy diluida. Es un ácido débil con p K a1 = 9,84, p K a2 = 13,2 a 25 °C. Generalmente se escribe como H 4 SiO 4 , pero la fórmula Si(OH) 4 es generalmente aceptada. [5] [ dudoso – discutir ] Se han caracterizado otros ácidos silícicos como el ácido metasilícico (H 2 SiO 3 ), el ácido disilícico (H 2 Si 2 O 5 ) y el ácido pirosilícico (H 6 Si 2 O 7 ). Estos ácidos también tienen grupos hidróxido unidos al silicio; las fórmulas sugieren que estos ácidos son formas protonadas de polioxianiones .
Se han caracterizado pocos complejos hidroxo de germanio . El hidróxido de estaño (II) Sn(OH) 2 se preparó en un medio anhidro. Cuando el óxido de estaño (II) se trata con álcali, se obtiene el complejo hidroxo piramidal Sn(OH)−
3se forma. Cuando se acidifican las soluciones que contienen este ion, se forma el ion [Sn 3 (OH) 4 ] 2+ junto con algunos complejos hidroxo básicos. La estructura de [Sn 3 (OH) 4 ] 2+ tiene un triángulo de átomos de estaño conectados por grupos hidróxido puente. [26] El hidróxido de estaño (IV) es desconocido, pero puede considerarse como el ácido hipotético del que se derivan los estannatos, con una fórmula [Sn(OH) 6 ] 2− , por reacción con el ion hidróxido básico (de Lewis). [27]
La hidrólisis de Pb 2+ en solución acuosa se acompaña de la formación de varios complejos que contienen hidroxo, algunos de los cuales son insolubles. El complejo hidroxo básico [Pb 6 O(OH) 6 ] 4+ es un grupo de seis centros de plomo con enlaces metal-metal que rodean un ion óxido central. Los seis grupos hidróxido se encuentran en las caras de los dos tetraedros externos de Pb 4 . En soluciones fuertemente alcalinas se forman iones plumbato solubles, incluido [Pb(OH) 6 ] 2− . [28]
En los estados de oxidación superiores de los pnicógenos , calcógenos , halógenos y gases nobles hay oxoácidos en los que el átomo central está unido a iones óxido e iones hidróxido. Los ejemplos incluyen ácido fosfórico H 3 PO 4 y ácido sulfúrico H 2 SO 4. En estos compuestos, uno o más grupos hidróxido pueden disociarse con la liberación de cationes hidrógeno como en un ácido de Brønsted-Lowry estándar . Se conocen muchos oxoácidos de azufre y todos presentan grupos OH que pueden disociarse. [29]
El ácido telúrico a menudo se escribe con la fórmula H 2 TeO 4 ·2H 2 O, pero se describe mejor estructuralmente como Te(OH) 6 . [30]
El ácido orto -peryódico [nota 6] puede perder todos sus protones, formando finalmente el ion peryodato [IO 4 ] − . También puede protonarse en condiciones fuertemente ácidas para dar el ion octaédrico [I(OH) 6 ] + , completando la serie isoelectrónica , [E(OH) 6 ] z , E = Sn, Sb, Te, I; z = −2, −1, 0, +1. Se conocen otros ácidos de yodo(VII) que contienen grupos hidróxido, en particular en sales como el ion peryodato meso que se encuentra en K 4 [I 2 O 8 (OH) 2 ]·8H 2 O. [31]
Como es habitual fuera de los metales alcalinos, los hidróxidos de los elementos en estados de oxidación más bajos son complicados. Por ejemplo, el ácido fosforoso H 3 PO 3 tiene predominantemente la estructura OP(H)(OH) 2 , en equilibrio con una pequeña cantidad de P(OH) 3 . [32] [33]
Los oxiácidos de cloro , bromo y yodo tienen la fórmula O n −1/2 A(OH), donde n es el número de oxidación : +1, +3, +5 o +7, y A = Cl, Br o I. El único oxoácido del flúor es el ácido hipofluoroso F(OH) . Cuando estos ácidos se neutralizan, el átomo de hidrógeno se elimina del grupo hidróxido. [34]
Los hidróxidos de los metales de transición y post-transición usualmente tienen el metal en el estado de oxidación +2 (M = Mn, Fe, Co, Ni, Cu, Zn) o +3 (M = Fe, Ru, Rh, Ir). Ninguno es soluble en agua, y muchos están mal definidos. Una característica que complica los hidróxidos es su tendencia a sufrir una mayor condensación a los óxidos, un proceso llamado olación . Los hidróxidos de metales en el estado de oxidación +1 también están mal definidos o son inestables. Por ejemplo, el hidróxido de plata Ag(OH) se descompone espontáneamente al óxido (Ag 2 O). Los hidróxidos de cobre(I) y oro(I) también son inestables, aunque se conocen aductos estables de CuOH y AuOH. [35] Los compuestos poliméricos M(OH) 2 y M(OH) 3 se preparan en general aumentando el pH de una solución acuosa de los cationes metálicos correspondientes hasta que el hidróxido precipita fuera de la solución. Por el contrario, los hidróxidos se disuelven en solución ácida. El hidróxido de cinc Zn(OH) 2 es anfótero y forma el ion tetrahidroxizincato Zn(OH) 2.2−
4en solución fuertemente alcalina. [16]
Existen numerosos complejos de ligandos mixtos de estos metales con el ion hidróxido. De hecho, en general están mejor definidos que los derivados más simples. Muchos pueden formarse mediante la desprotonación del complejo acuoso metálico correspondiente .
El ácido vanádico H 3 VO 4 muestra similitudes con el ácido fosfórico H 3 PO 4 aunque tiene una química de oxoaniones vanadato mucho más compleja. El ácido crómico H 2 CrO 4 , tiene similitudes con el ácido sulfúrico H 2 SO 4 ; por ejemplo, ambos forman sales ácidas A + [HMO 4 ] − . Algunos metales, por ejemplo V, Cr, Nb, Ta, Mo, W, tienden a existir en estados de oxidación altos. En lugar de formar hidróxidos en solución acuosa, se convierten en grupos oxo mediante el proceso de olación , formando polioxometalatos . [36]
En algunos casos, los productos de la hidrólisis parcial de iones metálicos, descrita anteriormente, se pueden encontrar en compuestos cristalinos. Un ejemplo sorprendente se encuentra en el circonio (IV). Debido al alto estado de oxidación, las sales de Zr 4+ se hidrolizan ampliamente en agua incluso a pH bajo. Se descubrió que el compuesto originalmente formulado como ZrOCl 2 ·8H 2 O era la sal de cloruro de un catión tetramérico [Zr 4 (OH) 8 (H 2 O) 16 ] 8+ en el que hay un cuadrado de iones Zr 4+ con dos grupos hidróxido que forman un puente entre átomos de Zr en cada lado del cuadrado y con cuatro moléculas de agua unidas a cada átomo de Zr. [37]
El mineral malaquita es un ejemplo típico de un carbonato básico. La fórmula, Cu 2 CO 3 (OH) 2 muestra que está a medio camino entre el carbonato de cobre y el hidróxido de cobre . De hecho, en el pasado la fórmula se escribía como CuCO 3 ·Cu(OH) 2 . La estructura cristalina está formada por iones de cobre, carbonato e hidróxido. [37] El mineral atacamita es un ejemplo de un cloruro básico. Tiene la fórmula, Cu 2 Cl(OH) 3 . En este caso, la composición es más cercana a la del hidróxido que a la del cloruro CuCl 2 ·3Cu(OH) 2 . [38] El cobre forma hidroxifosfato ( libetenita ), arseniato ( olivenita ), sulfato ( brochantita ) y compuestos de nitrato. El plomo blanco es un carbonato de plomo básico , (PbCO 3 ) 2 ·Pb(OH) 2 , que se ha utilizado como pigmento blanco debido a su calidad opaca, aunque su uso ahora está restringido porque puede ser una fuente de envenenamiento por plomo . [37]
El ion hidróxido parece rotar libremente en cristales de hidróxidos de metales alcalinos más pesados a temperaturas más altas, de modo que se presenta como un ion esférico, con un radio iónico efectivo de aproximadamente 153 pm. [39] Por lo tanto, las formas de alta temperatura de KOH y NaOH tienen la estructura de cloruro de sodio , [40] que se congela gradualmente en una estructura de cloruro de sodio monoclínicamente distorsionada a temperaturas inferiores a aproximadamente 300 °C. Los grupos OH todavía rotan incluso a temperatura ambiente alrededor de sus ejes de simetría y, por lo tanto, no pueden detectarse por difracción de rayos X. [41] La forma de temperatura ambiente de NaOH tiene la estructura de yoduro de talio . LiOH, sin embargo, tiene una estructura en capas, formada por unidades tetraédricas Li(OH) 4 y (OH)Li 4 . [39] Esto es consistente con el carácter débilmente básico de LiOH en solución, lo que indica que el enlace Li-OH tiene mucho carácter covalente.
El ion hidróxido muestra simetría cilíndrica en hidróxidos de metales divalentes Ca, Cd, Mn, Fe y Co. Por ejemplo, el hidróxido de magnesio Mg(OH) 2 ( brucita ) cristaliza con la estructura de capa de yoduro de cadmio , con una especie de empaquetamiento compacto de iones de magnesio e hidróxido. [39] [42]
El hidróxido anfótero Al(OH) 3 tiene cuatro formas cristalinas principales: gibbsita (más estable), bayerita , nordstrandita y doyleíta . [nota 7] Todos estos polimorfos están formados por capas dobles de iones hidróxido (los átomos de aluminio en dos tercios de los agujeros octaédricos entre las dos capas) y difieren solo en la secuencia de apilamiento de las capas. [43] Las estructuras son similares a la estructura de la brucita. Sin embargo, mientras que la estructura de la brucita puede describirse como una estructura compacta en la gibbsita, los grupos OH en la parte inferior de una capa descansan sobre los grupos de la capa inferior. Esta disposición llevó a la sugerencia de que hay enlaces direccionales entre los grupos OH en capas adyacentes. [44] Esta es una forma inusual de enlace de hidrógeno , ya que se esperaría que los dos iones hidróxido involucrados apunten en direcciones opuestas. Los átomos de hidrógeno se han localizado mediante experimentos de difracción de neutrones en α-AlO(OH) ( diáspora ). La distancia O–H–O es muy corta, 265 pm; el hidrógeno no es equidistante entre los átomos de oxígeno y el enlace OH corto forma un ángulo de 12° con la línea O–O. [45] Se ha propuesto un tipo similar de enlace de hidrógeno para otros hidróxidos anfóteros, incluidos Be(OH) 2 , Zn(OH) 2 y Fe(OH) 3 . [39]
Se conocen varios hidróxidos mixtos con estequiometría A 3 M III (OH) 6 , A 2 M IV (OH) 6 y AM V (OH) 6 . Como sugiere la fórmula, estas sustancias contienen unidades estructurales octaédricas M(OH) 6 . [46] Los hidróxidos dobles en capas pueden representarse mediante la fórmula [Mz +
1− xMETRO3+
x(OH)
2] q + (X n − )
q / n· y H
2O . Lo más común es que z = 2 y M 2+ = Ca 2+ , Mg 2+ , Mn 2+ , Fe 2+ , Co 2+ , Ni 2+ , Cu 2+ o Zn 2+ ; por lo tanto, q = x .
El hidróxido de potasio y el hidróxido de sodio son dos reactivos bien conocidos en la química orgánica .
El ion hidróxido puede actuar como un catalizador básico . [47] La base abstrae un protón de un ácido débil para dar un intermedio que pasa a reaccionar con otro reactivo. Los sustratos comunes para la abstracción de protones son alcoholes , fenoles , aminas y ácidos carbonados . El valor pKa para la disociación de un enlace C–H es extremadamente alto, pero el pKa de los hidrógenos alfa de un compuesto carbonílico es aproximadamente 3 unidades logarítmicas más bajo. Los valores típicos de pKa son 16,7 para el acetaldehído y 19 para la acetona . [48] La disociación puede ocurrir en presencia de una base adecuada.
La base debe tener un valor de p K no menor que aproximadamente 4 unidades logarítmicas menor, o el equilibrio estará casi completamente a la izquierda.
El ion hidróxido por sí solo no es una base lo suficientemente fuerte, pero se puede convertir en una añadiendo hidróxido de sodio al etanol.
para producir el ion etóxido . El pKa para la autodisociación del etanol es de aproximadamente 16, por lo que el ion alcóxido es una base lo suficientemente fuerte. [49] La adición de un alcohol a un aldehído para formar un hemiacetal es un ejemplo de una reacción que puede ser catalizada por la presencia de hidróxido. El hidróxido también puede actuar como un catalizador de base de Lewis. [50]

El ion hidróxido es intermedio en nucleofilia entre el ion fluoruro F − y el ion amida NH−
2. [51] Hidrólisis de ésteres en condiciones alcalinas (también conocida como hidrólisis básica)
es un ejemplo de un ion hidróxido que actúa como nucleófilo. [52]
Los primeros métodos para fabricar jabón trataban los triglicéridos de la grasa animal (el éster) con lejía .
Otros casos en los que el hidróxido puede actuar como reactivo nucleofílico son la hidrólisis de amidas , la reacción de Cannizzaro , la sustitución alifática nucleofílica , la sustitución aromática nucleofílica y en las reacciones de eliminación . El medio de reacción para KOH y NaOH suele ser agua, pero con un catalizador de transferencia de fase, el anión hidróxido también puede transportarse a un disolvente orgánico, por ejemplo, en la generación del intermedio reactivo diclorocarbeno .
{{cite journal}}: CS1 maint: URL no apta ( enlace )