
Un inhibidor mitótico , inhibidor de microtúbulos o inhibidor de tubulina es un fármaco que inhibe la mitosis o división celular y se utiliza en el tratamiento del cáncer , la gota y los hongos en las uñas . Estos medicamentos alteran los microtúbulos , que son estructuras que separan los cromosomas cuando una célula se divide. Los inhibidores mitóticos se utilizan en el tratamiento del cáncer , porque las células cancerosas pueden crecer mediante una división continua que eventualmente se propaga por el cuerpo ( metástasis ). Por tanto, las células cancerosas son más sensibles a la inhibición de la mitosis que las células normales. Los inhibidores mitóticos también se utilizan en citogenética (el estudio de los cromosomas), donde detienen la división celular en una etapa en la que los cromosomas pueden examinarse fácilmente. [1]
Los inhibidores mitóticos se derivan de sustancias naturales como los alcaloides vegetales y evitan que las células experimenten mitosis al interrumpir la polimerización de los microtúbulos, previniendo así el crecimiento canceroso. Los microtúbulos son proteínas largas, parecidas a cuerdas, que se extienden a través de la célula y mueven los componentes celulares. Los microtúbulos son polímeros largos formados por unidades más pequeñas ( monómeros ) de la proteína tubulina . Los microtúbulos se crean durante las funciones celulares normales ensamblando (polimerizando) componentes de tubulina y se desmontan cuando ya no son necesarios. Una de las funciones importantes de los microtúbulos es mover y separar los cromosomas y otros componentes de la célula para la división celular ( mitosis ). Los inhibidores mitóticos interfieren con el ensamblaje y desensamblaje de la tubulina en polímeros de microtúbulos. Esto interrumpe la división celular, generalmente durante la fase de mitosis (M) del ciclo celular, cuando se supone que dos conjuntos de cromosomas completamente formados se separan en células hijas. [2] [3] Las moléculas de unión a tubulina han generado un interés significativo después de la introducción de los taxanos en la oncología clínica y el uso general de los alcaloides de la vinca .
Ejemplos de inhibidores mitóticos utilizados frecuentemente en el tratamiento del cáncer incluyen paclitaxel , docetaxel , vinblastina , vincristina y vinorelbina . [1] La colchicina y la griseofulvina son inhibidores mitóticos utilizados en el tratamiento de la gota y los hongos en las uñas, respectivamente.

Los microtúbulos son los componentes clave del citoesqueleto de las células eucariotas y tienen un papel importante en diversas funciones celulares, como la migración y el transporte intracelular, el mantenimiento de la forma celular, la polaridad, la señalización celular y la mitosis. [4] Desempeñan un papel fundamental en la división celular al participar en el movimiento y la unión de los cromosomas durante diversas etapas de la mitosis. Por lo tanto, la dinámica de los microtúbulos es un objetivo importante para el desarrollo de fármacos contra el cáncer . [5]
Los microtúbulos están compuestos por dos subunidades proteicas globulares , la tubulina α y β. Estas dos subunidades se combinan para formar un heterodímero α,β que luego se ensambla en una estructura filamentosa en forma de tubo. Los heterodímeros de tubulina se organizan de cabeza a cola con la subunidad α de un dímero entrando en contacto con la subunidad β del otro. Esta disposición da como resultado la formación de largas fibras proteicas llamadas protofilamentos.
Estos protofilamentos forman la columna vertebral del microtúbulo cilíndrico hueco que tiene aproximadamente 25 nanómetros de diámetro y varía de 200 nanómetros a 25 micrómetros de longitud. Aproximadamente entre 12 y 13 protofilamentos se disponen en paralelo para formar una lámina de proteína en forma de C, que luego se curva para formar una estructura en forma de tubo llamada microtúbulo. La disposición de cabeza a cola de los heterodímeros da polaridad al microtúbulo resultante, que tiene una subunidad α en un extremo y una subunidad β en el otro extremo. El extremo de la tubulina α tiene cargas negativas (–), mientras que el extremo de la tubulina β tiene cargas positivas (+). [4] Los microtúbulos crecen a partir de sitios de ensamblaje discretos en las células llamados centros organizadores de microtúbulos (MTOC), que son una red de proteínas asociadas a microtúbulos (MAP). [6] [7]
Dos moléculas de trifosfato de guanosina (GTP), rico en energía, también son componentes importantes de la estructura de los microtúbulos. Una molécula de GTP está estrechamente unida a la α-tubulina y no es intercambiable, mientras que la otra molécula de GTP está unida a la β-tubulina y puede intercambiarse fácilmente con guanosina difosfato (PIB). La estabilidad del microtúbulo dependerá de si el extremo β está ocupado por GTP o GDP. Un microtúbulo que tiene una molécula de GTP en el extremo β será estable y seguirá creciendo, mientras que un microtúbulo que tiene una molécula de GDP en el extremo β será inestable y se despolimerizará rápidamente. [6] [7]
Los microtúbulos no son estáticos pero son polímeros altamente dinámicos y exhiben dos tipos de comportamientos dinámicos: ' inestabilidad dinámica ' y ' caminata '. La inestabilidad dinámica es un proceso en el que los extremos de los microtúbulos cambian entre períodos de crecimiento y acortamiento. Los dos extremos no son iguales, el extremo anillado (-) de α-tubulina es menos dinámico, mientras que el extremo anillado (+) de β-tubulina, más dinámico, crece y se acorta más rápidamente. Los microtúbulos sufren largos periodos de lento alargamiento, breves periodos de rápido acortamiento y también una pausa en la que no hay crecimiento ni acortamiento. [4] [7] [8] La inestabilidad dinámica se caracteriza por cuatro variables: la tasa de crecimiento de los microtúbulos; la tasa de acortamiento; frecuencia de transición del estado de crecimiento o pausa al acortamiento (llamado ' catástrofe ') y la frecuencia de transición del acortamiento al estado de crecimiento o pausa (llamado ' rescate ').
El otro comportamiento dinámico llamado cinta rodante es el crecimiento neto de los microtúbulos en un extremo y el acortamiento neto en el otro extremo. Implica el flujo intrínseco de subunidades de tubulina desde el extremo positivo al extremo negativo. Ambos comportamientos dinámicos son importantes y un microtúbulo en particular puede exhibir principalmente inestabilidad dinámica, andar en cinta o una combinación de ambos. [8] [9]
Los agentes que actúan como inhibidores de la tubulina también actúan como inhibidores de la división celular. Un microtúbulo existe en un estado dinámico continuo de crecimiento y acortamiento mediante asociación y disociación reversible de heterodímeros de tubulina α/β en ambos extremos. Este comportamiento dinámico y el control resultante sobre la longitud del microtúbulo es vital para el funcionamiento adecuado del huso mitótico en la mitosis, es decir, la división celular.
Los microtúbulos intervienen en diferentes etapas del ciclo celular . Durante la primera etapa o profase , los microtúbulos necesarios para la división celular comienzan a formarse y crecer hacia los cromosomas recién formados formando un haz de microtúbulos llamado huso mitótico . Durante la prometafase y la metafase, este huso se adhiere a los cromosomas en un punto particular llamado cinetocoro y pasa por varios períodos de crecimiento y acortamiento en sintonía con las oscilaciones de ida y vuelta de los cromosomas. También en la anafase , los microtúbulos adheridos a los cromosomas mantienen un proceso de acortamiento y alargamiento cuidadosamente regulado. Por tanto, la presencia de un fármaco que pueda suprimir la dinámica de los microtúbulos es suficiente para bloquear el ciclo celular y provocar la muerte de las células por apoptosis . [5] [10] [11]
Los inhibidores de tubulina actúan así interfiriendo con la dinámica de los microtúbulos, es decir, creciendo ( polimerización ) y acortándose (despolimerización). Una clase de inhibidores actúa inhibiendo la polimerización de la tubulina para formar microtúbulos y se denominan inhibidores de la polimerización, como los análogos de la colchicina y los alcaloides de la vinca . Disminuyen la masa de polímero de microtúbulos en las células en altas concentraciones y actúan como agentes desestabilizadores de microtúbulos. La otra clase de inhibidores actúa inhibiendo la despolimerización de la tubulina polimerizada y aumenta la masa polimérica de los microtúbulos en las células. Actúan como agentes estabilizadores de microtúbulos y se denominan inhibidores de la despolimerización como los análogos del paclitaxel . [4] Estas tres clases de drogas parecen operar mediante mecanismos ligeramente diferentes .

Los análogos de la colchicina bloquean la división celular al alterar los microtúbulos. Se ha informado que la subunidad β de la tubulina participa en la unión de la colchicina. Se une a la tubulina soluble para formar el complejo colchicina-tubulina. Este complejo, junto con las tubulinas normales, se polimeriza para formar los microtúbulos. Sin embargo, la presencia de este complejo TC impide una mayor polimerización de los microtúbulos. Este complejo provoca un cambio conformacional que bloquea la adición adicional de los dímeros de tubulina y, por lo tanto, previene el crecimiento de los microtúbulos. A medida que el complejo TC ralentiza la adición de nuevos dímeros, el microtúbulo se desmonta debido a un desequilibrio estructural o inestabilidad durante la metafase de la mitosis. [13]
Los alcaloides de la Vinca se unen a la subunidad β de los dímeros de tubulina en una región distinta llamada dominio de unión a la Vinca. Se unen rápidamente a la tubulina y esta unión es reversible e independiente de la temperatura (entre 0 °C y 37 °C). A diferencia de la colchicina, los alcaloides de la vinca se unen directamente a los microtúbulos. No forman primero un complejo con la tubulina soluble ni se copolimerizan para formar los microtúbulos, pero son capaces de provocar un cambio conformacional en la tubulina en relación con la autoasociación de la tubulina. [8] Los alcaloides de la vinca se unen a la tubulina con alta afinidad en los extremos de los microtúbulos, pero con baja afinidad en los sitios de tubulina presentes a lo largo de los lados del cilindro de los microtúbulos. La unión de estos fármacos en los sitios de alta afinidad da como resultado una fuerte supresión cinética del intercambio de tubulina incluso a bajas concentraciones de fármaco, mientras que su unión a los sitios de baja afinidad en concentraciones relativamente altas despolimeriza los microtúbulos. [5]
A diferencia de los alcaloides de la colchicina y la vinca, el paclitaxel mejora la polimerización de los microtúbulos promoviendo las fases de nucleación y elongación de la reacción de polimerización y reduce la concentración crítica de la subunidad de tubulina (es decir, la concentración de tubulina soluble en estado estacionario). Los microtúbulos polimerizados en presencia de paclitaxel son extremadamente estables. [5] El mecanismo de unión del paclitaxel imita el del nucleótido GTP junto con algunas diferencias importantes. El GTP se une a un extremo del dímero de tubulina manteniendo contacto con el siguiente dímero a lo largo de cada uno de los protofilamentos, mientras que el paclitaxel se une a un lado de la β-tubulina manteniendo contacto con el siguiente protofilamento. El GTP se une a los dímeros de tubulina no ensamblados, mientras que los sitios de unión de paclitaxel se encuentran únicamente en la tubulina ensamblada. La hidrólisis del GTP permite el desmontaje y la regulación del sistema de microtúbulos; sin embargo, la activación de tubulina por paclitaxel da como resultado la estabilización permanente de los microtúbulos. Por tanto, se describió que la supresión de la dinámica de los microtúbulos era la causa principal de la inhibición de la división celular y de la muerte de las células tumorales en las células tratadas con paclitaxel. [14]

La colchicina es uno de los fármacos antimitóticos más antiguos conocidos y en los últimos años [ ¿cuándo? ] Se han realizado muchas investigaciones para aislar o desarrollar compuestos que tengan una estructura similar pero alta actividad y menos toxicidad . Esto dio lugar al descubrimiento de varios análogos de la colchicina. La estructura de la colchicina está formada por tres anillos, un anillo de trimetoxibenceno (anillo A), un anillo de metoxitropona ( anillo C) y un anillo de siete miembros (anillo B) con un grupo acetamido ubicado en su posición C-7. El grupo trimetoxifenilo de la colchicina no sólo ayuda a estabilizar el complejo tubulina-colchicina sino que también es importante para la actividad antitubulina junto con el anillo C. El grupo 3-metoxi aumentó la capacidad de unión, mientras que el grupo 1-metoxi ayudó a lograr la correcta conformación de la molécula. La estabilidad del anillo tropone y la posición del grupo metoxi y carbonilo son cruciales para la capacidad de unión del compuesto. El grupo 10-metoxi se puede reemplazar con grupos halógeno, alquilo, alcoxi o amino sin afectar la afinidad de unión de tubulina, mientras que los sustituyentes voluminosos reducen la actividad. El anillo B, cuando se expandió, mostró una actividad reducida; sin embargo, se cree que el anillo y su cadena lateral C-7 afectan la conformación de los análogos de colchicina en lugar de su capacidad de unión a tubulina. La sustitución en C-5 dio como resultado una pérdida de actividad, mientras que la unión de sistemas de anillos heterocíclicos anulados al anillo B dio como resultado un compuesto muy potente . [13]

Paclitaxel ha logrado un gran éxito como fármaco contra el cáncer, pero se han realizado esfuerzos continuos para mejorar su eficacia y desarrollar análogos que sean más activos y tengan mayor biodisponibilidad y especificidad . La importancia de la cadena lateral de fenilisoserina sustituida en C-13 para la bioactividad del paclitaxel se conoce desde hace mucho tiempo. Se han probado varios reemplazos en la sustitución C-3'. La sustitución del grupo fenilo C-3' por grupos alquilo o alquinilo mejoró enormemente la actividad, y con el grupo CF 3 en esa posición en combinación con la modificación del 10-Ac con otros grupos acilo aumentó la actividad varias veces. También se encontró que otra modificación de C-3' con restos de ciclopropano y epóxido era potente. Se encontró que la mayoría de los análogos sin el anillo A eran mucho menos activos que el propio paclitaxel. Los análogos con cadena lateral de amida en C-13 son menos activos que su contraparte éster. También la desoxigenación en la posición 1 mostró una actividad reducida. La preparación de 10-α-espiro epóxido y su éter 7-MOM dio compuestos que tenían una citotoxicidad y actividad de ensamblaje de tubulina comparables a las del paclitaxel. La sustitución con C-6-α-OH y C-6-β-OH proporcionó análogos que eran equipotentes con respecto al paclitaxel en el ensayo de ensamblaje de tubulina. Finalmente, se descubre que el anillo de oxetano desempeña un papel importante durante la interacción con la tubulina. [15]
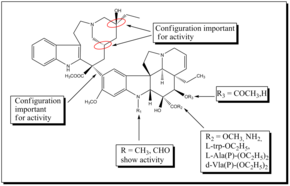
La vinblastina es un fármaco muy potente que también tiene efectos secundarios graves, especialmente en el sistema neurológico. Por ello, se desarrollaron nuevos análogos sintéticos con el objetivo de obtener fármacos más eficaces y menos tóxicos. Las configuraciones estereoquímicas en C-20', C-16' y C-14' en la porción de velbanamina son críticas y la inversión conduce a la pérdida de actividad. El grupo carboximetilo C-16' es importante para la actividad ya que el dímero descarboxilado está inactivo. La variación estructural en C-15'-C-20' en el anillo de velbanamina es bien tolerada. La modificación del esqueleto superior de la vinblastina dio vinorelbina, que muestra una actividad comparable a la de la vinblastina. Otro análogo preparado fue el derivado difluoro de vinorelbina que mostró una actividad antitumoral mejorada in vivo. Se descubrió que la fluoración en la posición C-19' de vinorelbina aumentaba drásticamente la actividad in vivo . La mayoría de los estudios SAR involucran la porción vindolina de los alcaloides bis-indol porque la modificación en C-16 y C-17 ofrece buenas oportunidades para desarrollar nuevos análogos. La sustitución del grupo éster por un grupo amida en el C-16 dio como resultado el desarrollo de vindesina. De manera similar, reemplazo del grupo acetilo en C-16 con L-trp-OC 2 H 5 , d-Ala(P)-(OC 2 H 5 ) 2 , L-Ala(P)-(OC 2 H 5 ) 2 y I-Vla(P)-(OC 2 H 5 ) 2 dio lugar a nuevos análogos con actividad antitubulina. También se encontró que el grupo indol metilo de la vindolina es una posición útil para funcionalizar potencialmente y desarrollar nuevos y potentes derivados de vinblastina. Una nueva serie de espirooxazolidina-1,3-dionas C-16 semisintéticas preparadas a partir de 17-desacetil vinblastina mostró una buena actividad antitubulina y una menor citotoxicidad. El vinglicinato, un profármaco de glicinato derivado del grupo C-17-OH de la vinblastina, mostró una actividad antitumoral y una toxicidad similares a las de la vinblastina. [dieciséis]
La citogenética , el estudio del material cromosómico mediante el análisis de cromosomas con bandas G, utiliza ampliamente inhibidores mitóticos. Para preparar un portaobjetos para el estudio citogenético, se añade un inhibidor mitótico a las células en estudio. Esto detiene las células durante la mitosis, mientras los cromosomas aún son visibles. Una vez que las células se centrifugan y se colocan en una solución hipotónica , se hinchan, diseminando los cromosomas. Después de la preparación, los cromosomas de las células se pueden observar bajo un microscopio para examinar los patrones de bandas de los cromosomas. Este experimento es crucial para muchas formas de investigación del cáncer.
Las moléculas de unión a tubulina se diferencian de otros fármacos anticancerígenos en su modo de acción porque se dirigen al huso mitótico y no al ADN. Los fármacos fijadores de tubulina se han clasificado según su modo de acción y sitio de unión [6] [17] [18] como:
a) Ligandos del sitio de paclitaxel , incluye paclitaxel, epotilona, docetaxel, discodermolida, etc.
a) Sitio de unión de colchicina, incluye colchicina, combrestatina, 2-metoxiestradiol, metoxibencenosulfonamidas (E7010), etc.
b) Sitio de unión de los alcaloides de la vinca, [19] incluye vinblastina, vincristina, vinorelbina, vinflunina, dolastatinas, halicondrinas, hemiasterlinas, criptofisina 52, etc.
Los taxanos son terpenos complejos producidos por las plantas del género Taxus (tejos). Originariamente derivados del árbol del tejo del Pacífico , ahora se sintetizan artificialmente. Su mecanismo principal es la alteración de la función de los microtúbulos de la célula mediante la estabilización de la formación de microtúbulos. Los microtúbulos son esenciales para la reproducción mitótica , por lo que mediante la inactivación de la función de los microtúbulos de una célula, los taxanos inhiben la división celular.

Los alcaloides de la vinca son aminas producidas por la planta alucinógena Catharanthus roseus (Bígaro de Madagascar). "Los alcaloides de la vinca inhiben la polimerización de microtúbulos ".
La colchicina es un alcaloide derivado del azafrán de otoño ( Colchicum Autumnale ). Inhibe la mitosis al inhibir la polimerización de microtúbulos. Si bien la colchicina no se usa para tratar el cáncer en humanos, se usa comúnmente para tratar ataques agudos de gota . [26]
La colchicina es un fármaco antiinflamatorio que se utiliza de forma continuada desde hace más de 3000 años. La colchicina es un fármaco oral que se sabe que se utiliza para tratar la gota aguda y prevenir ataques agudos de fiebre mediterránea familiar (FMF). Sin embargo, el uso de colchicina está limitado por su alta toxicidad en otras terapias. Se sabe que la colchicina inhibe la división y proliferación celular. Los primeros estudios demostraron que la colchicina altera el huso mitótico. Posteriormente se demostró que la disolución de los microtúbulos era responsable del efecto de la colchicina sobre el huso mitótico y la proliferación celular. [27]
La podofilotoxina derivada de la planta del manzano se usa para tratar infecciones virales de la piel y los análogos sintéticos de la molécula se usan para tratar ciertos tipos de cáncer.
La griseofulvina , derivada de una especie de Penicillium, es un inhibidor mitótico que se utiliza como fármaco antifúngico. Inhibe el ensamblaje de microtúbulos fúngicos.
Las limitaciones en la terapia contra el cáncer se deben principalmente a dos razones; por el organismo del paciente, o por alteraciones genéticas específicas en las células tumorales. Por parte del paciente, la terapia está limitada por la mala absorción del fármaco, lo que puede provocar una baja concentración del agente activo en la sangre y una pequeña cantidad que llega al tumor. El nivel sérico bajo de un fármaco también puede ser causado por un metabolismo y una excreción rápidos asociados con la afinidad por el citocromo P450 intestinal o hepático . Otra razón es la inestabilidad y degradación de los fármacos en el entorno gastrointestinal. Un problema grave es también la variabilidad entre los pacientes, lo que provoca una biodisponibilidad diferente después de la administración de dosis iguales de un fármaco y una tolerancia diferente al efecto de los agentes quimioterapéuticos. El segundo problema es particularmente importante en el tratamiento de personas mayores. Su cuerpo es más débil y necesita aplicar dosis más bajas, a menudo por debajo del nivel terapéutico. Otro problema con los agentes anticancerígenos es su limitada solubilidad acuosa, lo que reduce sustancialmente la absorción de un fármaco. Los problemas con la administración de fármacos al tumor también ocurren cuando el agente activo tiene un peso molecular alto que limita la penetración en el tejido o el tumor tiene un gran volumen que impide la penetración. [4] [33]
La resistencia a múltiples fármacos es la limitación más importante en la terapia contra el cáncer. Puede desarrollarse en muchos compuestos químicamente distintos. Hasta ahora se conocen varios mecanismos para desarrollar la resistencia. La más común es la producción de las llamadas "bombas de expulsión". Las bombas eliminan los fármacos de las células tumorales, lo que provoca una baja concentración del fármaco en el objetivo, por debajo del nivel terapéutico. La salida es causada por la glicoproteína P, también llamada transportador de múltiples fármacos. Esta proteína es un producto del gen MDR1 de resistencia a múltiples fármacos y un miembro de la familia de transportadores dependientes de ATP ( casete de unión a ATP ). La glicoproteína P se encuentra en todos los organismos y sirve para proteger al cuerpo de los xenobióticos y participa en el movimiento de nutrientes y otros compuestos biológicamente importantes dentro de una célula o entre células. La glicoproteína P detecta sustratos cuando ingresan a la membrana plasmática y se une a ellos, lo que provoca la activación de uno de los dominios de unión a ATP. El siguiente paso es la hidrólisis del ATP, que provoca un cambio en la forma de la P-gp y abre un canal a través del cual el fármaco se bombea fuera de la célula. La hidrólisis de una segunda molécula de ATP da como resultado el cierre del canal y se repite el ciclo. La glicoproteína P tiene afinidad por los fármacos hidrofóbicos con carga positiva o eléctricamente neutra y, a menudo, se sobreexpresa en muchos cánceres humanos. Algunos tumores, por ejemplo el cáncer de pulmón, no sobreexpresan este transportador pero también pueden desarrollar resistencia. Se descubrió que otro transportador MRP1 también funciona como bomba de eflujo, pero en este caso los sustratos son compuestos naturales cargados negativamente o fármacos modificados por glutatión, conjugación, glicosilación, sulfatación y glucuronilación. Las drogas pueden ingresar a una célula de varias maneras. Las rutas principales son: difusión a través de la membrana plasmática, a través de receptores o transportadores o por el proceso de endocitosis . El cáncer puede desarrollar resistencia mediante mutaciones en sus células que resultan en alteraciones en la superficie de las células o en una endocitosis alterada. La mutación puede eliminar o cambiar transportadores o receptores, lo que permite que los medicamentos entren en la célula tumoral. Otra causa de resistencia a los medicamentos es una mutación en la tubulina β que causa alteraciones en los sitios de unión y un fármaco determinado no puede unirse a su objetivo. Los tumores también cambian las isoformas de expresión de tubulina para estos, que no son objetivos de fármacos antimitóticos, por ejemplo, sobreexpresan βIII-tubulina. Además, las células tumorales expresan otros tipos de proteínas y cambian la dinámica de los microtúbulos para contrarrestar el efecto de los fármacos anticancerígenos. También puede desarrollarse resistencia a los medicamentos debido a la interrupción del tratamiento. [4] [7] [8] [33]
El primer compuesto conocido que se une a la tubulina fue la colchicina, que se aisló del azafrán de otoño , Colchicum Autumnale , pero no se ha utilizado para el tratamiento del cáncer. Los primeros medicamentos contra el cáncer aprobados para uso clínico fueron los alcaloides de la vinca, la vinblastina y la vincristina en la década de 1960.
Fueron aislados de extractos de hojas de la planta Catharanthus roseus ( Vinca rosea ) en la Universidad de Western Ontario en 1958. [5] El primer fármaco pertenece a los taxanos y paclitaxel , descubiertos en extractos de la corteza del árbol de tejo, Taxus brevifolia . en 1967 por Monroe Wall y Mansukh Wani, pero su actividad de inhibición de la tubulina no se conoció hasta 1979.
Los árboles de tejo son una fuente pobre de agentes activos que limitaron el desarrollo de taxanos durante más de 20 años hasta que se descubrió la forma de síntesis. [5] En diciembre de 1992 se aprobó el uso de paclitaxel en quimioterapia. [37]
Debido a los numerosos efectos adversos y las limitaciones de uso, se necesitan nuevos fármacos con mejores propiedades. Se desean especialmente mejoras en la actividad antitumoral, el perfil de toxicidad, la formulación de fármacos y la farmacología. [35] Actualmente se han sugerido algunos enfoques en el desarrollo de nuevos agentes terapéuticos con mejores propiedades.