Los calcogenuros de hidrógeno (también hidruros de calcógeno o calciuros de hidrógeno ) son compuestos binarios de hidrógeno con átomos de calcógeno (elementos del grupo 16: oxígeno , azufre , selenio , telurio , polonio y livermorio ). El agua , el primer compuesto químico de esta serie, contiene un átomo de oxígeno y dos átomos de hidrógeno , y es el compuesto más común en la superficie de la Tierra. [1]
La serie más importante, que incluye el agua, tiene la fórmula química H2X , donde X representa cualquier calcógeno. Por lo tanto, son triatómicos . Toman una estructura doblada y, como tales, son moléculas polares . El agua es un compuesto esencial para la vida en la Tierra hoy en día, [2] cubriendo el 70,9% de la superficie del planeta. Los otros calcogenuros de hidrógeno suelen ser extremadamente tóxicos y tienen olores fuertes y desagradables que generalmente se asemejan a huevos o vegetales podridos. El sulfuro de hidrógeno es un producto común de descomposición en entornos pobres en oxígeno y, como tal, es una sustancia química responsable del olor de las flatulencias . También es un gas volcánico . A pesar de su toxicidad, el cuerpo humano lo produce intencionalmente en pequeñas cantidades para usarlo como molécula de señalización .
El agua puede disolver los demás calcogenuros de hidrógeno (al menos los que se encuentran hasta el telururo de hidrógeno), formando soluciones ácidas conocidas como ácidos hidrocalcógenos . Aunque estos son ácidos más débiles que los ácidos hidrohálicos , siguen una tendencia similar de aumento de la fuerza ácida con calcógenos más pesados, y también se forman de manera similar (convirtiendo el agua en un ion hidronio H 3 O + y el soluto en un ion XH − ). Se desconoce si el hidruro de polonio forma una solución ácida en agua como sus homólogos más ligeros, o si se comporta más como un hidruro metálico (véase también astaturo de hidrógeno ).
Algunas propiedades de los calcogenuros de hidrógeno son las siguientes: [3]
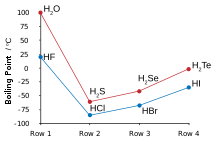

Muchas de las propiedades anómalas del agua en comparación con el resto de los calcogenuros de hidrógeno pueden atribuirse a la importante formación de enlaces de hidrógeno entre átomos de hidrógeno y oxígeno. Algunas de estas propiedades son los altos puntos de fusión y ebullición (es un líquido a temperatura ambiente), así como la constante dieléctrica alta y la disociación iónica observable. La formación de enlaces de hidrógeno en el agua también da lugar a valores elevados de calor y entropía de vaporización, tensión superficial y viscosidad. [5]
Los otros calcogenuros de hidrógeno son gases altamente tóxicos y malolientes. El sulfuro de hidrógeno se encuentra comúnmente en la naturaleza y sus propiedades comparadas con el agua revelan una falta de enlaces de hidrógeno significativos. [6] Dado que ambos son gases en condiciones normales, el hidrógeno puede quemarse simplemente en presencia de oxígeno para formar agua en una reacción altamente exotérmica ; dicha prueba se puede utilizar en química para principiantes para probar los gases producidos por una reacción, ya que el hidrógeno se quema con un estallido. El agua, el sulfuro de hidrógeno y el seleniuro de hidrógeno se pueden obtener calentando sus elementos constituyentes juntos por encima de los 350 °C, pero el telururo de hidrógeno y el hidruro de polonio no se pueden obtener por este método debido a su inestabilidad térmica; el telururo de hidrógeno se descompone en la humedad, en la luz y en temperaturas superiores a 0 °C. El hidruro de polonio es inestable y, debido a la intensa radiactividad del polonio (que resulta en autoradiólisis al formarse), solo se pueden obtener cantidades traza tratando ácido clorhídrico diluido con una lámina de magnesio revestida con polonio . Sus propiedades son algo distintas del resto de los calcogenuros de hidrógeno, ya que el polonio es un metal mientras que los otros calcógenos no lo son, y por lo tanto este compuesto es intermedio entre un calcogenuro de hidrógeno normal o haluro de hidrógeno como el cloruro de hidrógeno , y un hidruro metálico como el estannano . Al igual que el agua, el primero del grupo, el hidruro de polonio también es un líquido a temperatura ambiente. Sin embargo, a diferencia del agua, las fuertes atracciones intermoleculares que causan el punto de ebullición más alto son interacciones de van der Waals , un efecto de las grandes nubes de electrones del polonio. [3]
Los dicalcogenuros de dihidrógeno tienen la fórmula química H 2 X 2 y generalmente son menos estables que los monocalcogenuros, y comúnmente se descomponen en el monocalcogenuro y el calcógeno involucrado.
El más importante de ellos es el peróxido de hidrógeno , H2O2 , un líquido azul pálido, casi incoloro, que tiene una volatilidad menor que el agua y una mayor densidad y viscosidad. Es importante químicamente porque se puede oxidar o reducir en soluciones de cualquier pH, puede formar fácilmente complejos de peroxometales y complejos de peroxoácidos, además de experimentar muchas reacciones ácido/base protónicas. En su forma menos concentrada, el peróxido de hidrógeno tiene algunos usos domésticos importantes, como desinfectante o para decolorar el cabello; las soluciones mucho más concentradas son mucho más peligrosas.
Algunas propiedades de los dicalcogenuros de hidrógeno son las siguientes:
Se ha examinado computacionalmente un isómero estructural alternativo de los dicalcogenuros, en el que ambos átomos de hidrógeno están unidos al mismo átomo de calcógeno, que también está unido al otro átomo de calcógeno. Estas estructuras H 2 X + –X – son iluros . Esta forma isomérica del peróxido de hidrógeno, el oxiagua, no se ha sintetizado experimentalmente. El isómero análogo del disulfuro de hidrógeno, el tiosulfóxido , se ha detectado mediante experimentos de espectrometría de masas . [9]
Es posible que dos átomos de calcógeno diferentes compartan un dicalcogenuro, como en el tioperóxido de hidrógeno (H 2 SO ); compuestos más conocidos de descripción similar incluyen el ácido sulfúrico (H 2 SO 4 ).
Todos los calcogenuros de hidrógeno de cadena lineal siguen la fórmula H 2 X n .
Los polióxidos de hidrógeno superiores al H 2 O 2 no son estables. [10] El trioxidano , con tres átomos de oxígeno, es un intermediario inestable transitorio en varias reacciones. Los dos siguientes en la serie del oxígeno, el tetraoxidano y el pentaoxidano , también se han sintetizado y se ha descubierto que son altamente reactivos. Se ha examinado computacionalmente un isómero estructural alternativo del trioxidano, en el que los dos átomos de hidrógeno están unidos al oxígeno central de la cadena de tres oxígenos en lugar de uno en cada extremo. [11]
Además del H 2 S y el H 2 S 2 , muchos polisulfanos superiores, H 2 S n ( n = 3–8), se conocen como compuestos estables. [12] Presentan cadenas de azufre no ramificadas, lo que refleja la tendencia del azufre a la concatenación. Comenzando con el H 2 S 2 , todos los polisulfanos conocidos son líquidos a temperatura ambiente. El H 2 S 2 es incoloro, mientras que los otros polisulfanos son amarillos; el color se vuelve más intenso a medida que n aumenta, al igual que la densidad, la viscosidad y el punto de ebullición. A continuación se presenta una tabla de propiedades físicas. [13]
Sin embargo, pueden oxidarse fácilmente y son todos térmicamente inestables, desproporcionándose fácilmente en azufre y sulfuro de hidrógeno, una reacción para la cual el álcali actúa como catalizador: [13]
También reaccionan con sulfito y cianuro para producir tiosulfato y tiocianato respectivamente. [13]
Se ha examinado computacionalmente un isómero estructural alternativo del trisulfuro, en el que los dos átomos de hidrógeno están unidos al azufre central de la cadena de tres azufres en lugar de uno en cada extremo. [11] El ácido tiosulfuroso , un isómero ramificado del tetrasulfuro, en el que el cuarto azufre está unido al azufre central de una estructura lineal de trisulfuro de dihidrógeno ( (HS) 2 S + −S − ), también se ha examinado computacionalmente. [14] El ácido tiosulfúrico , en el que dos átomos de azufre se ramifican del azufre central de una estructura lineal de trisulfuro de dihidrógeno, también se ha estudiado computacionalmente. [15]
Pueden existir hidruros de polonio superiores. [16]

Existen algunos compuestos de calcogenuro monohidrógeno y otros se han estudiado teóricamente. Como compuestos radicales , son bastante inestables. Los dos más simples son el hidroxilo (HO) y el hidroperoxilo (HO 2 ). También se conoce el compuesto ozónido de hidrógeno (HO 3 ), [17] junto con algunas de sus sales de ozónido de metal alcalino (varios MO 3 ). [18] El análogo de azufre respectivo para el hidroxilo es el sulfanilo (HS) y HS 2 para el hidroperoxilo.
Uno o ambos átomos de protio en el agua pueden sustituirse por el isótopo deuterio , produciendo respectivamente agua semipesada y agua pesada , siendo este último uno de los compuestos de deuterio más famosos. Debido a la alta diferencia de densidad entre el deuterio y el protio regular , el agua pesada exhibe muchas propiedades anómalas. El radioisótopo tritio también puede formar agua tritiada de la misma manera. Otro calcogenuro de deuterio notable es el disulfuro de deuterio . El telururo de deuterio (D 2 Te) tiene una estabilidad térmica ligeramente mayor que el telururo de protio, y se ha utilizado experimentalmente para métodos de deposición química de películas delgadas basadas en telururo. [19]
El hidrógeno comparte muchas propiedades con los halógenos ; sustituir el hidrógeno con halógenos puede dar lugar a compuestos de haluro de calcógeno como el difluoruro de oxígeno y el monóxido de dicloro , junto con otros que pueden ser imposibles con hidrógeno, como el dióxido de cloro .
Uno de los iones de calcogenuro de hidrógeno más conocidos es el ion hidróxido y el grupo funcional hidroxi relacionado . El primero está presente en hidróxidos de metales alcalinos , alcalinotérreos y tierras raras , formados al reaccionar el metal respectivo con agua. El grupo hidroxi aparece comúnmente en química orgánica, como en los alcoholes . El grupo bisulfuro /sulfhidrilo relacionado aparece en sales de hidrosulfuro y tioles , respectivamente.
El ion hidronio (H 3 O + ) está presente en soluciones ácidas acuosas, incluidos los propios ácidos hidrocalcógenos, así como en agua pura junto con el hidróxido.