La hemofilia B , también llamada hemofilia B , es un trastorno de la coagulación sanguínea que provoca hematomas y sangrado con facilidad debido a una mutación hereditaria del gen del factor IX y que da lugar a una deficiencia del factor IX. Es menos común que la deficiencia del factor VIII ( hemofilia A ). [3]
La hemofilia B fue reconocida por primera vez como una entidad patológica distinta en 1952. [4] También se la conoce con el nombre de enfermedad de Christmas , [1] llamada así por Stephen Christmas , el primer paciente descrito con hemofilia B. Además, el primer informe de su identificación se publicó en la edición navideña del British Medical Journal . [4] [5]
La mayoría de las personas que padecen hemofilia B y presentan síntomas son hombres. [6] La prevalencia de la hemofilia B en la población es de aproximadamente uno en 40.000; la hemofilia B representa alrededor del 15% de los pacientes con hemofilia. [6] Muchas mujeres portadoras de la enfermedad no presentan síntomas. [6] Sin embargo, se estima que entre el 10 y el 25% de las mujeres portadoras tienen síntomas leves; en casos raros, las mujeres pueden tener síntomas moderados o graves. [6]
Los síntomas incluyen hematomas con facilidad , sangrado del tracto urinario ( hematuria ), hemorragias nasales ( epistaxis ) y sangrado en las articulaciones ( hemartrosis ). [1]
Los pacientes con trastornos hemorrágicos presentan una mayor incidencia de enfermedad periodontal, así como caries dentales, en relación con el temor al sangrado que conduce a una falta de higiene bucal y cuidado de la salud bucal. La manifestación oral más prominente de una hemofilia B leve sería el sangrado gingival durante la exfoliación de la dentición primaria, o el sangrado prolongado después de un procedimiento invasivo/extracción dental; En la hemofilia grave, puede haber sangrado espontáneo de los tejidos orales (p. ej. paladar blando, lengua, mucosa bucal), labios y encías, con equimosis. En casos raros, puede observarse hemartrosis (sangrado en el espacio articular) de la articulación temporomandibular (ATM). [7]
Los pacientes con hemofilia experimentarán muchos episodios de sangrado oral a lo largo de su vida. Un promedio de 29,1 episodios de sangrado por año son lo suficientemente graves como para requerir un reemplazo de factor en pacientes con deficiencia de F VIII, de los cuales el 9 % afecta las estructuras orales. Los niños con hemofilia grave tienen una prevalencia significativamente menor de caries dentales y puntuaciones de placa más bajas en comparación con controles sanos emparejados. [8]
El gen del factor IX se encuentra en el cromosoma X (Xq27.1-q27.2). Es un rasgo recesivo ligado al cromosoma X , lo que explica por qué los varones se ven afectados en mayor número. [9] [10]
En 1990, George Brownlee y Merlin Crossley demostraron que dos conjuntos de mutaciones genéticas impedían que dos proteínas clave se unieran al ADN de personas con una forma rara e inusual de hemofilia B ( hemofilia B de Leyden ), en la que los pacientes experimentan episodios de sangrado excesivo en la infancia pero tienen pocos problemas de sangrado después de la pubertad. [10]
Esta falta de unión de la proteína al ADN desactivaba el gen que produce el factor de coagulación IX , que previene el sangrado excesivo. [10]
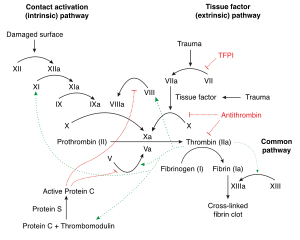
La deficiencia del factor IX conduce a una mayor propensión a la hemorragia , que puede producirse espontáneamente o en respuesta a un traumatismo leve. [11]
La deficiencia del factor IX puede causar interferencias en la cascada de coagulación, lo que provoca hemorragias espontáneas cuando hay un traumatismo. El factor IX, cuando se activa, activa el factor X , que ayuda a la conversión del fibrinógeno en fibrina . [11]
El factor IX se activa finalmente en la coagulación por acción del cofactor VIII (específicamente IXa). Las plaquetas proporcionan un sitio de unión para ambos cofactores. Este complejo (en la vía de la coagulación) finalmente activará el factor X. [12]
El diagnóstico de la hemofilia B se puede realizar mediante las siguientes pruebas/métodos: [2]
El diagnóstico diferencial de esta enfermedad hereditaria es el siguiente: hemofilia A , deficiencia del factor XI , enfermedad de von Willebrand , trastornos del fibrinógeno y síndrome de Bernard-Soulier [10].
El tratamiento se administra de forma intermitente, cuando hay sangrado significativo. Incluye infusión intravenosa de factor IX y/o transfusiones de sangre. Se deben evitar los AINE una vez realizado el diagnóstico, ya que pueden exacerbar un episodio de sangrado. Cualquier procedimiento quirúrgico debe realizarse con ácido tranexámico concomitante . [4] [13]
El etranacogen dezaparvovec (Hemgenix) fue aprobado para uso médico en los Estados Unidos en noviembre de 2022. [6] Es la primera terapia génica aprobada por la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) para tratar la hemofilia B. [6]
El tratamiento quirúrgico, incluida una extracción dental simple, debe planificarse para minimizar el riesgo de sangrado, hematomas excesivos o formación de hematomas. Se pueden utilizar férulas blandas moldeadas al vacío para brindar protección local después de una extracción dental o un sangrado prolongado posterior a la extracción. [14]
En julio de 2022 se anunciaron los resultados de un candidato a terapia génica para la hemofilia B llamado FLT180, que funciona utilizando un virus adenoasociado (AAV) para restaurar la proteína del factor de coagulación IX (FIX), se observaron niveles normales de la proteína con dosis bajas de la terapia, pero se necesitó inmunosupresión para disminuir el riesgo de respuestas inmunes relacionadas con el vector. [15] [16] [17]

Stephen Christmas (12 de febrero de 1947 - 20 de diciembre de 1993) fue el primer paciente con enfermedad de Christmas (o hemofilia B) descrito en 1952 por un grupo de médicos británicos. Christmas nació en una familia británica en Londres . Era hijo del actor de cine y televisión Eric Christmas . [18] Emigró a Toronto, Ontario , Canadá, con su familia, y fue allí a la edad de dos años que le diagnosticaron hemofilia en el Hospital para Niños Enfermos . La familia regresó a Londres en 1952 para visitar a sus familiares, y durante el viaje Stephen fue ingresado en el hospital. Una muestra de su sangre fue enviada al Centro de Hemofilia de Oxford en Oxford , donde Rosemary Biggs y Robert Gwyn Macfarlane descubrieron que no tenía deficiencia de Factor VIII , que normalmente disminuye en la hemofilia clásica, sino de una proteína diferente, que recibió el nombre de factor Christmas en su honor (y más tarde Factor IX ). [18] Stephen dependía de transfusiones de sangre y plasma , y se infectó con VIH en el período en el que no se realizaban análisis de sangre de forma rutinaria para detectar este virus. Se convirtió en un trabajador activo de la Sociedad Canadiense de Hemofilia e hizo campaña por la seguridad de las transfusiones desde que se infectó, pero desarrolló SIDA y murió a causa de esta enfermedad en 1993. [18]
En los años 1950 y 1960, con la nueva tecnología y los avances graduales en la medicina, los científicos farmacéuticos encontraron una forma de tomar el factor IX del plasma fresco congelado (PFC) y dárselo a las personas con hemofilia B. Aunque encontraron una forma de tratar la enfermedad, el FFP contenía solo una pequeña cantidad de factor IX , lo que requería grandes cantidades de FFP para tratar un episodio de sangrado real, lo que resultó en que la persona requiriera hospitalización. A mediados de la década de 1960, los científicos encontraron una forma de obtener una mayor cantidad de factor IX del FFP. A fines de la década de 1960, los científicos farmacéuticos encontraron métodos para separar el factor IX del plasma , lo que permite botellas cuidadosamente empaquetadas de concentrados de factor IX. Con el auge de los concentrados de factor IX, se hizo más fácil para las personas recibir tratamiento en casa. [19] Aunque estos avances en la medicina tuvieron un impacto positivo significativo en el tratamiento de la hemofilia, hubo muchas complicaciones que vinieron con él. A principios de los años 1980, los científicos descubrieron que los medicamentos que habían creado transmitían virus transmitidos por la sangre , como el de la hepatitis y el VIH , el virus que causa el SIDA. Con el aumento de estos virus mortales, los científicos tuvieron que encontrar métodos mejorados para analizar los productos sanguíneos que recibían de los donantes. En 1982, los científicos hicieron un gran avance en la medicina y pudieron clonar el gen del factor IX . Con este nuevo desarrollo, se redujo el riesgo de muchos virus. Aunque se creó el nuevo factor, no estuvo disponible para los pacientes con hemofilia B hasta 1997. [ cita requerida ]
En 2009, un análisis de marcadores genéticos reveló que la hemofilia B era la enfermedad de la sangre que afectaba a muchas familias reales europeas del Reino Unido, Alemania, Rusia y España: la llamada "enfermedad real". [20] [21]